硼中子俘获疗法的原理及临床应用
刘志凯,程炜诗,吴王锁,梁天骄,邢庆子,张紫竹,刘志博,刘渊豪,潘建基,朱晒红,李晴暖0,张福泉,邱 杰,霍 力
中国医学科学院北京协和医院 1放射治疗科 11核医学科,北京 100730 2兰州大学核科学与技术学院,兰州 730000 3中国科学院高能物理研究所,广东东莞 100049 4清华大学工程物理系,北京 100084 5北京核工业医院,北京 100045 6北京大学化学与分子工程学院,北京 100871 7中硼(厦门)医疗器械有限公司,福建厦门 361028 8福建医科大学,福州 350122 9中南大学湘雅三医院,长沙 410013 10中国科学院上海应用物理研究所,上海 201800
电离辐射(放疗)对细胞具有杀伤作用,人们利用这种作用治疗肿瘤,但由于恶性肿瘤具有浸润性生长的特点,放疗对邻近或受侵犯的正常组织损伤较大。核素治疗利用不同肿瘤细胞独特的生理特性,将放射性核素或标记化合物浓聚于肿瘤细胞中,从而对肿瘤进行细胞级的靶向杀伤。但核素不仅可被肿瘤特异性摄取,也可能被其他组织器官生理性摄取甚至产生富集;此外,核素经肾脏、胃肠道、肝胆、唾液腺等途径排泄,排泄过程必然会使核素富集于相应的器官并对正常器官造成损伤,这限制了核素治疗效果的提升。在上述背景下,硼中子俘获疗法(Boron neutron capture therapy,BNCT)应运而生。
1 BNCT的原理
BNCT是一项处于快速发展中的先进放疗技术,通过在细胞内发生10B(n,α)7Li原子核反应[1]杀死癌细胞,是一种原子级别的二元靶向治疗,其基本原理如图1所示。
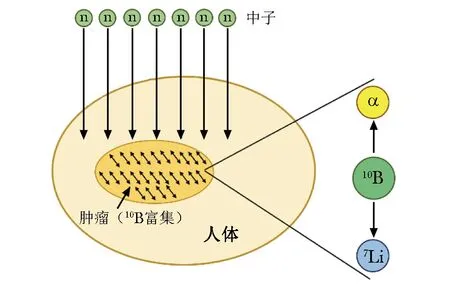
图1 硼中子俘获疗法基本原理示意图
首先给癌症患者注射一种含硼-10(10B)的特殊化合物,这种化合物在体内可选择性聚集于癌细胞内,而较少分布于正常组织中,对癌细胞具有很强的特异性亲和力。该化合物对人体的毒性很低且对肿瘤无效,但当用对人体损伤不大的热中子或超热中子束进行肿瘤局部照射时,中子即与在癌细胞内富集的10B发生10B(n,α)7Li反应[2]。BNCT生成具有极高传能线密度(linear energy transfer,LET)的α粒子和7Li反冲核,其平均LET分别为190 keV/μm和160 keV/μm。理论上,数个α粒子释放的能量即足以摧毁任何人体细胞,但在人体组织中,这些粒子仅具有一个细胞尺寸的极短射程(5~9 μm),故10B(n,α)7Li反应只能杀死内部富集了10B的肿瘤细胞,而周围正常人体组织由于10B含量很少,因此受到的损伤较小。除肿瘤细胞外,10B还可能聚集于肝脏、肾脏、唾液腺等器官,而10B本身的细胞毒性很低,可通过控制中子束照射范围以避免对正常组织造成损伤。
2 BNCT的核心技术
要完成上述核反应,需要有相应的中子源及中子俘获药物,二者是BNCT的核心要素。
2.1 中子源
中子是发生BNCT所需核反应的必要条件。根据能量不同,可将中子分为热中子(En≤0.5 eV)、超热中子(0.5 eV 产生中子的特定设备被称为中子源,其是BNCT能否成功的核心要素之一。理想的BNCT中子源应同时满足以下几个条件:(1)主要成分应为超热中子或热中子;(2)具有密度不小于109n/(cm2·s)的中子通量;(3)入射到人体后形成的热中子通量最大值应在10B富集的肿瘤区域内;(4)含有的快中子和γ射线成分应足够低;(5)准直性应足够好。目前,可应用于BNCT的中子源主要为基于反应堆的中子源[6-7]和基于加速器的中子源[8-10]。 2.1.1 基于反应堆的中子源 核反应堆利用重核裂变在其内部形成的链式反应源源不断地产生出大量中子。核反应堆产生的中子源,经过滤和慢化处理后,可得到强度大、稳定性好、纯度高的热中子束或超热中子束,这些中子束适用于BNCT相关的研究及治疗。但出于核反应堆自身安全等方面的考虑,基于核反应堆的中子源通常坐落于远离城市中心的核物理研究中心,属于非医疗环境,配套医疗设施不足;反应堆作为大型科研设备,通常还承担其他任务,难以保证其作为医疗设备的使用;此外,反应堆普遍采用高浓铀堆芯,面临老化、退役、核事故担忧等问题,维护费用高昂。因此,目前基于反应堆的中子源主要用于BNCT相关基础研究。 2.1.2 基于加速器的中子源 通过高能加速器对质子进行加速,高能质子打靶可产生中子,这种方式的中子源被称为基于加速器的中子源。其按加速器类型不同可分为射频直线加速器、回旋加速器和高压加速器3类,具有安全可靠、使用灵活方便等优势。近年来,基于加速器的中子源日渐成熟,目前已成为临床首选的中子源。 2.1.3 其他中子源 中子发生器[11]工作原理是基于氘-氘核反应(d+d→n+3He)或氘-氚核反应(d+T→n+4He),产生具有较高中子产额的单能中子束。中子发生器具有占用空间小、操作简单的优点。近年来,世界各地陆续开始研究基于射频等离子体的紧凑型中子发生器开展BNCT的可行性,但目前中子发生器的中子强度仍需进一步提高,才能满足医学治疗的要求。 BNCT的成功与否不仅取决于中子源和辐照条件,还与10B携带剂(硼药)能否在肿瘤细胞内富集密切相关。因此,选择合适的硼药也是BNCT能够取得预期临床疗效的关键。理想的硼药应具有低内在毒性、高肿瘤细胞摄取量(20~50 ppm)、高肿瘤特异性、较高的生物利用度以及适宜的脂水分配系数等特点[12-13]。此外,组织内定量释放、可追踪成像、具有良好的化学稳定性、易于长时间保存并能够进行商品化大规模生产等特点也是理想的硼药标准。 2.2.1 第一代硼药 20世纪50至60年代是BNCT发展的起步阶段,硼砂、硼酸及其衍生物作为第一代硼药在最初临床试验中用于评估BNCT对脑肿瘤的疗效[14-15]。第一代硼药使大脑中的硼浓度在到达平衡之前,存在短暂且不可控的时间段,此时肿瘤/正常组织(T/N)水平较高,可勉强进行中子辐照。然而,第一代硼药无法避免损伤机体正常组织,且其从肿瘤细胞中清除过快,造成肿瘤内硼浓度不足,因此首批BNCT临床试验以失败告终[16-17],迫切需要开发更高效的新型硼药。 2.2.2 第二代硼药 此后,研究者们致力于开发更为高效的第二代硼药,使其能够选择性地靶向肿瘤,以提高治疗效果和减少患者的不良反应。在此过程中,BPA(4-二羟基硼基-L型苯丙氨酸)和BSH(十一氢巯基十二硼化钠)两种物质脱颖而出。 BPA是一种基于氨基酸代谢途径设计的硼药,其化学结构通过模拟内源性酪氨酸参与合成特定蛋白质。其在肿瘤细胞快速增殖时能够选择性积累在与肿瘤生长相关的蛋白质中,实现与肿瘤细胞的特异性结合。由于BPA能够参与黑色素合成并被黑色素瘤细胞优先摄取,最初用于治疗皮肤黑色素瘤[18],后续研究发现BPA能携带治疗浓度的10B,靶向神经胶质瘤等多种类型的肿瘤[6,19]。BSH是一种碳硼烷类化合物,其分子结构中一般含有10个以上的硼原子,可有效提升肿瘤内的硼浓度,并具有更高的代谢稳定性且毒性更低。1967年,Soloway等[20]合成了BSH,并证明BSH具有脑肿瘤特异性。随后,研究者们采用此两种硼药进行了大量临床试验[21-22],并将BPA作为治疗高级别神经胶质瘤和头颈部复发肿瘤的首选硼药[6]。但这两种药物的肿瘤特异性仍不能完全满足BNCT药物的理想化标准。因此,寻求更高效、更具肿瘤特异性的新型硼药成为研究的热点和难点。 2.2.3 第三代硼药 20世纪70年代至今,针对第三代硼药的研究层出不穷[12-13]。随着各种类型硼化合物的相继涌现,出现了多种具有应用前景的新型硼药,包括含硼小分子药物(如氨基酸、核酸、卟啉等)、含硼生物大分子药物(如多肽、抗体等)以及含硼纳米药物(如脂质体、MOF、COF等)等。尽管在体外和动物实验中取得了令人鼓舞的结果,这些药物的发展仍面临诸多瓶颈,例如小分子药物含硼量不足和含硼纳米药物的代谢时间较长等问题。随着诊疗一体化时代的到来,研究者们需继续努力开发T/N高、生物相容性好的生物大分子,以推动BNCT在肿瘤治疗中的进一步应用。 上述所有研发的药物在进行BNCT临床应用前,均需经过安全、微量、生物学特征相似的PET/CT显像剂(pmol级)检测以证实新研发的药物(mg级)适用于BNCT临床治疗。PET/CT显像剂可动态观察血中硼浓度以间接反映肿瘤摄取特点,通过图形图像分析为BNCT的治疗过程提供半定量指标及动态数学模型,同时为制订精准的个体化治疗计划提供影像数据支持。通过发挥无创、在体评估肿瘤摄取硼药水平等优势,PET/CT可推进BNCT临床试验的进一步发展。 3.1.1 评估硼药组织分布 并非所有肿瘤均能特异性高摄取硼药,治疗前需了解硼药的组织分布情况。以临床常用的硼药L-BPA为例,可使用L-18F-FBPA PET/CT影像技术了解L-BPA体内及肿瘤内组织分布情况。L-18F-FBPA是L-BPA的类似物,二者在人体内生物学特性基本相似,由于18F射线能够被正电子显像设备PET/CT捕获并成像,因此临床使用L-18F-FBPA PET/CT在L-BPA BNCT治疗前观察体内肿瘤与周围正常组织L-BPA摄取情况。此外,L-18F-FBPA PET/CT的半定量参数,如靶肿瘤与正常组织比(tumor to normal tissue ratio,TNR)和标准摄取值(standard uptake value,SUV),可预测肿瘤中BPA的蓄积量、最佳外照射时间、BPA在不同器官中的生物分布,通常TNR>2.5被认为可能从BNCT中获益,TNR>3则可能更佳,反之认为不能从BNCT中获益[23]。在多项胶质瘤、黑色素瘤脑转移、头颈部肿瘤的临床试验[24]中,L-18F-FBPA PET/CT用于治疗前观察肿瘤的摄取情况,筛选合适的患者,BNCT后再次行L-18F-FBPA PET/CT可协助判断患者是否可进行多次BNCT治疗。L-18F-FBPA PET/CT还可用于照射野内肿瘤治疗剂量的计算和治疗规划。因此,借助核医学技术能够监测硼药在肿瘤和正常组织中的分布情况,提高BNCT精准诊疗效率。 3.1.2 评估硼药时间动态分布 硼药在体内的分布随时间变化而变化,制订BNCT治疗方案需将时间因素考虑在内。L-18F-FBPA的多时间点或动态显像可动态获取肿瘤硼浓度、健康组织硼浓度、血硼浓度的关系,进行药代动力学研究,协助无创、在体获取肿瘤硼浓度变化,为建立BNCT生物靶向适形调强的个体化治疗方案提供了必要条件,还可在治疗中评估疗效。 治疗实施时,实时动态、在体监测肿瘤及正常组织内硼含量的变化至关重要。在BNCT治疗中,10B俘获热中子发生10B(n,α)7Li核反应,释放出高线性能量转移的α粒子和7Li粒子,7Li粒子进一步衰变发射478 keV的瞬发γ射线。瞬发γ射线分析通过监测γ射线计数可测定样本中平均或总体10B含量,但无法分析不同部位的10B含量[25]。PG-SPECT(prompt Gamma-single photon emission computed tomography)可将SPECT技术与瞬发γ射线分析结合,从而获得肿瘤、正常组织内的10B含量,实现治疗中10B含量的监测。这一技术对准直器、探测器、图像重建算法等均有较高要求,目前仍在研发中。未来,联合BNCT治疗所需的中子源相关设备与治疗过程中实时定量监测的PG-SPECT系统将对BNCT治疗起到重大推进作用。 BNCT治疗顺利实施需要一套能够完整运行的BNCT治疗装置,其子系统通常包括治疗计划系统、照射剂量监控系统、患者摆位系统与图像引导系统。 3.2.1 治疗计划系统 BNCT治疗需要高度整合的照射实施技术,因此相较于传统放疗技术,BNCT的治疗计划系统需与患者定位摆位装置、中子束装置、照射控制系统等充分整合,才能够达到正确的剂量计算,顺利实施照射。治疗计划系统是一套用以制订、计算与规划照射治疗方案的软件,主要包括图像处理、模体构建、剂量计算引擎、剂量后处理与显示、报告产生等模块。目前国际上主要使用或在开发的治疗计划系统包括SERA(已终止开发)、NCTPlan(已终止开发)、JCDS (已终止开发)、THORPlan、TsukubaPlan、NeuMANTA、NeuCure、RayStation(开发中)。 3.2.2 照射剂量监控系统 BNCT照射实施过程需对照射剂量进行监控,此时需要两个重要的子系统对剂量实施监测、计算及控制。这两个子系统又统称为BNCT照射控制系统,或医疗用户控制系统,对中子束的辐照情形进行探知与累积剂量计算,并实时调控(包括降低、提高、中止中子束流等手段)照射条件,以及在给定时间范围内按照处方剂量完成精确照射。 3.2.3 治疗摆位系统 患者治疗摆位系统(patient positioning system,PPS)是提高BNCT治疗效率和患者周转率的关键。其不仅影响设备的患者周转率(每年可治疗人数),同时可影响患者及医务人员(如物理师、护士及医师)的暴露风险。由于目前BNCT装备使用的是固定式的中子束,因此PPS的摆位自由度会直接影响BNCT装备施照的角度与对应病灶位置。一般建议采用具备5个以上自由度且可达到毫米级甚至亚毫米级精确度的摆位系统,同时应考虑患者受照射时的稳固性及舒适度。 目前国内外PPS解决方案包括:(1)简易治疗床或治疗椅:带轮子、可移动,患者定位需有参考基座(docking base)供固定与校准。治疗床以躺姿进行照射,治疗椅则采用坐姿。(2)移动轨道车搭配可变床板:轨道车搭载患者在准备舱与治疗舱之间移动。患者在准备舱进行定位,随后移动至治疗舱进行照射,结束后再移回准备舱。可以躺姿或转变成坐姿进行照射。(3)照射机器人手臂搭配床板:利用一个高承载、高精密的机器人手臂搭载一个可变或固定床板,用以移动患者至照射位置。 3.2.4 图像引导系统 BNCT可能并不需要传统加速器的三维图像引导系统。BNCT对于照射位置的准确性要求比传统放疗及质子治疗更低,通常5 mm左右的位置误差对治疗不会造成有临床意义的影响。BNCT的剂量分布首先来自于含硼靶向药物分布,也就是生物靶区自勾画,其次是中子束的多照野辅助。这与传统放疗及粒子治疗显著不同;粒子治疗及光子治疗是利用小束或经多叶光栅等限束装置适形,对勾勒的靶区进行物理剂量投射。中子束在照射过程中对物质产生活化,同时可能损伤晶体,因此BNCT对于CT或MRI成像的图像引导系统并无明确需求。 然而,当中子与10B发生俘获反应时,可释放出0.478 MeV的光子,而对单光子进行探测与成像可帮助测算与辅助验证治疗过程实际的硼中子反应(正比于硼剂量)情形。因此PG-SPECT在线图像系统对于BNCT具有重要帮助,目前这项技术仍在研发中。 相较于传统放疗,BNCT具有如下特点:(1)精准靶向能力达细胞水平,对肿瘤细胞周围健康组织损伤小;(2)相对生物学效应较高,对于部分传统放疗不敏感的肿瘤也能取得良好疗效;(3)疗程短,通常数次治疗即可,最短疗程为1次。BNCT目前尚未被广泛应用于临床,一些小样本临床研究提示对于某些特定患者,BNCT能够取得优于传统放疗的疗效。从机理方面分析,BNCT的适应证主要取决于所使用中子束照射系统特性(通量和射程)和硼药在肿瘤内的聚集程度。用于BNCT的药物需具有较好的靶向性,即能够聚集于肿瘤组织,正常组织分布少且清除快。在BNCT治疗中,L-18F-FBPA PET/CT的T/N值>2.5被视为判断BNCT适应证的重要指标,但也有T/N≤2.5获得完全缓解或部分缓解的病例报道。 目前BNCT的临床研究主要集中于局部复发肿瘤的治疗。目前使用硼药(BPA和BSH)和照射系统(反应堆和AB-BNCT)的临床研究结果表明,BNCT在中枢神经系统肿瘤、头颈部肿瘤、皮肤和黏膜恶性黑色素瘤中具有突出优势。 4.1.1 中枢神经系统肿瘤 胶质母细胞瘤是最常见且致死率极高的中枢神经系统恶性肿瘤,中位生存期(median survival time,MST)约为14个月。BNCT被认为是新诊断和复发性脑胶质母细胞瘤的治疗新选择。欧洲和美国学者开展的Ⅰ/Ⅱ期临床研究结果表明,新诊断的脑胶质母细胞瘤患者术后BNCT治疗与标准放化疗方案(Stupp方案)生存时间相当[26]。日本多项临床研究[27-28]表明,BNCT联合X线放疗、替莫唑胺化疗方案治疗脑胶质母细胞瘤的MST可延长至19.5~25.7个月。复发性脑胶质瘤的预后极差,手术、放疗和标准化疗疗效欠佳。日本大阪医学院[29]采用BPA-BNCT治疗复发性脑胶质母细胞瘤的MST为10.8个月,联用BPA-BNCT和BSH-BNCT治疗的MST为15.6个月,联合X线放疗的MST可达23.5个月。日本多中心Ⅱ期临床试验(JG002)[30]纳入27例标准治疗后复发且未曾使用过贝伐单抗的脑胶质瘤患者(其中24例为胶质母细胞瘤),使用BPA-BNCT治疗,1年生存率和MST分别为79.2% 和18.7个月,最主要的副作用为脑水肿。 脑膜瘤是成人最常见的中枢神经系统肿瘤,大多为良性,但高级别脑膜瘤(WHO分级为Ⅱ级或Ⅲ级)侵袭性强,局部控制率和总体生存率均较低。2005—2014年间日本大阪医学院一项回顾性研究[31]显示,31例复发性高级别脑膜瘤患者采用BNCT治疗2个月后,平均体积减少64.5%,MST为24.6个月。 4.1.2 头颈部肿瘤 在日本、芬兰及我国台湾地区已报道的头颈部肿瘤临床研究中,BNCT显示出了良好疗效。日本学者Suzuki等[32]2001—2007年采用BNCT治疗62例局部复发或不能切除的头颈部肿瘤患者,治疗后6个月的总反应率为58%,MST为10.1个月,平均生存期为18.7个月。而日本学者Kato等[33]则报道了BNCT治疗26例头颈部肿瘤的总体有效率为85%,患者生活质量得到改善。2019年6月,日本南东北BNCT研究中心报道了AB-BNCT的 Ⅱ 期临床试验结果[34],研究纳入不能手术、对铂类化疗有耐药性的复发性头颈部鳞状细胞癌患者8例和不能手术、复发性/局部晚期非鳞状细胞癌患者13例,客观缓解率分别为75.0%和69.2%。2020年3月,日本国家药监部门批准BNCT可用于无法手术的复发性头颈部肿瘤的临床治疗。 4.1.3 黑色素瘤 黑色素瘤是由黑色素细胞异常过度增生引发的皮肤恶性肿瘤,其恶性程度高,易复发和转移,预后极差。阿根廷Menéndez等[35]报告了2003—2007年7例接受BNCT治疗的黑色素瘤患者,按照14 g/m2L-BPA剂量90 min内注射完毕,总体有效率为69%,3级毒性(溃疡)率为30%。我国中南大学湘雅三医院2013年启动了一项“BNCT对黑色素瘤患者的有效性和安全性临床试验”,2014年8月首例左侧足部浅表扩散型恶性黑色素瘤患者采用350 mg/kg的剂量静脉注射BPA,中子照射20 min。患者在BNCT后1周仅出现轻度头皮屑,4周时发展为2级皮炎,9个月时活检以及25个月时PET扫描均未发现肿瘤[36]。 4.1.4 其他肿瘤 BNCT在除上述肿瘤治疗中发挥重要作用外,其在胸部肿瘤、骨软组织肉瘤、乳腺癌、膀胱癌和儿童肿瘤等方面的临床探索性研究也在进行中。 (1)胸部肿瘤 Suzuki等[37]报道了2例弥漫型胸膜肿瘤患者(包括恶性胸膜间皮瘤1例,恶性短梭形细胞瘤1例),BNCT治疗后随访6个月,肿瘤稳定或消退,未出现3级急性或晚期毒性反应。这项研究证实BNCT是弥漫型、不可切除的恶性胸膜间皮瘤的有效治疗手段,但对于深部胸部肿瘤,BNCT的治疗效果仍待探究。 (2)乳腺癌 Seneviratne等[38]研究表明,BNCT可能是人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)过度表达的乳腺癌潜在治疗方式。有研究表明,运用免疫脂质体(如曲妥珠单抗修饰的脂质体)作为硼携带剂,可选择性地与表达HER-2的癌细胞结合,此外,剂量分析显示BNCT对局部复发性乳腺癌具有治疗可能性[39-40]。但其安全性和有效性有待进一步临床研究加以验证。 (3)骨软组织肉瘤 Futamura等[41]报道了1例复发性辐射诱导的枕骨肉瘤患者,按照500 mg/kg剂量静脉注射BPA药物,患者在诊断性检查时有严重行走障碍,BNCT治疗3周后,能够无辅助地稳定行走。治疗过程中患者耐受性良好,无皮肤损伤,证明BNCT是骨肉瘤安全可行的治疗方法。恶性外周神经鞘瘤是一种罕见的高度侵袭性软组织肿瘤,目前尚无标准治疗方案,外科手术是唯一确定的有效治疗方法,但预后较差。日本学者报道了一例手术后复发、化疗无效的胸腔纵膈外周神经鞘膜瘤患者[42],病灶位于右锁骨上窝,接受2次BNCT治疗后2年内无复发。 (4)乳腺外Paget病 对于生殖器区的黑色素瘤和乳腺外Paget病(extramammary Paget’s disease,EMPD),广泛性手术切除病变是目前最常推荐的治疗方法,但该方法创伤大并可导致功能性问题。当手术不可行时,迫切需要新的替代疗法。日本京都大学报道了4例接受BNCT治疗的生殖器恶性肿瘤患者(包括1例外阴黑色素瘤和3例生殖器EMPD),均在治疗6个月内达到完全缓解[43]。因此,BNCT是生殖器区原发性外阴黑色素瘤和EMPD颇具前景的治疗方法。 (5)儿童恶性脑肿瘤 Nakagawa等[44]的研究中,共有23例年龄<15岁(其中4例<3岁)的恶性脑肿瘤患者接受BNCT治疗,包括胶质母细胞瘤3例、间变性星形细胞瘤6例、原始神经外胚层肿瘤7例、脑桥胶质瘤6例、间变性室管膜瘤1例,4例治疗后无复发迹象。因此,BNCT被认为是儿童恶性脑肿瘤的最佳治疗方法。 硼药对肿瘤细胞的高选择性,使BNCT治疗后的不良反应发生率及其严重程度均低于常规放射治疗。现阶段,皮肤浅表肿瘤BNCT治疗最常见的副反应为轻度皮肤放射性损伤,表现为照射部位皮肤干燥、脱屑,可伴有潮红、发痒。由于患者相同部位仅需照射1~2次,照射剂量有限,通常1~4周内皮肤状况可自行改善,无需特殊处理。头颈部或其他深部肿瘤接受BNCT治疗的患者,常见副反应为口腔黏膜炎、局部脱发,这些症状程度均较轻且可自行缓解。少数患者可出现头晕、乏力等神经系统症状或其他Ⅲ、Ⅳ级严重并发症,需积极对症治疗。 BNCT从原理上讲是一种极具前景的肿瘤治疗手段。在20世纪,受限于技术水平,仅少量患者能够接受BNCT治疗并从中获益。小规模的临床研究表明,BNCT是中枢神经系统肿瘤、头颈部肿瘤、皮肤和黏膜恶性黑色素瘤等肿瘤的有效治疗方法。近年来,随着基于加速器的中子源和硼药技术的进步、核医学及治疗实施装置与技术的成熟,新型BNCT治疗中心在国内外均如雨后春笋般蓬勃发展。这些中心能够依托于成熟的肿瘤治疗机构,大大提升BNCT治疗的可及性。未来全球研究者可基于新型BNCT治疗中心开展更高质量的临床试验,探索适应证及副反应,通过临床实践对技术发展作出反馈,不断修正技术路线、完善技术细节,最终使BNCT作为常规可选的治疗手段应用于临床,使更多患者受益。 作者贡献:刘志凯负责设计论文框架,调研整理文献,撰写论文初稿及修订论文;程炜诗负责调研整理文献,参与撰写论文初稿及论文修订;吴王锁、梁天骄、邢庆子、张紫竹、刘志博、刘渊豪、潘建基、朱晒红、李晴暖、张福泉、邱杰负责调研整理文献;霍力负责指导修订、审核论文。 利益冲突:所有作者均声明不存在利益冲突2.2 中子俘获药物
3 BNCT的临床评估与实施
3.1 临床评估
3.2 临床实施装置与技术
4 BNCT适应证及副反应
4.1 主要适应证
4.2 常见副反应
5 小结与展望

