肺磨玻璃结节的高分辨率CT特征及鉴别肺腺癌的价值
钱国伟 福建省南平市建阳第一医院 354200
肺癌作为发病率排名首位的恶性肿瘤,其病死率非常高且呈逐年增高趋势,对人们的生命安全及身心健康极具威胁[1]。随着我国人们体检普及率的增长,越来越多的人开始重视肺癌的早期筛查。美国胸协会、欧洲呼吸学会及国际肺癌研究协会于2011年将肺腺癌重新分为浸润前病变及浸润性病变,前者包含不典型腺瘤样增生(AAH)及原位癌(AIS),后者包含微浸润性病变(MIA)及浸润性病变(IAC)。每种类型意味诊疗方案及手术切除范围的不同,同时对5年生存率亦存在影响,故此术前对于GGN诊断极其重要[2]。肺癌常用临床监测方法为CT,经过多层螺旋CT技术快速更新,传统CT逐步呈现高分辨率CT(HRCT)的功能,其可清晰显现与实体标本相似的肺组织细微结。肺磨玻璃结节(GGN)是通过HRCT影响结果呈现不掩盖其内部支气管血管束的肺内局限性密度增高影,其可呈现一般直径2~3mm的多发或单发半透明玻璃状影,内见支气管壁影或血管[3]。基于此,为分析GGN于HRCT特征及鉴别肺腺癌的临床价值,笔者回顾性收集2018年6月—2021年6月期间我院收治150例肺腺癌患者临床资料纳入研究,现报道如下。
1 资料与方法
1.1 一般资料 本研究经我院伦理委员会批准,回顾性收集2018年6月—2021年6月期间我院收治的疑似肺腺癌患者临床资料。 纳入标准:(1)HRCT检查影响结果显示存在GGN;(2)GGN为<3mm,且HRCT影像显示无肉眼可见伪影;(3)术中病理结果确诊肺腺癌;(4)临床资料足够满足本次研究。排除标准:(1)存在CT扫描禁忌;(2)合并其他恶性肿瘤;(3)肿瘤已出现侵犯血管、胸膜、淋巴结系统或出现肿瘤坏死;(4)妊娠或哺乳期女性。最终150例肺腺癌患者纳入研究,据病理结果类型分为浸润前组(59例)及浸润组(91例)。浸润前组中男20例,女39例;年龄36~72岁,平均年龄(54.18±6.24)岁;家族史:有22例,无37例;吸烟史:有7例,无52例。浸润组中男33例,女58例;年龄38~75岁,平均年龄(52.86±6.37)岁;家族史:有36例,无55例;吸烟史:有19例,无72例。两组一般资料对比无显著差异(P>0.05)。
1.2 方法
1.2.1 HRCT扫描。以多层螺旋CTNeuViz 16 CT于患者深吸气下屏气进行胸部扫描。嘱患者平卧后屏气,自肺尖至膈顶以肺窗位-600HU、窗宽1 600HU、管电流200mAs及管电压120kV进行扫描。扫描结束后,将非离子型对比剂(武汉曙尔生物科技有限公司生产,1.5ml/kg)以2.5ml/s高压注射于肘静脉后增强扫描,分别于注射结束后30s与90s扫描。结束后将所有薄层图像重建进行测量,层厚1.5mm,CT成像采用标准算法与高分辨骨算法。
1.2.2 影像评估及病理检查。所有图像特征在预先不告知患者病历资料情况下以2位肺癌影像诊断经验超过10年的医生共同分析位置、大小、边缘、形态、结节内部扩张小血管及支气管、实性成分最大直径及比值、胸膜牵拉进行判断,若意见相同则记录下来,若意见相左,则与肺癌影像诊断经验超过15年的医生讨论分析,最终记录一致意见。术中病理确诊:术前以微量亚甲蓝注射病灶及CT引导针穿刺进行双重定位,定位成功后行胸腔镜手术。术中将切除的采样淋巴结及肺组织以快速冰冻病理进行检测。当检测结果为良性或不典型腺瘤样增生(AAH),则可结束手术,若检测结果为原位癌(AIS) 及微浸润性病变(MIA) 则继续手术进行淋巴结清扫;若检测结果为浸润性病变(IAC),则继续手术将病变侧肺叶全部切除与淋巴结清扫。术后需将术中切除的淋巴结组织及肺组织重新进行病理学检查,再次确定浸润情况及结节病变类型。
1.3 观察指标 (1)观察和统计所有患者HRCT特征及影像学参数,包括形状、位置、边缘、胸膜牵拉、扩张小支气管、扩张小血管、结节大小、实性成分最大直径及实性成分最大直径占比;(2)采用Logistic回归分析HRCT特征与肺腺癌浸润性的关系;(3)单绘制 ROC 曲线分析HRCT特征鉴别肺腺癌浸润性的价值。

2 结果
2.1 HRCT影像学特征 两组在位置、扩张小支气管方面无显著差异(P>0.05),而在形状、边缘、胸膜牵拉、扩张小血管等方面差异具统计学意义(P<0.05),见表1。

表1 两组HRCT影像学特征对比[n(%)]
2.2 HRCT影像学参数 浸润前组结节大小、实性成分最大直径及其占比均显著低于浸润组(P<0.05),见表2。
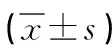
表2 两组HRCT影像学参数对比
2.3 HRCT影像学与肺腺癌病理结果的Logistic回归分析 以形状(圆形=1、不规则=2、分叶状=3)、边缘(光滑=0、毛刺=1、模糊=2)、胸膜牵拉(有=1、无=0)、扩张小血管(有=1、无=0)、结节大小(连续变量)、实性成分最大直径(连续变量)及实性成分最大直径占比(连续变量)为协变量,肺腺癌病理结果(浸润前=0、浸润=1)为因变量行Logistic回归分析。结果显示形状、胸膜牵拉、实性成分最大直径及实性成分最大直径占比均为肺腺癌的独立影响因素,见表3。

表3 HRCT影像学与肺腺癌病理结果的Logistic回归分析
2.4 HRCT特征对肺腺癌浸润性的鉴别价值分析 ROC曲线分析结果显示,单一HRCT特征鉴别肺腺癌浸润性时,以实性成分最大直径占比的AUC值最高,但与形状、胸膜牵拉、实性成分最大直径的AUC比较差异无统计学意义(Z=1.741、1.360、0.563,P=0.082、0.174、0.574),以56%为截断值,其鉴别肺腺癌浸润性的敏感度为45.05%、特异度为88.14%。见表4。

表4 HRCT特征对肺腺癌浸润性的鉴别价值分析
3 讨论
GGN并不是疾病的准确名称,而是机体肺部疾病的一种影像学改变,表现为肺内局限性淡薄的密度增高影,但其未掩盖其中的支气管束及血管[4]。其可能为出血、炎症等良性病变,也可能为原位癌或浸润性癌变等恶性病变,常常不同诊断结果意味着不一样的处理方案及对于患者预后判断[5]。目前,临床确诊肺腺癌的诊断依据为穿刺活检,然其属于一种有创手段,可能引起血胸、气胸等并发症,故此,许多专家希望通过分析患者GGN的HRCT影像特征来判断疾病良恶性、病变程度及浸润性[6]。
本研究结果显示,浸润前组及浸润组在形状、边缘、胸膜牵拉、扩张小血管等方面具有显著差异,Logistic回归分析结果也显示,形状、胸膜牵拉为肺腺癌的独立影响因素,其病变风险增加至1.369倍、1.592倍。另有报道显示,GGN恶性病变中出现胸膜牵拉概率远高于良性病变,且恶化等级越高出现胸膜牵拉概率越高。良性病变常边缘光滑少见模糊或毛刺,其多可见部分点状钙化,可能存在周围胸膜粘连肥厚的情况,而恶性病变中,形状不规则或分叶状都是较为多见且存在边缘粗糙或弧形凹陷[7]。分叶征又因癌性细胞分化差异分为深分叶和浅分叶,肺内结缔组织间隔影响病变区域的生长发育而出现延伸至肺部的凹陷为深分叶,其于临床诊断异常关键[8]。本研究ROC曲线也显示,形状、胸膜牵拉鉴别肺腺癌浸润性的AUC分别为0.610、0.635,但形状、胸膜牵拉鉴别肺腺癌的敏感度欠佳,分别为59.34%、47.25%。另有研究显示,当病变侵犯胸膜可致使胸膜出现肿瘤内部结缔组织增生反应,而致使病灶中心纤维化对胸膜形成牵拉,影像学结果表现为肿瘤周围条索纤维化改变样[9]。
病变中实性成分大小常为临床鉴别GGN良恶性的重要指标之一,其中实性成分常代表肿瘤对于机体的入侵部分。李鲁等[10]将GGN中实性成分于病变部位占比进行研究,结果显示当其占比超过50%,提示确诊浸润性肺腺癌概率大大增高,且淋巴转移概率可达21%~26%。本研究HRCT影像学计量资料对比结果显示,浸润前组实性成分最大直径及其占比均显著低于浸润组,且Logistic回归分析结果也显示实质成分最大直径及实性成分最大直径占比均为肺腺癌的独立影响因素,与既往研究结果一致。然两组性别、年龄、家族史及吸烟史均无显著差异,可能与本次研究样本量较少无法显现差异有关。本研究ROC曲线显示实质成分最大直径及实性成分最大直径占比鉴别肺腺癌的AUC分别为0.684、0.716。其中实性成分最大直径占比的AUC值最高,但与形状、胸膜牵拉、实性成分最大直径的AUC比较差异无统计学意义,以56%为截断值,其鉴别肺腺癌浸润性的敏感度为45.05%,特异度为88.14%。
综上所述,肺腺癌是由浸润前病变逐渐转变为浸润性病变的一个过程,影像学结果显示结节形状、胸膜牵拉、实质成分最大直径及实性成分最大直径占比均为肺腺癌的独立影响因素,可判断肺腺癌是浸润前病变还是已经进行致浸润性病变,可为临床医者为患者制定手术方案提供参考依据。本研究不足之处在于样本量偏小且作为回顾性研究,样本资料可能存在偏倚,后续研究会扩大病例范围,增加样本量,望早日将肺腺癌影像判断标准统一化。

