抗病和感病香蕉品种根系内生细菌群落结构与多样性
张艳 曾凤花 农倩 覃丽萍 窦同心 邱美莎 谢玲

摘要:【目的】分析抗病和感病香蕉品種根系内生细菌群落结构与多样性,探究香蕉抗枯萎病能力与香蕉根系微生物组的关联,为发掘利用香蕉枯萎病土著生防微生物组提供理论依据。【方法】以香蕉枯萎病感病品种威廉斯B6和抗病品种中蕉9号为材料,在枯萎病发病初期(营养生长旺盛期)和发病严重期(孕蕾期)采集香蕉根系,采样前均调查香蕉发病情况;分别提取抗病和感病香蕉植株根系DNA,利用高通量测序技术对香蕉根系内生细菌16S rRNA基因V3~V4区进行测序分析,通过Fastp和Flash软件对原始测序序列进行质控、拼接,利用RDP classifier和Silva数据库对序列进行比对、注释,采用Excel 2010对数据进行整理统计,运用DPS 7.0进行差异显著性分析。【结果】随着香蕉的生长发育和枯萎病的越发严重,抗病品种中蕉9号在生长过程中相对感病品种威廉斯B6表现出极显著(P<0.01)的抗病能力。测序获得的2568个OTUs分属于32门89纲220目369科673属1139种。Alpha多样性和物种组成分析结果表明,抗病品种中蕉9号根系细菌多样性高于感病品种威廉斯B6,但差异不显著(P>0.05)。2个品种根系细菌群落在发病初期和严重期的优势菌门无差异,但相对丰度随着香蕉的生长发生显著变化(P<0.05,下同)。在发病初期,感病和抗病香蕉植株根系细菌群落中主要优势菌属较单一;发病严重期细菌群落组成较丰富,其中抗病品种中有益微生物链霉菌属(Streptomyces)、拟无枝菌酸菌属(Amycolatopsis)和短杆菌属(Brevibacterium)的相对丰度显著增加,分析发现短杆菌属只在抗病品种香蕉根系中特异富集。NMDS和PCoA分析表明,感病与抗病香蕉植株根系细菌群落结构在发病初期大致相同,到发病严重期时2个品种间内生细菌群落结构具有显著差异。【结论】感病与抗病香蕉植株根系内生细菌群落结构随着生长发育和发病进程而变化,优势菌门和菌属群落组成变化较大且差异显著,尤其是抗病品种中有益微生的相对丰度显著增加。感病与抗病香蕉植株根系微生物结构组成变化对香蕉枯萎病的发生有较大影响,特异微生物的富集对香蕉抗枯萎病产生直接或间接的影响。
关键词:香蕉枯萎病;高通量测序;内生细菌;群落结构多样性
中图分类号:S182;S436.681 文献标志码: A 文章编号:2095-1191(2023)02-0365-11
Abstract:【Objective】To analyze the community structure and diversity of endophytic bacteria in banana roots of resistant and susceptible banana varieties and explore the association between resistance to fusarium wilt and the root microbiome of banana, which would provide theoretical basis for exploiting and utilizing indigenous biocontrol microbiome of banana fusarium wilt. 【Method】The banana fusarium wilt susceptible variety Williams B6 and resistant variety Zhongjiao 9 were used as materials. The banana root system was collected at the initial stage of fusarium wilt (the period of vigorous vegetative growth) and the severe stage(the period of gestational bud stage), the incidence of banana was investigated before two sampling; the root DNA of susceptible and disease-resistant banana plants was extracted respectively. The V3-V4 region of 16S rRNA gene of endophytic bacteria in banana roots was sequenced by high-throughput sequencing technology. Raw sequencing files were quality-filtered by Fastp and merged by Flash. The taxonomy of each 16S rRNA gene sequence was compared and annotated by RDP classifier algorithm against the Silva 16S rRNA database. Excel 2010 was used to analyze the data, and DPS 7.0 software was used for significant difference analysis. 【Result】With the growth and development of banana, the fusarium wilt became more and more serious, and the resistant variety Zhongjiao 9 showed extremely significant(P<0.01) disease resistance compared with the susceptible variety Williams B6 during the growth process. A total of 2568 OTUs were obtained by high-throughput sequencing, which belonged to 1139 species, 673 genera, 369 families, 220 orders, 89 classes, and 32 phyla. The results of Alpha diversity and species composition analysis showed that the root bacteria diversity of resistant variety Zhongjiao 9 was higher than that of susceptible variety Williams B6, but the differences was not significant(P>0.05). There was no difference in the dominant bacterial phyla of root bacterial community between the two varieties at the initial stage and the severe stage, however, the relative abundances changed significantly with the growth of bananas(P<0.05, the same below). At the initial stage, the main dominant bacterial genus in the root system of susceptible and disease-resistant bananas was relatively single, while the bacterial community composition in the severe stage was more abundant, the relative adundance of beneficial microorganism Streptomyces, Bacteroides and Brevibacterium increased significantly in the resistant banana variety, genus Brevibacterium was found and enriched only in the roots of resistant variety. NMDS and PCoA analysis showed that the community structure of endophytic bacteria in the disease initial stage was basiclly the same, and the community structure of endophytic bacteria of disease-resistant variety in the severe disease stage was significantly different from the other treatment group. 【Conclusion】The community structure of endophytic bacteria in the root of susceptible and disease-resistant banana changes with the progression of the disease process. The community composition of dominant phyla and genera vary significantly, especially the relative abundance of beneficial microorganism increas significantly in resistant variety. The variation of root microbial structure of susceptible and resistant banana have great effect on the occurrence of fusarium wilt, and the accumulation of specific microorganisms has direct or indirect effect on fusarium wilt resistance of banana.
Key words: banana fusarium wilt; high-throughput sequencing; endophytic bacteria; diversity of community structure
Foundation items:National Natural Science Foundation of China (32260008); Guangxi Natural Science Foundation (2019GXNSFAA185051); Basic Research Project of Guangxi Academy of Agricultural Sciences (Guinongke 2020YM77, Guinongke 2021YT065)
0 引言
【研究意义】香蕉(Musa spp.)是重要的热带和亚热带水果。统计数据表明,2020年我国香蕉种植面积达32.72万ha,产量约1151.3万t,广西作为我国香蕉主产区之一,2020年种植面积达7.75万ha,产量约311.0万t(张放,2021)。然而,近年来有“香蕉癌症”之称的香蕉枯萎病给我国香蕉产业带来了毁灭性打击。香蕉枯萎病是由古巴专化型尖孢镰刀菌(Fusarium oxysporum f. sp. cubense)侵染引起植株凋萎、维管束坏死的毁灭性土传病害(Ploetz et al.,2006),截至2019年5月,香蕉枯萎病在我国所有的香蕉主产区均有报道,此病害给香蕉产业造成了重大影响,严重时甚至绝收(李华平等,2019;杜浩等,2020),已成為制约我国香蕉生产的最重要因素。由于化学防治效果不理想,加上抗病、高产和品质在育种中难以兼顾和突破,因此,安全、环境友好的生物防治一直是学者们的研究热点。目前对作物枯萎病的生防研究主要集中在两个方面,一是利用生物体中的“活性物质”进行枯萎病防治,如利用甲壳素(Roller and Covill,1999)、壳聚糖(徐鹏,2007)、外源褪黑素(Wei et al.,2017)、竹荪粗提物(刘范等,2018)或韭菜(王彤,2018)等抑制香蕉枯萎病的发生;二是筛选并利用拮抗菌防治枯萎病,当前研究的主要有绿脓杆菌(Sekhar and Thomas,2015)、链霉菌(周登博等,2017)、芽孢杆菌(卢亭君等,2018;赵志祥等,2022)、荧光假单胞菌(Khan et al.,2018)、木霉(叶乃玮等,2019;曹鹏飞和刘青娥,2021)、放线菌(赖宝春等,2020)和短短芽孢杆菌(张涵等,2022)等生防菌。现有的生防菌剂大多由1种或2~4种微生物混合而成,易受环境因素的影响,在田间的生防效果并不稳定。研究表明,在土壤环境中进行生物防治时,发挥有效作用的微生物类群较复杂,多种益生菌与宿主植物之间存在复杂的作用关系(Mendes et al.,2011)。自然界中,正常生长的农作物表面和内部的微生物总和称之为农作物微生物组(Müller et al.,2016)。这些微生物通过协作和竞争等作用方式形成稳定的群落结构,对作物生长发育、抗病、抗逆至关重要,但目前人类对于绝大部分作物表面及内生微生物与植物抗病之间的联系知之甚少(Philippot et al.,2013)。对于香蕉而言,香蕉植株上的微生物组与香蕉抗枯萎病之间的联系亦是许多研究者探索的热点。因此,开展抗病和感病香蕉品种根系内生细菌群落结构及其多样性研究,挖掘香蕉枯萎病生防微生物,对香蕉枯萎病的生物防治具有重要意义。【前人研究进展】前人关于内生微生物对植物病害的影响有较多报道。吴思梦(2018)通过Illumina高通量测序技术分析抗/感溃疡病柑橘的内生细菌菌群,发现抗病、感病品种植株组织中的内生细菌群落存在一定差异,抗病品种中含有更多拮抗作用的内生细菌,感病品种中除拮抗菌外还存在感病协同菌,初步认定内生细菌的差异是影响寄主抗溃疡病能力的因素;Kwak等(2018)研究发现番茄青枯病抗病品种与感病品种的根际微生物组结构存在差异,通过二者微生物组的互相移植以及菌株的功能验证,证明根际微生物组参与了植物的抗病过程,即抗病品种特异富集的微生物群可保护宿主免受病原菌侵害。香蕉植株内生微生物(病原菌或生防菌)对香蕉病害的影响也有较多报道。李梅婷(2007)通过研究香蕉根际及内生菌的菌群结构以及内生菌群与香蕉病害的相关性,查明了内生炭疽菌具有潜伏侵染特性,对香蕉有致病性,香蕉内生镰刀菌无致病性,与香蕉枯萎病菌无亲和性;许乐等(2012)通过基于16S rRNA的末端标记限制性片段长度多态性技术分析香蕉枯萎病健康和感病植株中内生细菌的多样性,发现抗病品种比感病品种具有更丰富多样且更稳定的内生细菌群落,而且不同抗性品种中健康与感病植株内的优势种群存在明显差异;农倩等(2017)在前期研究中筛选获得了抗香蕉枯萎病的深色有隔内生真菌(DSE)菌株L-14,接种于香蕉植株后可显著降低田间香蕉苗枯萎病的发病率,L-14可定殖在香蕉的根系,但并不产生抑制病原菌生长的拮抗物质,而是诱导香蕉植株产生了系统抗病性,可见,香蕉根系内生微生物可能在枯萎病抗病过程中扮演着较重要的生态角色;陈艳露等(2022)对广西香蕉主产区的香蕉根系进行内生真菌分离,采用形态特征观察和ITS序列分析相结合的方法,发现不同地理位置的香蕉根系内生真菌群落种类、组成和分布有所差异。【本研究切入点】有关微生物对香蕉抗枯萎病的影响已有一些报道,但不同抗病程度香蕉品种的根系细菌群落结构差异研究则鲜见报道。【拟解决的关键问题】采用高通量测序方法测定田间自然发病条件下香蕉枯萎病抗病与感病品种根系细菌群落结构的差异并分析其多样性,在此基础上分析抗病和感病品种根系细菌群落组成对香蕉抗枯萎病能力的影响,为发掘利用香蕉枯萎病土著生防微生物组供理论依据。
1 材料与方法
1. 1 试验材料
香蕉枯萎病感病品种为目前生产上的主栽品种威廉斯B6(编号为W),购自广西植物组培苗有限公司;抗病品种为中蕉9号(编号为Z),由广东农业科学院果树研究所提供。
1. 2 样品的准备与采集
在香蕉枯萎病主病区广西南宁市郊金陵镇南岸村(东经108?1'~108?2',北纬22?56'~22?57')选择0.13 ha连续种植香蕉且具5年枯萎病严重发病史的香蕉种植地作为试验地,分别种植感病和抗病品种,威廉斯B6设4个小区共137株,中蕉9号设4个小区共143株,四周设置保护行,正常水肥管理。分别在发病初期即营养生长旺盛期(标记为T1)和发病严重期即孕蕾期(标记为T2)按照五点采样法采集感病、抗病品种植株2种类型的根系(Root system,简写为R)样本,抖去根表附着的土壤,每种样本各采集30株,然后随机分成3份,每份10株,每份为1个样本,共12个根样本,将样本置于冰盒带回实验室。用无菌水洗涤根部30 s,然后在70%乙醇中浸泡2 min,再用2.5% NaClO(含0.1% Tween 80)浸泡5 min后转移至70%无菌乙醇浸泡30 s,最后使用无菌水洗涤根部3次以上,用液氮速冻后保存于-80 ℃冰箱备用。
1. 3 试验方法
1. 3. 1 2个时期感病和抗病品种香蕉枯萎病调查 在发病初期和发病严重期采样前均调查香蕉发病情况,参考邓晓等(2012)的方法进行病害等级鉴定,记录病级并计算病情指数。病情分级标准:0级,未发病,外观无可见症状;1级,外围下部1~2叶片出现小面积黄色斑块,占叶面积的1/2以下,或球茎组织变褐面积占球茎面积的1/4以下假莖组织未见褐变,根有的变褐;3级,外围叶片出现大面积黄色斑块,占叶面积的1/2以上,叶片出现萎蔫,或球茎组织变褐面积占球茎面积的1/4~1/2,假茎组织未见褐变,根有的变褐;5级,叶片黄化萎蔫、死亡,球茎组织变褐面积占球茎面积的1/2左右,假茎组织上部未见变褐,而下部出现浅褐色斑点状或褐色线条状病变,根部黑褐色,植株出现轻度萎蔫;7级,植株出现萎蔫、枯死,球茎组织1/2以上面积变褐或腐烂,假茎上、下部出现褐色条状病变,基部易折断、萎蔫或腐烂,根黑褐色或出现烂根;9级,全株枯死。
病情指数=∑(病株级数×代表数值)/(株数总和×最高病级代表值)
1. 3. 2 香蕉根系DNA提取及高通量测序 用CTAB法提取香蕉根系DNA,用1%琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop 2000测定DNA浓度和纯度。DNA样本委托上海美吉生物医药科技有限公司进行基因扩增和测序。香蕉根系内生细菌使用上游引物338F(5'-ACTCCTACGGGAG GCAGCAG-3')和下游引物806R(5'-GGACTACH VGGGTWTCTAAT-3')对16S rRNA基因V3~V4区进行扩增;将同一样本的PCR产物混合后使用2%琼脂糖凝胶分别回收2个片段的PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用QuantusTM Fluorometer(Promega,USA)对回收产物进行检测、定量。使用NEXTFLEX Rapid DNA-Seq Kit进行建库。利用Illumina公司的MiSeq PE300平台进行测序。
1. 4 统计分析
通过Fastp和Flash软件对原始测序序列进行质控、拼接。运用Usearch(version 7.0 http://drive5.com/uparse/),根据97%的相似度对序列进行OTU聚类并剔除嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列与Silva数据库(v138)进行比对、注释。经过Alpha多样性分析(包括Chao、Shannon、Simpsonace、Simpson和Coverage等分析指数)后得到香蕉根系内生细菌群落中物种的丰富度、覆盖度和多样性等;基于物种注释结果,通过群落柱形图、群落热图、韦恩图等可视化分析,分析样本中物种的组成及优势菌群/关键菌群等;基于物种注释结果,使用NMDS、PCoA等分析,评估组间或样本间在物种组成上的相似性和差异性;通过以上结果分析,根据细菌群落多样性以及门和属水平上的相对丰度与品种抗性的相关性分析微生物整体群落与品种抗性之间的相关性。采用Excel 2010对数据进行整理统计,运用DPS 7.0进行单因素方差分析、使用邓肯氏新复极差法进行差异显著性分析。
2 结果与分析
2. 1 不同时期感病和抗病香蕉品种枯萎病发病情况
对抗感、香蕉品种枯萎病发病初期(T1)和发病严重期(T2)的病情调查结果(表1)显示,在T1时期,中蕉9号无发病症状,病情指数为0,与威廉斯B6(病指为0.31)相比较差异极显著(P<0.01,下同);T2时期,大部分植株均出现发病症状(图1),威廉斯B6病情指数逐渐增大,病指为0.53,中蕉9号病指为0.12,与威廉斯B6相比较差异极显著。可见,随着香蕉的生长发育枯萎病越发严重,抗病品种中蕉9号在生长过程中相对感病品种威廉斯B6表现出极显著的抗病能力。
表 1 不同时期感病和抗病香蕉品种枯萎病发病情况
Table 1 The incidence of fusarium wilt in susceptible and resistant banana varieties at different stages
[香蕉品种
Banana variety 病情指数 Disease index T1 T2 Z 0bB 0.12bB W 0.31aA 0.53aA ]
同列数据后不同大、小写字母分别表示差异达极显著(P<0.01)和显著(P<0.05)水平。表2同
Different uppercase letters in the same column represented extremely significant difference(P<0.01), and lowercase letters represented significant difference(P<0.05). The same was applied in Table 2
图 1 抗病与感病香蕉植株发病情况
Fig.1 Disease incidence of resistant and susceptible banana
plants
A:抗病品种中蕉9号;B:感病品种威廉斯B6
A: Resistant variety (Zhongjiao 9); B:Susceptible variety(Williams B6)
2. 2 香蕉根系内生细菌物种注释与评估
2. 2. 1 样本稀释曲线分析 选择97%相似度的OTU计算不同随机抽样下的Sobs指数绘制稀释曲线图(图2),序列数在60000时趋于平缓,但未达到饱和,说明测序数据量合理,可体现根系样本各细菌群落,但也存在未检测出少量微生物的可能性,表明若继续测序还可能产生较多新的物种(如OTU)。总体而言,此测序结果可以反映香蕉根系样本中绝大多数的细菌信息。
2. 2. 2 不同时期感病和抗病香蕉植株根系内生细菌群落Alpha多样性分析 根据测序获得的有效序列分析(表2)可知,感病和抗病香蕉植株在2个不同生长期的12个根系样本获得的有效序列均值均在10万条以上,总和达1285808条;各样本测序覆盖度指数在0.9970以上,差异不显著(P>0.05,下同),说明测序数据合理真实,测序数据基本涵盖了香蕉根系中的细菌类群,能体现香蕉根系真实环境中的细菌组成特征。
研究根系中细菌的多样性,可通过单样本的多样性(Alpha多样性)分析反映细菌群落的丰富度和多样性,其中Shannon指数和Simpson指数反映群落的多样性,Shannon值越大,说明群落多样性越高,Simpson指数越大,说明群落多样性越低;ACE和Chao1指数反映群落的丰富度,值越大则丰富度越高。通过方差分析发现,从发育时期来看,2个品种T2期的Shannon指数高于T1期,随着生长发育和病情指数的增长,Shannon指数呈上升趋势,表现为T2_RZ>T2_RW>T1_RW>T1_RZ;从样本来看,T1时期RW与RZ相比,RW的Shannon指数较RZ高、Simpson指数较RZ低,T2时期则相反,RZ的Shannon指数高于RW,Simpson指数低于RW(表2)。表明随着香蕉植株的生长发育和病情指数的上升,抗病品种中蕉9号根系细菌群落多样性高于感病品种威廉斯B6,但二者差异不显著。
随着香蕉的生长和枯萎病发病越发严重,ACE和Chao1指数均有所提高,说明发病严重期2个香蕉品种根系细菌群落丰富度均高于发病初期;同时RW在2个发育时期中ACE和Chao1指数均高于RZ,表明威廉斯B6根系细菌群落丰富度高于中蕉9号,二者差异不显著,即二者的细菌群落丰富度相近(表2)。
2. 2. 3 OTU聚类分析 12个根系样本内生细菌共鉴定得到32门89纲220目369科673属1139种2568个OTUs。如图3所示,T1_RW、T1_RZ、T2_RW和T2_RZ根系分别获得715、662、1830、1742个细菌OTU,4个处理间有388个共有OTUs,四者特有OTUs数量分别为T2_RW(635)>T2_RZ(560)>T1_RW(31)>T1_RZ(27),表明随着香蕉的生长和发病越发严重,不同品种的香蕉根系内生细菌多样性存在差异,且各自有其特异的OTUs,共有OTUs和特有OTUs差异较大,即感病和抗病品种的根系内生细菌群落具有明顯差异。
2. 3 不同时期感病和抗病香蕉植株根系内生细菌群落结构分析
2. 3. 1 门水平细菌群落结构分析 Alpha多样性可反映细菌群落的丰富度和多样性,而物种组成分析能反映样本在分类学水平上的群落结构及结构中各优势物种的相对丰度。高通量测定结果(图4)显示,从门分类水平看,威廉斯B6和中蕉9号在发病初期和发病严重期其根系内生细菌群落共检测到10个优势门类(相对丰度≥0.01%为优势菌门,相对丰度<0.01%归为其他),分别为变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、粘球菌门(Myxococcota)、酸杆菌门(Acidobacteriota)、芽单胞菌门(Gemmatimonadota)、绿弯菌门(Chloroflexi)、疣微菌门(Verrucomicrobiota)和浮霉菌门(Planctomycetota)。
物种组成分析结果(图4)表明,中蕉9号与威廉斯B6在门分类水平上优势菌门无差异,在物种类别无差异的情况下,物种的相对丰度是反映物种多样性的重要指标。在香蕉发病初期,威廉斯B6和中蕉9号的第1优势菌门为变形菌门,相对丰度分别为97.31%和97.05%,第2优势菌门为厚壁菌门(RW:1.10%;RZ:1.91%),其他8个菌门的相对丰度均小于1.00%。在发病严重期,威廉斯B6和中蕉9号中变形菌门的相对丰度均大幅度降低,分别为40.17%和32.10%,而放线菌门(RW:34.00%;RZ:49.67%)和拟杆菌门(RW:7.76%;RZ:3.92%)的相对丰度显著提高(P<0.05,下同),其他8个菌门的相对丰度均有所提高。可见,随着生长和发病时间的推移,威廉斯B6和中蕉9号根系细菌群落的优势菌门及其相对丰度有显著变化,并趋于平衡和稳定。物种差异分析结果(图4)显示,在菌门分类水平上,发病严重期抗病品种中蕉9号和感病品种威廉斯B6间的变形菌门、放线菌门和拟杆菌门的相对丰度差异显著,其中中蕉9号的变形菌门(32.10%)显著低于威廉斯B6(40.17%),而中蕉9号的放线菌门(49.67%)显著高于威廉斯B6(34.00%),提高了46.09%。说明在菌门水平上,抗病品种中蕉9号根系细菌群落多样性高于感病品种威廉斯B6。
2. 3. 2 属水平细菌群落结构分析 从属分类水平看(图5),威廉斯B6和中蕉9号在发病初期和发病严重期其根系内生细菌群落共检测到673个属,其中T1_RW、T1_RZ、T2_RW和T2_RZ分别含318、288、558和528个属,4个处理共有属232个[优势菌属为肠杆菌属(Enterobacter)],T1_RW和T1_RZ独有属分别分别为6个[优势菌属为Niveispirillum]和3个[优势菌属为苍白杆菌(Ochrobactrum)],T2_RW和T2_RZ独有属分别为112个(优势菌属为Pelagibacterium)和83个[优势菌属为短杆菌属(Brevibacterium)]。可看出感病与抗病品种香蕉根系内生细菌群落组成在属水平上多样性较丰富且差异显著。
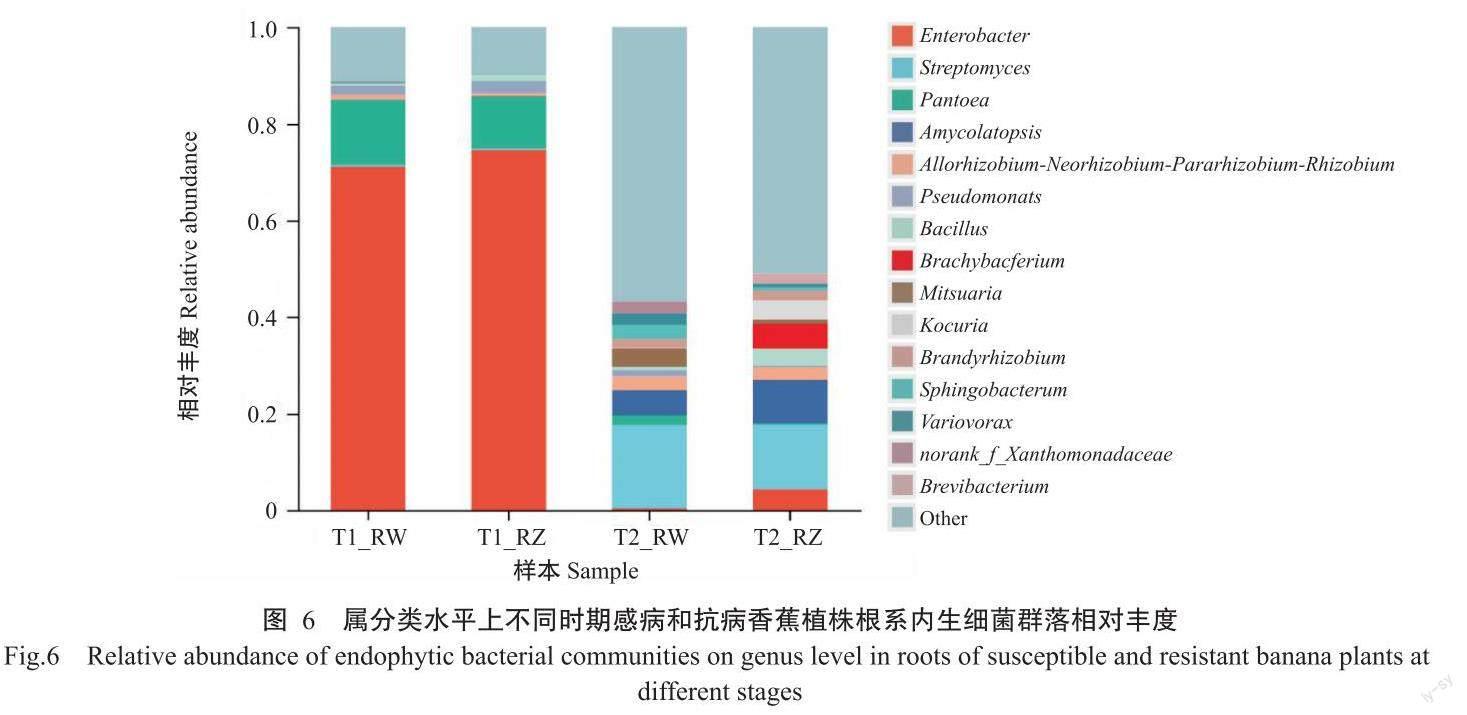
威廉斯B6和中蕉9号根系内生细菌在2个生长时期的优势菌属及相对丰度存在明显差异(图6)。其中,T1时期RW和RZ的内生细菌组成较单一且相似,优势菌属及其在相应样本中的相对丰度顺序分别为:肠杆菌属(RW 71.06%;RZ 74.52%)>泛菌属(Pantoea)(RW 13.46%;RZ 10.58%)>Others(RW 11.34%;RZ 9.79%)>假单胞菌属(Pseudomonas)(RW 1.84%;RZ 2.47%)>根瘤菌属(Rhizobium)(RW 1.04%;RZ 0.66%)和芽孢杆菌属(Bacillus)(RW 0.46%;RZ 1.30%),其余的菌属相对丰度均小于1.00%;芽孢杆菌属是该时期中蕉9号根系特有优势内生细菌。
T2时期2个香蕉品种的根系内生细菌组成较丰富,其群落结构与T1时期差异明显,优势菌属及其在相应样本中的相对丰度顺序分别为:Others(RW 56.82%;RZ 51.08%)>链霉菌属(Streptomyces)(RW 17.30%;RZ 13.43%)>拟无枝菌酸菌属(Amycolatopsis)(RW 5.27%;RZ 8.88%)>短状杆菌属(Brachybacterium)(RW 0.01%;RZ 5.11%)>考克氏菌属(Kocuria)(RW 0.01%;RZ 3.98%)>Mitsuaria(RW 3.87%;RZ 0.94%)>芽孢杆菌属(RW 0.64%;RZ 3.57%)>鞘氨醇杆菌属(Sphingobacterium)(RW 3.05%;RZ 0.65%)>根瘤菌属(RW 2.81%;RZ 2.60%)>未定名黄单胞菌科(norank_f__Xanthomonadaceae)(RW 2.41%;RZ 0.00%)>贪噬菌属(Variovorax)(RW 2.34%;RZ 0.69%)>泛菌属(RW 1.97%;RZ 0.30%)>短杆菌属(RW 0%;RZ 2.09%)>慢生根瘤菌属(Bradyrhizobium)(RW 1.85%;RZ 2.06%)>假单胞菌属(RW 1.35%;RZ 0.35%),其余的菌属相对丰度均小于1.00%(图6)。T2时期与T1时期对比可知,Others、链霉菌属、拟无枝菌酸菌属和芽孢杆菌属的相对丰度提高比例较大,作为T1时期优势菌属的肠桿菌属和泛菌属相对丰度大幅度降低;根据物种组成分析结果,值得关注的是未定名黄单胞菌科和梭菌(Clostridium)是威廉斯B6根系特有的优势菌属,短杆菌属、解环菌属(Cycloclasticus)、嗜盐放线菌(Neomicrococcus)及糖多胞菌(Saccharopolyspora)是中蕉9号根系特异富集的优势菌属。可见,随着香蕉植株的生长及枯萎病的发生,感病和抗病香蕉根系内生细菌群落组成发生了变化,根系能富集或招募更多与其生长相关或对其发生枯萎病有影响的特有细菌属种。
2. 4 不同时期感病和抗病香蕉植株根系内生细菌群落Beta多样性分析结果
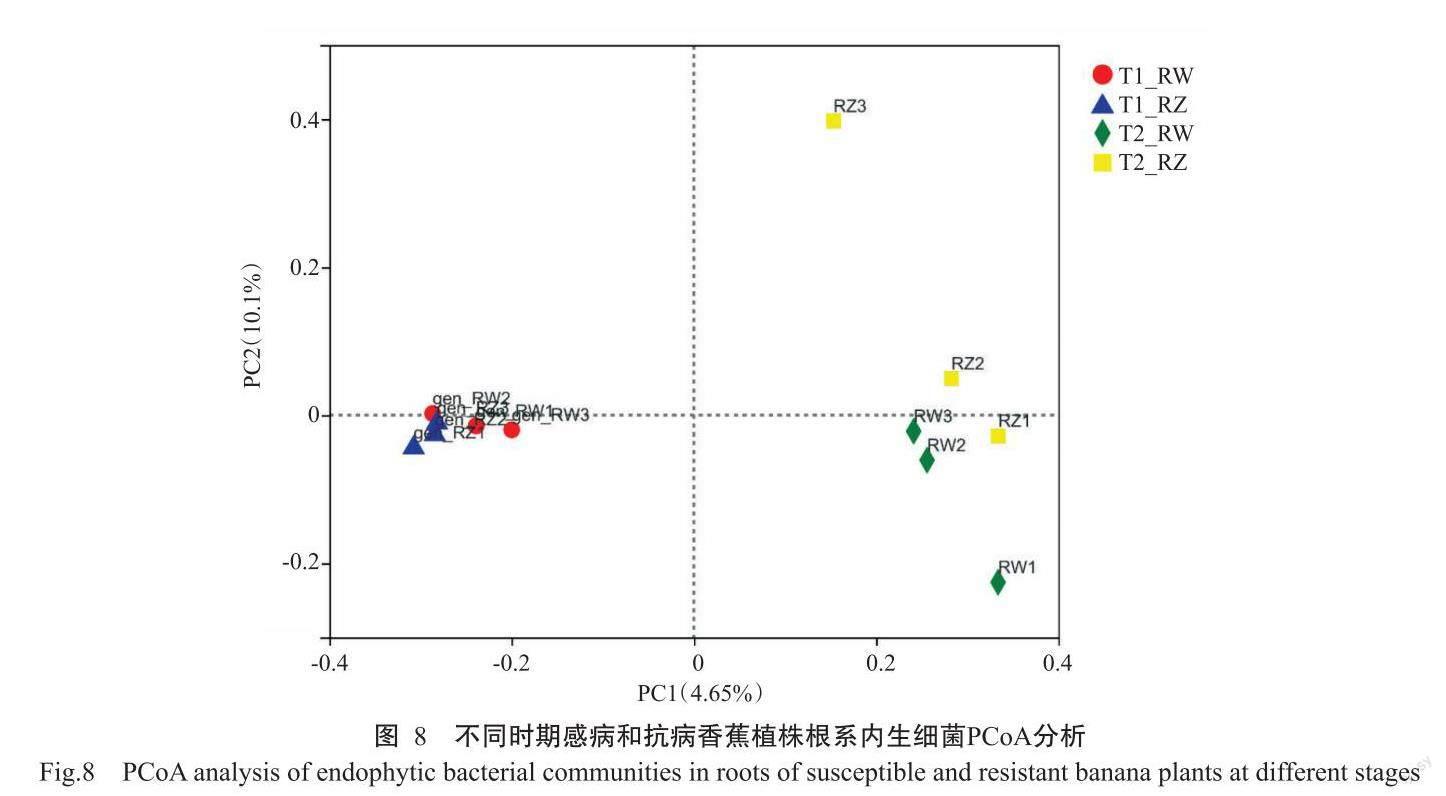
NMDS分析,即非度量多维尺度分析(Non-metric multidimensional scaling)是基于Bray-curtis距离进行分析的数据分析方法,根据不同时期威廉斯B6和中蕉9号根系中包含的内生细菌群落信息,以点的形式反映在多维空间上,继而通过点与点间的距离体现不同样本间的差异程度。如图7所示,基于不同时期威廉斯B6和中蕉9号根系内生细菌测序获得的OTUs水平的NMDS分析结果,Stress为0,说明NMDS可准确反映样本间的差异程度,结果显示4个处理存在明显差异。4个处理分布在不同象限内,TI_RW与TI_RZ组间距离较近,有2个数据点几近重合;T2_RW与T2_RZ组间距离较大。说明威廉斯B6和中蕉9号根系内生细菌群落结构在生长初期大致相同,随着种植和发病时间的推移内生细菌群落结构也逐渐改变,到发病严重期时2个品种间内生细菌群落结构具有明显差异。
在OTU水平上对细菌群落进行基于Unweighted UniFrac距离算法的主坐标分析(Principal co-ordinates analysis,PCoA),结果(图8)显示,不同时期的威廉斯B6和中蕉9号根系内生细菌群落变化与NMDS分析结果一致,T1的2个处理聚在同一个象限,且处理间的距离很近,T1_RW和T1_RZ则表现出明显的组内聚集,说明这2个处理的细菌群落组成结构很相似;T2与T1处理分布在不同象限,说明不同时期的香蕉根系内生细菌群落结构差距较大;T2_RZ与T2_RW、T1_RW、T1_RZ等3个处理间的距离较远,说明发病严重期抗病品种与另3个处理的香蕉根系内生细菌群落结构相似性较低,差异显著。
3 讨论
许多研究表明,微生物多样性与植物抗病能力有密切关系。邓晓等(2012)研究表明,健康香蕉植株根际微生物总量与多样性大于发病植株。杨尚东等(2020)发现甘蔗宿根矮化病感病植株的不同部位内生细菌多样性降低,较健康植株差异显著。刘宇星等(2021)研究发现,健康刺梨植株附生菌群和内生菌群的香农指数、辛普森指数、丰富度指数和均匀度指数均大于患病植株的相关指数。在本研究中,香蕉从发病初期到发病严重期,威廉斯B6发病明显,病级逐渐变大,同时中蕉9号大部分植株均能正常生长且长势良好,高通量测序结果发现抗病品种中蕉9号发病严重期其根系内生细菌多样性高于发病初期,且高于感病品种威廉斯B6,与邓晓等(2012)、刘宇星等(2021)的研究结果相似。结合植株生长情况和测序结果发现,在抵御香蕉枯萎病过程中,抗病品种根系内生细菌多样性显著提高,说明香蕉植株可能通过竞争根系内生微生物资源来抑制病原菌的侵染和定殖,使内生微生物群落结构更加稳定,继而维持香蕉植株的健康水平并减少发病机会,而感病品种根系内生细菌多样性降低则与其枯萎病病指变大相对应。由此可推论香蕉植株根系内生微生物多样性与其抗病程度呈明显的正相关关系。
前人研究发现,生长素和细胞分裂素等植物生长促进类激素与浮霉菌门、酸杆菌门、绿弯菌门等细菌呈显著正相关,与厚壁菌门细菌呈负相关;水杨酸、茉莉酸等抗逆及防御类植物激素与放线菌门细菌呈显著正相关,与变形菌门细菌呈负相关(卢玉秋,2019;陈思宇等,2021)。链霉菌属是生物活性物质的主要来源,植物内生链霉菌的次级代谢产物丰富,可与宿主长期协同进化、互利共生,在植物—微生物互作中发挥重要作用,是一种可应用于农业领域的促生及防病生物制剂潜在资源(刘迎雪等,2020;王莎等,2021)。芽孢杆菌是一种著名的植物促生微生物,其能通过分泌抗真菌物质抑制病原菌生长,同时还能分泌植物激素来促进植物生长。Kwak等(2018)发现抗青枯病番茄品种的根际微生物组参与了植物的抗病过程,抗病品种特异富集的黄杆菌(Flavobacterium sp.,属于拟杆菌门)能提高番茄抗青枯病能力,保护番茄免受病原菌侵害。本研究发现,香蕉营养生长期优势菌门的变形菌门和厚壁菌门相对丰度均显著降低,至发病严重期时,随着病原菌的不断胁迫,放线菌门相对丰度显著提高,尤其是中蕉9号根系中放线菌门的相对丰度较威廉斯B6高15.67%;在属分类水平上看,发病初期作为优势菌属的肠杆菌属和泛菌属的相对丰度随着植株的生长和病程的推进逐渐降低,而有益菌链霉菌属、拟无枝菌酸菌属和芽孢杆菌属的相对丰度逐渐提高并成为优势菌属。而中蕉9号中芽孢杆菌属、短状杆菌属、短杆菌属和考克氏菌属等菌属相对丰度较威廉斯B6高,说明在香蕉抗病过程中,放线菌门和芽孢杆菌属等有益微生物积极分泌生长类和抗逆类植物激素促进中蕉9号生长并抑制病原菌的生长,从而保持植株健康,提高抗病能力,这意味着微生物群落中有益物种的种类和相对丰度与香蕉的健康生长及其抗枯萎病能力呈正相关。
值得关注的是未定名黄单胞菌科,其与梭菌是威廉斯B6根系特有的优势菌属,短杆菌属、解环菌属、嗜盐放线菌及糖多胞菌是中蕉9号根系特有的优势内生细菌属。黄单胞菌属隶属于好氧或兼性厌氧非发酵革兰氏阴性杆菌,多为植物致病菌(Vauterin et al.,1996),部分梭菌属对人、动物或植物致病。未定名黄单胞菌科细菌和梭菌属细菌的特异富集与威廉斯B6发病逐渐明显呈正相关关系,这一结论与薛超(2015)的研究结果一致。而解环菌属、嗜盐放线菌及糖多胞菌多存在于海洋高盐、高压、低营养环境条件,具有耐盐性、耐高温和高渗透性、固氮等功能,且能产生可抵抗病原微生物的特殊代谢产物(单纪苗等,2014;李恩源,2017)。这类菌的特异富集对中蕉9号的抗逆、防御能力有重要影响,与Kwak等(2018)的研究结果相似。病原菌的富集加重植物的感病程度与发病速度,而有益特有菌属的富集能抵抗枯萎病,有可能是其产生抑制病原菌生长的拮抗物质直接参与抗病过程,亦或是诱导香蕉植株产生系统抗病性的间接作用。因此,香蕉根系能招募何种类型的微生物群落对香蕉植株的抗病能力具有关键作用。在后续研究中应尝试分离抗病品种中特异富集的细菌并进行功能验证,进而揭示香蕉根系微生物组与香蕉抗枯萎病之间的联系。
4 结论
感病与抗病香蕉植株根系内生细菌群落结构随着生长发育和枯萎病发病进程而变化,优势菌门和菌屬群落组成变化较大且差异显著,尤其是抗病品种中有益微生物链霉菌属、拟无枝菌酸菌属和短杆菌属的相对丰度显著增加。这些微生物的结构组成变化对香蕉枯萎病的发生有较大影响,特异微生物的富集对香蕉抗枯萎病产生直接或间接的影响。
参考文献:
曹鹏飞,刘青娥. 2021. 杨梅枯萎病拮抗内生菌的分离及其抑菌机制研究[J]. 河南农业科学,50(4):96-105. [Cao P F, Liu Q E. 2021. Isolation of antagonistic endophytes against Myrica rubra wilt and their antagonistic mechanism[J]. Journal of Henan Agricultural Sciences,50(4):96-105.] doi:10.15933/j.cnki.1004-3268.2021.04.013.
陈思宇,孙妍,肖健,赵天义,杨尚东. 2021. 果实红色与黄色番茄品种植株茎部内生细菌群落结构及代谢功能特征[J]. 微生物学报,62(2):602-616. [Chen S Y, Sun Y, Xiao J, Zhao T Y, Yang S D. 2021. Characteristics of endophytic bacterial community structure and metabolic function in stems of tomatoes between red and yellow varieties[J]. Acta Microbiologica Sinica,62(2):602-616.] doi:10.13343/j.cnki.wsxb.20210246.
陈艳露,谢玲,刘斌,曾凤花,廖仕同,张艳. 2022. 广西香蕉根系内生真菌的群落组成与多样性[J]. 热带作物学报,43(2):385-398. [Chen Y L, Xie L, Liu B, Zeng F H, Liao S T, Zhang Y. 2022. Community composition and diversity of endophytic fungi in banana root in Guangxi[J]. Chinese Journal of Tropical Crops,43(2):385-398.] doi:10.3969/j.issn.1000-2561.2022.02.020.
邓晓,李勤奋,侯宪文,武春媛,李光义. 2012. 香蕉枯萎病不同感病级别植株根际与非根际土壤微生物物种多样性研究[J]. 中国农学通报, 28(30): 239-248. [Deng X, Li Q F, Hou X W, Wu C Y, Li G Y. 2012. Study on the microbial species diversity of rhizosphere and non-rhizosphere soils from different grades infected by banana fusarium wilt[J]. Chinese Agricultural Science Bulletin,28(30):239-248.] doi:10.3969/j.issn.1000-6850.2012. 30.044.
杜浩,只佳增,李宗锴,周劲松,杨绍琼,陈伟强. 2020. 我国土壤微生物菌群构建防控香蕉枯萎病研究进展[J]. 热带农业科学, 40(2): 90-98. [Du H, Zhi J Z, Li Z K, Zhou J S, Yang S Q, Chen W Q. 2020. Research progress of control of banana fusarium wilt through establishment of a soil microbial community in China[J]. Chinese Journal of Tropical Agriculture, 40(2):90-98.] doi:10.12008/j.issn.1009-2196.2020.02.014.
赖宝春,戴瑞卿,林明辉,吴振强,王家瑞. 2020. 一株拮抗放线菌的鉴定及其对香蕉枯萎病的生防效应[J]. 南方农业学报,51(4):836-843. [Lai B C, Dai R Q, Lin M H, Wu Z Q, Wang J R. 2020. Identification of an antagonistic ctinomycetes and its biological control effect on banana fusarium wilt[J]. Journal of Southern Agriculture, 51(4):836-843.] doi:10.3969/j.issn.2095-1191.2020. 04.014.
李恩源. 2017. 两株嗜盐放线菌YIM 96633和YIM 96077功能基因及次生代谢产物的初步研究[D]. 昆明:云南大学. [Li E Y. 2017. Preliminary study on functional gene and secondary metabolites of two halophilic actinomycetes YIM 96633 and YIM 96077[D]. Kunming:Yunnan University.]
李华平,李云峰,聂燕芳. 2019. 香蕉枯萎病的发生及防控研究现状[J]. 华南农业大学学报,40(5):128-136. [Li H P, Li Y F, Nie Y F. 2019. Research status of occurrence and control of fusarium wilt of banana[J]. Journal of South China Agricultural University,40(5):128-136.] doi: 10.7671/j.issn.1001-411X.201905062.
李梅婷. 2007. 香蕉根际及内生真菌和放线菌与香蕉病害的相关性[D]. 福州: 福建农林大学. [Li M T. 2007. Relationship of rhizosphere and endophytic fungi and actinomyces of Musa spp. with banana diseases[D]. Fuzhou: Fujian Agriculture and Forestry University.]
刘范,刘嘉鹏,项蕾蕾,田娜,孙雪丽,郝向阳,赖钟雄,程春振. 2018. 竹荪粗提物对香蕉枯萎病菌FocTR4的抑制效果[J]. 福建农业学报,33(11):1167-1171. [Liu F, Liu J P, Xiang L L, Tian N, Sun X L, Hao X Y, Lai Z X, Cheng C Z. 2018. Inhibitory effect of bamboo fungus crude extracts on banana wilt pathogen[J]. Fujian Journal of Agricultural Sciences,33(11):1167-1171.] doi:10.19303/j.issn.1008-0384.2018.11.008.
刘宇星,邵秋雨,葛伟,董醇波,张芝元,任玉连,罗力,郑鲁平,韩燕峰,梁宗琦. 2021. 健康与患病刺梨植株可培养叶际真菌菌群差异比较[J]. 菌物学报,40(10):2620-2640. [Liu Y X, Shao Q Y, Ge W, Dong C B, Zhang Z Y, Ren Y L, Luo L, Zheng L P, Han Y F, Liang Z Q. 2021. Comparison of culturable phyllosphere fungal flora between healthy and diseased Rosa roxburghii[J]. Mycosystema,40(10):2620-2640.] doi:10.13346/j.mycosystema.210043.
劉迎雪,赵滢,张宝香,杨义明,范书田,李昌禹,王月,许培磊,秦红艳,路文鹏. 2020. 植物内生细菌来源及生物学功能研究进展[J]. 特产研究,42(4):60-67. [Liu Y X, Zhao Y, Zhang B X, Yang Y M, Fan S T, Li C Y, Wang Y, Xu P L, Qin H Y, Lu W P. 2020. Research progress on the source and biological function of plant endophytic bacteria[J]. Special Wild Economic Animal and Plant Research,42(4):60-67.] doi:10.16720/j.cnki.tcyj.2020.04.011.
卢亭君,卢行尚,黄晓妹. 2018. 5亿cfu/g枯草芽孢杆菌生物有机肥防治香蕉枯萎病田间试验效果初报[J]. 南方园艺, 29(4):11-13. [Lu T J, Lu X S, Huang X M. 2018. Preliminary study on the effect of bioorganic fertilizer with 500 million cfu/g Bacillus subtilis on the control of banana fusarium wilt[J]. Southern Horticulture,29(4):11-13.] doi:10.3969/j.issn.1674-5868.2018.04.005.
卢玉秋. 2019. 微生物群落对作物生长及植物激素的影响[D]. 北京:中国农业科学院. [Lu Y Q. 2019. Effects of microbial community on crop growth and phytohormones[D]. Beijing:Chinese Academy of Agricultural Sciences Dissertation.]
農倩,张雯龙,蓝桃菊,苏琴,陈艳露,张艳,覃丽萍,谢玲. 2017. 一株抗香蕉枯萎病DSE菌株的筛选鉴定及抗病机理初探[J]. 热带作物学报,38(3): 559-564. [Nong Q, Zhang W L, Lan T J, Su Q, Chen Y L,Zhang Y, Qin L P, Xie L. 2017. Screening and Identification of Dark Septate Endophyte strain L-14 and its mechanism of banana fusarium wilt disease resistance[J]. Chinese Journal of Tropical Crops,38(3):559-564.] doi:10.3969/j.issn. 1000-2561.2017.03.027.
单纪苗,张丽芳,车茜,孙世伟,顾谦群,毛文君. 2014. 红树林根泥放线菌Saccharopolyspora sp. 胞外多糖的结构研究[J]. 中国海洋药物,33(3):7-12. [Shan J M, Zhang L F, Che Q, Sun S W, Gu Q Q, Mao W J. 2014. Structures of the exopolysaccharides produced by the mangrove soil actinomycete Saccharopolyspora sp.[J]. Chinese Journal of Marine Drugs,33(3):7-12.] doi:10.13400/j.cnki.cjmd. 2014.03.002.
王莎,窦桂铭,马玉超. 2021. 植物内生链霉菌Streptomyces sp. SAT1的基因组测序和比较基因组分析[J]. 微生物学通报,48(9):3039-3053. [Wang S, Dou G M, Ma Y C. 2021. Genome sequencing and comparative genome ana-lysis of Streptomyces sp. SAT1[J]. Microbiology China,48(9):3039-3053.] doi:10.13344/j.microbiol.china.201135.
王彤. 2018. 六种韭菜品种抑菌物质分析及其对香蕉枯萎病的抑制效果评价[D]. 福州:福建农林大学. [Wang T. 2018. Analysis of the chemical substances in six different Chinese chive(Allium Tuberosum Rottler)cultivars and evaluation of their inhibitory effect to panama disease of banana[D]. Fuzhou:Fujian Agriculture and Forestry University.]
吴思梦. 2018. 柑橘抗/感溃疡病品种内生细菌菌群差异与寄主抗病的相关性研究[D]. 南昌:江西农业大学. [Wu S M. 2018. Relativity study between endophytic bacteria flora of different orange varieties and resistance or susceptibility of host to citrus canker[D]. Nanchang:Jiangxi Agriculture University.]
许乐,阮小蕾,李冬丽,李华平. 2012. 对枯萎病不同抗性的香蕉品种的内生细菌的多样性及群落结构[J]. 微生物学通报,39(9):1250-1259. [Xu L, Ruan X L, Li D L, Li H P. 2012. Endophytic bacterial diversity and communities of banana cultivars with different resistance to fusarium wilt disease[J]. Microbiology China,39(9):1250-1259.] doi:10.13344/j.microbiol.china.2012.09.003.
徐鹏. 2007. 壳聚糖分解细菌的分离鉴定以及壳聚糖分解液对黄瓜枯萎病的防治[D]. 兰州:兰州大学. [Xu P. 2007. Isolation and identification of chitosan degrading bacteria and inhibition of bacteria cultures to the cucumber blight disease[D]. Lanzhou:Lanzhou University.]
薛超. 2015. 香蕉根际土壤微生物区系特征与土传枯萎病防控研究[D]. 南京:南京农业大学. [Xue C. 2015. Mani-pulation of microbial community in banana rhizophere to suppress fusarium wilt of banana[D]. Nanjing:Nanjing Agricultural University.]
楊尚东,任奎瑜,谭宏伟. 2020. 甘蔗宿根矮化病感病与非感病植株养分含量、根系生长及内生细菌群落的差异[J]. 植物营养与肥料学报,26(9):1591-1599. [Yang S D, Ren K Y, Tan H W. 2020. Differences in plant nutrient content, root growth and endophytic bacterial community between infected and non-infected sugarcanes by ratoon stunting disease[J]. Journal of Plant Nutrition and Fertili-zers,26(9):1591-1599.] doi:10.11674/zwyf.20144.
叶乃玮,吴紫燕,干华磊. 2019. 组合木霉菌制剂防治香蕉枯萎病的研究[J]. 中国果树,(2):64-67. [Ye N W, Wu Z Y, Gan H L. 2019. Studies on the control of fusarium wilt with combined Trichoderma preparations[J]. China Fruits,(2):64-67.] doi:10.16626/j.cnki.issn1000-8047. 2019.02.015.
张放. 2021. 2020年我国水果生产统计简析[J]. 中国果业信息,38(12):29-39. [Zhang F. 2021. Summary of fruit production statistics in China in 2020[J]. China Fruit News,38(12):29-39.] doi:10.3969/j.issn.1673-1514.2021. 12.007.
张涵,赵莹,仲荣荣,文才艺,孟颢光. 2022. 生防细菌TB17的筛选、鉴定及其对苦瓜枯萎病的生防作用[J]. 河南农业大学学报,56(3):429-437. [Zhang H, Zhao Y, Zhong R R, Wen C Y, Meng H G. 2022. Screening,identification of biocontrol bacteria TB17 and its biocontrol effect on fusarium wilt of bitter gourd[J]. Journal of Henan Agricultural University,56(3):429-437.] doi:10.16445/j.cnki.1000-2340.20220111.001.
赵志祥,严婉荣,王宝,何舒,曾向萍,肖彤斌. 2022. 辣椒枯萎病生物防治研究进展[J]. 河南农业科学,51(4):11-21. [Zhao Z X,Yan W R,Wang B,He S,Zeng X P,Xiao T B. 2022. Research advances in biological control of pepper fusarium wilt[J]. Journal of Henan Agricultural Sciences,51(4):11-21.] doi:10.15933/j.cnki.1004-3268.2022.04.002.
周登博,井涛,起登凤,冯仁军,段雅捷,陈宇丰,王飞,张锡炎,谢江辉. 2017. 抗香蕉枯萎病菌的卢娜林瑞链霉菌的分离及防效鉴定[J]. 园艺学报,44(4):664-674. [Zhou D B, Jing T, Qi D F, Feng R J, Duan Y J, Chen Y F, Wang F, Zhang X Y, Xie J H. 2017. Isolation and identification of Streptomyces lunalinharesii and its control effect on the banana fusarium wilt disease[J]. Acta Horticulturae Sinica,44(4):664-674.] doi:10.16420/j.issn. 0513-353x.2016-0598.
Khan N, Martinez-Hidalgo P, Ice T A, Maymon M, Humm E A, Nejat N, Sanders E R, Kaplan D, Hirsch A M. 2018. Antifungal activity of Bacillus species against Fusarium and analysis of the potential mechanisms used in biocontrol[J]. Frontier in Microbiology,9:2363. doi: 10.3389/fmicb.2018.02363.
Kwak M J, Kong H G, Choi K, Kwom S K, Song J Y, Lee J, Lee P A, Choi S Y, Seo M, Lee H J, Jung E J, Park H, Roy N, Kim H, Lee M M, Rubin E M, Lee S W, Kim J F. 2018. Rhizosphere microbiome structure alters to enable wilt resistance in tomato[J]. Nature Biotechnology,36:1100-1109. doi:10.1038/nbt.4232.
Vauterin L, Yang P, Swings J. 1996. Utilization of fatty acid methyl esters for the differentiation of new xanthomonas species[J]. International Journal of Systematic Bacteriology,46(1):298-304. doi:10.1099/00207713-46-1-298.
Mendes R, Kruijt M, De Bruijn I, Dekkers E, Van Der Voort M, Schneider J H M, Piceno Y M, DeSantis T Z, Andersen G L, Bakker P A H M, Raaijmakers J M. 2011. Deciphering the rhizosphere microbiome for disease suppressive bacteria[J]. Science,332(6033):1097-1100. doi:10.1126/science.1203980.
Müller D B,Vogel C, Bai Y, Vorholt J A. 2016. The plant microbiota: Systems-level insights and perspectives[J]. Annual Review of Genetics,50(1):211-234. doi:10.1146/a nnurev-genet-120215-034952.
Philippot L, Raaijmakers J M, Lemanceau P, Van Der Putten W H. 2013. Going back to the roots: The microbial ecology of the rhizosphere[J]. Nature Reviews Microbio-logy,11(11):789-799.
Ploetz R C. 2006. Fusarium wilt of banana is caused by se-veral pathogens referred to as Fusarium oxysporum f. sp. cubense[J]. Phytopathology,96(6):653-656. doi:10.1094/P HYTO-96-0653.
Roller S, Covill N. 1999. The antifungal properties of chitosan in laboratory media and apple juice[J]. International Journal of Food Microbiology,47(1-2):67-77. doi:10. 1016/S0168-1605(99)00006-9.
Sekhar A C, Thomas P. 2015. Isolation and identification of shoot-tip associated endophytic bacteria from banana cv. Grand Naine and testing for antagonistic activity against Fusarium oxysporum f. sp. cubense[J]. American Journal of Plant Sciences,6(7):943-954. doi:10.4236/ajps. 2015.67101.
Wei Y X, Hu W, Wang Q N, Zeng H Q, Li X L, Yan Y, Russel J R, He C Z, Shi H T. 2017. Identification, transcriptional and functional analysis of heat-shock protein 90s in banana (Musa acuminata L.) highlight their novel role in melatonin-mediated plant response to fusarium wilt[J]. Journal of Pineal Research,62(1):e12367. doi: 10.1111/jpi.12367.
(責任编辑 麻小燕)

