中间球海胆CS基因克隆及其响应急性高温胁迫的表达模式
孙继红 任丽媛 崔东遥 赵谭军 常亚青 湛垚垚


摘要:【目的】明確中间球海胆(Strongylocentrotus intermedius)柠檬酸合酶(CS)基因(SiCS)的序列特征、组织表达情况及其应对急性高温胁迫的响应规律,为研究SiCS基因功能及揭示其参与中间球海胆高温应答的分子机制提供理论依据。【方法】利用RACE克隆SiCS基因cDNA序列,通过BLASTx、EXPASY Proteomics Server、HMMER、PSIRED v3.3及SWISS-MODEL等在线软件进行生物信息学分析;然后采用分光光度法检测中间球海胆管足和性腺线粒体肿胀度,运用实时荧光定量PCR检测SiCS基因的组织表达规律,并以Epoch酶标仪测定中间球海胆管足和性腺总SiCS活性变化情况。【结果】SiCS基因cDNA序列全长2971 bp,5'端非编码区(5'-UTR)和3'端非编码区(3'-UTR)分别为96和1480 bp,开放阅读框(ORF)为1395 bp,共编码464个氨基酸残基。SiCS蛋白分子量约51.48 kD,理论等电点(pI)为6.09,总平均亲水性(GRAVY)为-0.178,为稳定的温和疏水性蛋白;SiCS蛋白不存在信号肽和跨膜结构域,其二级结构中α-螺旋占43.86%、β-折叠占7.02%、无规则卷曲占49.12%,三维结构模型与野猪CS蛋白晶体结构的一致性为73.97%。SiCS氨基酸序列与紫球海胆(S. purpuratus)的CS氨基酸序列相似性最高,为92.90%。SiCS基因在中间球海胆的5种组织中均有表达,其相对表达量排序为体腔细胞>围口膜>性腺>管足>肠道;总SiCS活性排序则为管足>肠道>围口膜>性腺>体腔细胞;与对照组(20 ℃)相比,经23和26 ℃急性高温胁迫后中间球海胆管足和性腺的SiCS基因相对表达量及总SiCS活性均呈波动变化规律,但在不同高湿胁迫下和不同组织中有所差异。【结论】中间球海胆可能通过调整组织中的SiCS基因相对表达及SiCS活性来响应急性高温胁迫,且这种响应策略存在一定的组织和温度特异性,具体表现为性腺对急性高温胁迫较管足更敏感。
关键词:中间球海胆;柠檬酸合酶(CS);急性高温胁迫;表达模式;酶活性
中图分类号:S968.9 文献标志码:A 文章编号:2095-1191(2023)02-0586-12
Abstract:【Objective】To clarify the sequence characteristics,tissue expression rules and its expression patterns in response to acute heat stress of citrate synthase (CS) gene (SiCS) in Strongylocentrotus intermedius. The results of this study would provide a theoretical basis for further study of the biological function of SiCS gene and reveal the molecular mechanism of its involvement in the high temperature response of S. intermedius. 【Method】The cDNA sequence was cloned by using the rapid amplification of cDNA ends (RACE) technology. Bioinformatics analysis was carried out by online softwares such as BLASTx, EXPASY Proteomics Server, HMMER, PSIRED v3.3 and SWISS-MODEL. Mitochondria swelling degree of the tube foot and gonad were measured by spectrophotometry. Tissue relative expression of SiCS was analyzed by real-time fluorescence quantitative PCR (qRT-PCR); the changes of total SiCS activity in the tube foot and gonad of S. intermedius were measured by Epoch assay. 【Result】The results showed that the full length of SiCSc DNA was 2971 bp, containing a 5' end non-coding region (5'-UTR) of 96 bp, a 3' end non-coding region (3'-UTR)of 1480 bp, and an open reading frame(ORF) of 1395 bp which encoded 464 amino acids residues. The predicted molecular weight and the theoretical isoelectric point (pI) of SiCS protein were 51.48 kD and 6.09 respectively. SiCS was a stable mild hydrophobic protein with an average hydrophilicity (GRAVY) of -0.178. SiCS had no signal peptideand transmembrane. In the secondary structure, α-helix accounted for 43.86%, β-fold accounted for 7.02%, and random coil accounted for 49.12%.The consistency between the three dimensional structure of SiCS and the crystal structure of CS protein from Sus scrofa was 73.97%. Phylogenetic analysis indicated that the SiCS protein had the most similarity with CS protein from Strongylocentrotus purpuratus (similarity:92.90%). Relative gene expression data showed that SiCS was expressed in all examined tissues and the expression level from high to low was as coelomcytes>interdental muscle>gonad>tube foot>intestine. Total enzyme activity assay revealed that the level of total SiCS enzyme activity in different tissues from high to low was as tube foot>intestine>interdental muscle>gonad>coelomcytes. Compared with the control group (20 ℃), the relative expression level of the SiCS gene and the total SiCS activity in the tube foot and gonad of S. intermediuss howed fluctuations after acute heat stress at 23 and 26 ℃, and there were some differences under different heat stresses and in different tissues. 【Conclusion】S. intermedius mightrespond to acute heat stress by adjusting the relative expression of SiCS gene and SiCS enzyme activity in different tissues,and this response strategy hascertain tissue and temperature specificity, which specifically shows that the gonad is more sensitive to acute heat stress than the tube foot.
Key words: Strongylocentrotus intermedius; citrate synthase(CS); acute heat stress; gene expression; enzyme activity
Foundation items: “Xingliao Talents Plan” Project of Liaoning(XLYC2002107); Liaoning Innovative Talent Support Program of Colleges and Universities (LR2020065);
0 引言
【研究意义】海水温度作为最重要的环境因子之一,其变化会对海洋生物带来广泛且深远的负面影响。海水暖化通过影响三羧酸循环代谢进程而影响贝类(Cherkasov et al.,2007;Tomanek,2012;Gorenkova et al.,2013)、鱼类(Martinez et al.,2016)及刺胞生物(Hawkins and Wamer,2017)体内的生理和生化活动,如30 ℃高温胁迫会导致美洲牡蛎(Crassostrea virginica)腮组织细胞线粒体中的乌头酸酶活性降低34%(Sanni et al.,2008)。赵志刚等(2016)研究表明,随着驯化温度的升高,施氏鲟(Acipenser schrencki)幼鱼肝脏线粒体细胞色素C氧化酶(Cytochrome oxidase,CCO)活性逐渐增加。柠檬酸合酶(Citrate synthase,CS)是三羧酸循环的第一个限速酶,对维持不同类型细胞能量的产生起关键作用(Schlichtholz et al.,2005;Chen et al.,2014;MacPherson et al.,2017)。CS对高温较敏感,38 ℃可严重造成猪心脏线粒体中的CS失活(刘箭和庄野真理子,2001),32 ℃可导致大鼠(Rattus norvegicus)肝脏组织中的CS含量显著降低(姚凤云等,2018),但目前关于海水升温对中间球海胆(Strongylocentrotus intermedius)CS的影响尚无研究报道。因此,克隆中间球海胆CS基因(SiCS)并明确其响应海水高温胁迫的表达规律,可进一步丰富海洋棘皮类动物CS基因的序列信息和结构特点,为从能量代谢调节层面解析海洋生物应对海水暖化的分子响应规律提供参考资料,同时可为制定海水暖化背景下重要海洋经济棘皮类动物的养殖及管理策略提供新思路。【前人研究进展】CS定位于真核细胞线粒体基质中,具有专一的底物特异性,仅催化乙酰辅酶A(Acetyl-CoA)与草酰乙酸(Oxaloacetic acid)缩合生成柠檬酸(Citric acid)和辅酶A(CoA)(葛亚东等,2010)。CS广泛存在于动植物体内,根据其细胞定位情况,可分为线粒体CS(mCS)、乙醛酸循环体CS(gCS)和过氧化物酶体CS(pCS) (Schnarrenberger and Martin,2002)。CS除了参与能量调节外,还与动植物的抗逆性状存在一定关联(Pracharoenwattana et al.,2005)。在水稻(Oryza sativa)内过表达CS可加速根系大量合成及分泌柠檬酸,培育出耐低磷胁迫的转基因水稻植株(胡利华等,2006);在菠萝(Ananas comosus)果实的成熟过程中有机酸(主要是柠檬酸)含量与CS活性呈极显著正相关(张秀梅等,2007);在紫花苜蓿(Medicago sativa)中过表达CS可增强其对铝毒的耐受力(Barone et al.,2008)。在水产动物中,闫玉莲和谢小军(2011)研究证实CS活性可作为间接评价南方鲇(Silurus meridio-nalis)幼鱼线粒体功能的重要指标;Davis等(2016)研究表明南极洲翡翠岩鳕鱼(Trematomus bernacchii)可通过增强体内的CS活性来抵消海水酸化对有氧呼吸的影响;Jesus等(2018)研究发现当海水酸化条件为ΔpH=-0.4时卡氏雅罗鱼(Squalius carolitertii)肌肉组织中的CS活性显著降低;Li等(2019)研究表明,高盐(25‰)胁迫可增强中华绒螯蟹(Fenneropenaeus chinensis)后鳃组织中的CS活性,低盐(15‰和10‰)胁迫则导致中华绒螯蟹肌肉组织中的CS活性下降16.60%~59.11%。【本研究切入点】中间球海胆又称虾夷马粪海胆,具有棘刺短、性腺品质佳及生长快速等特点(常亚青等,2004;尹文露等,2020)。中间球海胆原产于日本北海道及俄罗斯远东地区,1989年由大连海洋大学从日本引进,现已发展成为我国最重要的海胆养殖品种(常亚青等,1999)。中间球海胆的最适生长水温在20 ℃左右,当水温超过23 ℃会严重影响其存活、摄食及生长发育,甚至导致大规模死亡(郑定发等,2019)。近年来受全球海水暖化的影响,我国北黄海中间球海胆养殖区夏季水温经常处于25~28 ℃(曾广恩等,2006),导致养殖中间球海胆大规模死亡事件频繁发生,而带来重大经济损失,因此亟待系统解析中间球海胆应对海水暖化的分子响应规律。【拟解决的关键问题】明确SiCS基因序列特征、组织表达情况及其对急性高温胁迫的响应规律,为后续研究SiCS基因功能及揭示其参与中间球海胆高温应答的分子机制提供理论依据。
1 材料与方法
1. 1 试验材料
供试中间球海胆购自大连市旅顺龙王塘养殖场,平均壳径40.00±5.01 mm,平均壳高26.00±2.03 mm,平均体质量38.20±5.04 g。试验前置于农业农村部北方海水增养殖重点实验室暂养1周。RNA提取试剂盒、PrimeScriptTM RT reagent Kit、SMARTer? RACE 5'/3' Kit及ABI 7500荧光定量PCR仪购自美国ABI公司;GENMED纯化线粒体肿胀光度法检测试剂盒购自上海杰美基因医药科技有限公司;组织线粒体分离试剂盒购自上海碧云天生物技術有限公司;CS测定试剂盒(A108-1)购自南京建成生物工程研究所有限公司;Epoch酶标仪购自美国BioTek公司。
1. 2 试验设计
1. 2. 1 急性高温胁迫 随机选取75只健康且活力好的中间球海胆,平均分成3组(每组25只),设1个对照组(20 ℃)和2个急性高温胁迫组(23和26 ℃)。对照组海胆养殖在20 ℃恒温循环水槽中,试验组海胆从暂养区直接转移至23和26 ℃的恒温循环水槽中进行急性高温胁迫,在整个急性高温胁迫过程中海胆活力减弱,但未出现死亡现象。
1. 2. 2 样品收集 选取健康、活力较好的中间球海胆,于冰上分别剖解收集管足、肠道、围口膜、体腔液和性腺等5个组织,参照武博琼等(2022)的方法进行保存,用于cDNA克隆、组织表达分析及总SiCS活性测定。同时,分别在23和26 ℃急性高温处理后第1.5、3.0﹑6.0﹑12.0﹑24.0﹑48.0﹑72.0及96.0 h时取样,每个时间点从各处理组中随机选取3只海胆,于冰上剖解收集管足和性腺组织,部分样品先进行液氮速冻,再置于-80 ℃冰箱保存备用,用于组织表达分析;另一部分样品直接-80 ℃冻存,用于线粒体肿胀度及总酶活性测定。
1. 3 SiCS基因克隆
按总RNA提取试剂盒说明提取中间球海胆各组织总RNA,参照PrimeScriptTM RT reagent Kit说明反转录合成cDNA模板,并参照SMARTer? RACE 5'/3' Kit说明合成5'/3'末端模板。从已构建的中间球海胆转录组文库中搜索CS基因Unigene序列,经BLASTx比对分析后使用Primer Premier 5.0设计SiCS基因特异性扩增引物(表1)。以cDNA为模板进行核心片段克隆,以5'/3'末端cDNA为模板进行5'/3'-RACE扩增。PCR反应体系及扩增程序参照李莹莹等(2020)的方法,PCR扩增产物电泳、切胶回收、连接转化及菌液PCR鉴定参照李蒙等(2019)的方法。
1. 4 SiCS基因生物信息学分析
使用DNAMAN 6.0完成SiCS基因cDNA序列拼接和组装,然后分别采用BLASTx(http://blast.ncbi.nlm.nih.gov/Blast.cgi)、ORF Finder(htttp://www.ncbi.nlm.nih.gov/orffinder/)、EXPASY Proteomics Server(http://www.expasy.org)、HMMER(http://hmmer.org/download.html)、PSIRED v3.3(http://bioinf.cs.ucl.ac.uk/ psipred/)、SWISS-MODEL(https://swissmodel.expasy. org/)及MEGA等在线软件完成序列比对分析、开放阅读框(ORF)确定、蛋白理化性质分析、蛋白结构域和二级结构预测、蛋白三维空间结构建模及系统进化树构建。
1. 5 中间球海胆组织线粒体肿胀度测定
采用GENMED纯化线粒体肿胀光度法检测试剂盒检测中间球海胆管足和性腺的线粒体肿胀度,具体操作:采用组织线粒体分离试剂盒分离待测的线粒体样品;移取20.0 μL线粒体样品至96孔细胞板中,加入170.0 μL GENMED缓冲液(Reagent A),混匀后立即放入酶标仪(波长520 nm)中读取0 min初始吸光值(OD520-0);室温静置1 min后加入10.0 μL GENMED膨胀液(Reagent B),混匀后即刻放入酶标仪(波长520 nm)中动态记录10 min吸光值(OD520-10)。
线粒体肿胀度= OD520-0-OD520-10
1. 6 实时荧光定量PCR检测SiCS基因组织表达规律
按照PrimeScriptTM RT reagent Kit说明合成cDNA模板,以β-actin为内参基因,对扩增引物的特异性和扩增效率进行检测。利用ABI 7500荧光定量PCR仪进行实时荧光定量PCR扩增,其反应体系参照柳林等(2019)的方法,扩增程序:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,进行45个循环;对扩增结果进行熔解曲线分析,排除非特异性扩增污染。采用2-ΔΔCt法換算SiCS基因相对表达量(Livak and Schmittgen,2001)。
1. 7 中间球海胆组织总SiCS活性测定
取0.5~1.0 g组织样品置于液氮中研磨,按1∶9(g∶mL)的比例加入提取液,冰浴匀浆,制成10%待测悬液。10000 r/min离心10 min,取上清液,参照CS测定试剂盒(A108-1)说明,利用Epoch酶标仪测定中间球海胆组织总SiCS活性。反应底物在412 nm波长下,测定初始吸光值(A0),转入37 ℃孵育箱温浴15 min后再放入酶标仪测定吸光值(A15),并计算各孔ΔA= A15-A0。
总SiCS活性(U/mg)=[△AU-△AO13.6×10-3×d×T]×N1÷C×N
式中,ΔAU代表测定孔吸光值变化量;ΔAO代表空白孔吸光值变化量;13.6×10-3为摩尔消光系数;T代表反应时间(15 min);d代表比色光径(cm);N1代表体系稀释倍数;C代表样本蛋白浓度(mg/mL);N代表样本测试前稀释倍数。
1. 8 统计分析
采用Excel 2016进行试验数据整理,使用SPSS 22.0进行单因素方差分析(One-way ANVOA),并以Origin 8.0制图。
2 结果与分析
2. 1 SiCS基因克隆及序列分析结果
对测序结果进行拼接比对分析,得到SiCS基因cDNA序列全长2971 bp,其中,ORF为1395 bp(编码464个氨基酸残基),5'端非编码区(5'-UTR)为96 bp,3'端非编码区(3'-UTR)为1480 bp,起始密码子(ATG)位于序列的第97 bp处,终止密码子(TAA)位于序列的第1489 bp,且包含30 bp的poly(A)尾巴(图1)。
2. 2 SiCS蛋白理化性质预测分析结果
采用ProtParam分析SiCS蛋白理化性质,结果显示,SiCS蛋白分子量为51.48 kD,理论等电点(pI)为6.09;带负电氨基酸残基数(Asp+Glu)52个,带正电氨基酸残基数(Arg+Lys)46个;不稳定系数为30.84,属于稳定蛋白;脂肪族氨基酸系数为89.55,说明SiCS蛋白脂肪族氨基酸含量较高;总平均亲水性(GRAVY)为-0.178,即为温和疏水性蛋白(图2)。SignalP预测结果显示,在SiCS蛋白氨基酸序列中未检测到信号肽,属于非分泌型蛋白(图3);TMHMM预测结果显示,SiCS蛋白为非跨膜蛋白(图4)。蛋白二级结构预测结果显示,SiCS蛋白中α-螺旋占43.86%、β-折叠占7.02%、无规则卷曲占49.12%(图5-A);SiCS蛋白C-端结构域位于第73~451氨基酸处,且在302H、348H和403D位检测到活性中心(图5-B)。以已知的野猪CS蛋白晶体结构(PDB登录号5uqs.1A)为模板进行三维结构同源建模,结果(图6)显示预测得到的SiCS蛋白三维结构模型与模板间的一致性为73.97%。
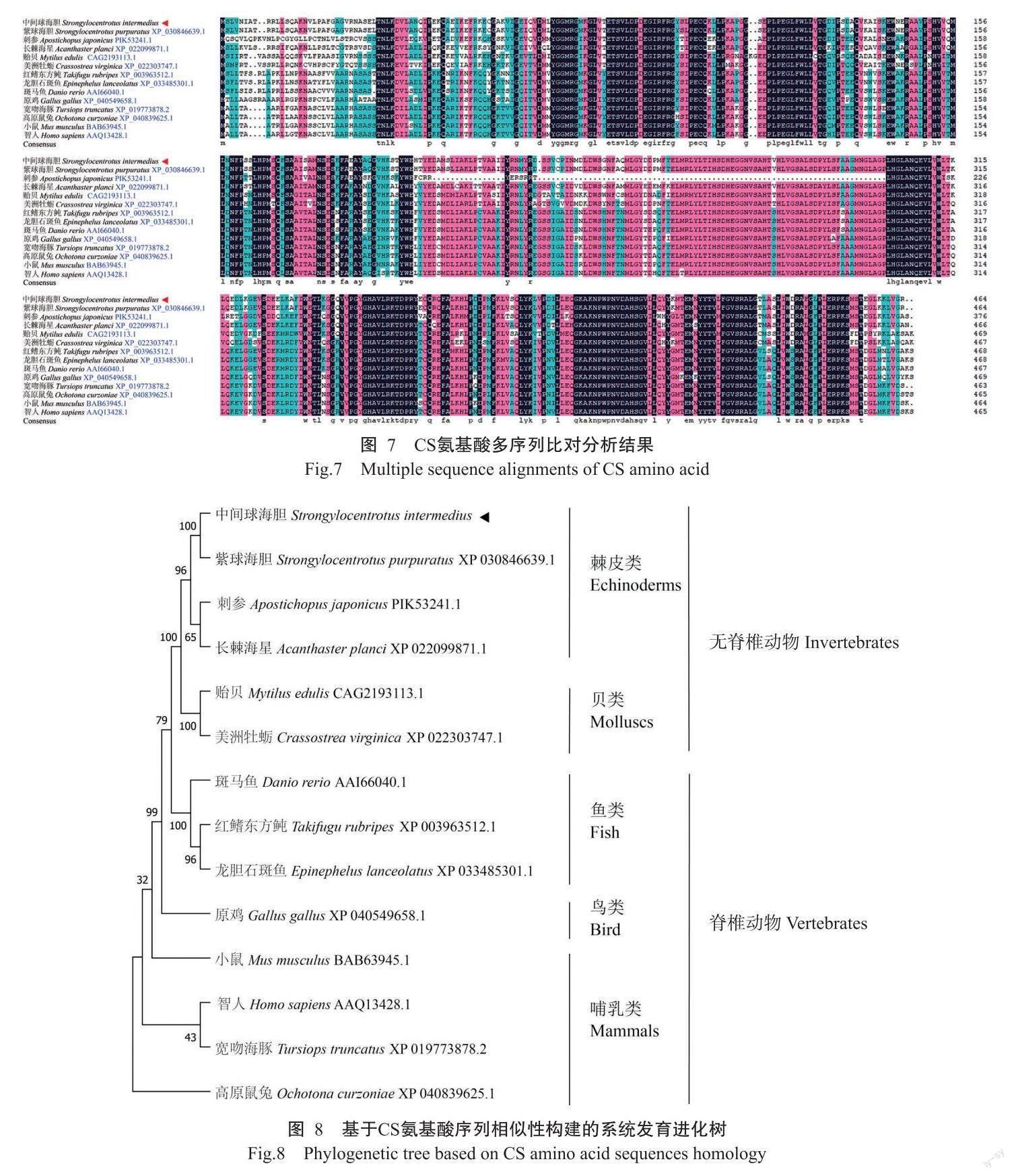
2. 3 CS氨基酸多序列比对及系统发育进化分析结果
CS氨基酸多序列比对分析结果显示,14种生物(表2)的CS氨基酸序列相似性为82.91%(图7);除刺参外,SiCS氨基酸序列与其他12种生物的CS氨基酸序列相似性均大于70.00%,其中,与紫球海胆(S. purpuratus)的CS氨基酸序列相似性最高,为92.90%,与长棘海星的CS氨基酸序列相似性为79.18%。由基于CS氨基酸序列相似性构建的系统发育进化树(图8)可知,中间球海胆与紫球海胆、刺参和长棘海星聚为一支,其中与紫球海胆的亲缘关系最近。
2. 4 急性高温胁迫对中间球海胆管足和性腺线粒体肿胀度的影响
如图9-A所示,与对照组(20 ℃)相比,23 ℃急性高温胁迫后第1.5和3.0 h中间球海胆管足线粒体肿胀度呈极显著上升趋势(P<0.01,下同),然后缓慢恢复至正常水平;经26 ℃急性高温胁迫后,中间球海胆管足线粒体肿胀度呈先上升后下降的变化趋势,至胁迫后第6.0 h达最高值,而后开始降低;与23 ℃急性高温胁迫相比,26 ℃急性高温胁迫整体上呈下降趋势。由图9-B可知,与对照组(20 ℃)相比,23 ℃急性高温胁迫后第1.5和3.0 h中间球海胆性腺线粒体肿胀度极显著上升,从胁迫后第6.0 h开始呈下降趋势;经26 ℃急性高温胁迫后,中间球海胆性腺线粒体肿胀度呈先上升后下降再上升的变化趋势,胁迫后第48.0 h降至最低值;与23 ℃急性高温胁迫相比,26 ℃急性高温胁迫后整体上呈下降趋势。
2. 5 SiCS基因和总SiCS活性的组织表达规律及其对急性高温胁迫的响应
2. 5. 1 SiCS基因和总SiCS活性的组织表达规律 如图10-A所示,SiCS基因在中间球海胆的管足、性腺、肠道、体腔细胞及围口膜等组织中均有表达,其相對表达量排序为体腔细胞>围口膜>性腺>管足>肠道,具有一定的组织特异性。SiCS基因相对表达量以中间球海胆体腔细胞的最高,显著高于其他4种组织(P<0.05,下同),管足和肠道中的相对表达量较低,显著低于其他3种组织。如图10-B所示,中间球海胆各组织的总SiCS活性排序为管足>肠道>围口膜>性腺>体腔细胞,其中,管足和肠道的总SiCS活性显著高于其他3种组织,围口膜和性腺的总SiCS活性又显著高于体腔细胞,而体腔细胞的总SiCS活性最低。
2. 5. 2 急性高温胁迫对SiCS基因表达及总SiCS活性的影响 如图11-A所示,与对照组(20 ℃)相比,经23和26 ℃急性高温胁迫后中间球海胆管足的SiCS基因相对表达量在不同时间点呈先上升后下降的波动变化规律。其中,在23 ℃急性高温胁迫中,中间球海胆管足SiCS基因相对表达量在胁迫后第6.0 h达第1次峰值,第96.0 h达第2次峰值,而在胁迫后第1.5和48.0 h分别出现2次谷值;在26 ℃急性高温胁迫中,中间球海胆管足SiCS基因相对表达量在胁迫后第3.0 h达第1次峰值,第72.0 h达第2次峰值,在胁迫后第24.0 h达最低值。与23 ℃急性高温胁迫相比,经26 ℃急性高温胁迫后中间球海胆管足SiCS基因相对表达量也呈先上升后下降的波动变化规律。在中间球海胆性腺SiCS基因相对表达量方面,与对照组(20 ℃)相比,经23和26 ℃急性高温胁迫后SiCS基因相对表达量均呈上升趋势,且在胁迫后第3.0 h达第1次峰值,第72.0 h达第2次峰值;与23 ℃急性高温胁迫相比,经26 ℃急性高温胁迫后中间球海胆性腺SiCS基因相对表达量呈先下降后上升的波动变化规律(图11-B)。
如图11-C所示,与对照组(20 ℃)相比,经23 ℃急性高温胁迫后中间球海胆管足总SiCS活性呈先下降后上升再下降的变化趋势,在胁迫后第6.0 h达峰值;经26 ℃急性高温胁迫后,中间球海胆管足总SiCS活性极显著下降;与23 ℃急性高温胁迫相比,26 ℃急性高温胁迫后总SiCS活性整体上呈下降趋势。在中间球海胆性腺总SiCS活性方面,与对照组(20 ℃)相比,经23 ℃急性高温胁迫后中间球海胆性腺总SiCS活性在各时间点均呈极显著下降趋势,且在胁迫后第3.0和72.0 h出现2次谷值;经26 ℃急性高温胁迫后中间球海胆性腺总SiCS活性在胁迫后第3.0 h达第1次峰值,第48.0 h达第2次峰值,而在胁迫后第6.0和72.0 h分别出现2次谷值;与23 ℃急性高温胁迫相比,经26 ℃急性高温胁迫后中间球海胆性腺总SiCS活性整体上呈先上升后下降的变化趋势(图11-D)。
3 讨论
3. 1 SiCS基因序列特征
本研究利用RACE首次克隆获得SiCS基因cDNA序列全长(NCBI登录号ON496991),编码一个具有464个氨基酸残基的蛋白。CS氨基酸多序列比对分析发现,SiCS氨基酸序列与紫球海胆的CS氨基酸序列相似性最高,达92.90%,仅存在1个氨基酸残基差异,提示CS同源蛋白在进化上具有一定的种属特异性。在蛋白空间结构方面,SiCS蛋白与亲缘关系较远的野猪CS蛋白在三维结构上差异较小,表明SiCS蛋白空间结构及其生物学功能在进化过程中具有较高的保守性。由基于CS氨基酸序列相似性构建的系统发育进化树可知,中间球海胆与同属于棘皮动物的紫球海胆、刺参和长棘海星聚为一支,处于无脊椎动物与脊椎动物的过渡位置,与海胆类传统的进化和分类地位相符。此外,SiCS氨基酸序列与长棘海星CS氨基酸序列的相似性高于其与刺参CS氨基酸序列的相似性,故推测SiCS蛋白与长棘海星CS蛋白的亲缘关系较近,而与刺参CS蛋白的亲缘关系较远,与崔东遥等(2019)研究报道的中间球海胆LDH基因系统进化分析结果相似。
3. 2 急性高温胁迫对中间球海胆管足和性腺线粒体肿胀变化的影响
线粒体形态具有高度的可塑性,极易受生理和病理条件的影响(Vincent et al.,2016)。线粒体肿胀是指线粒体内膜Na+、K+-ATP酶和Ca2+-ATP酶活性过低(Venkatraman et al.,2008),而导致线粒体膜电位(MMP)缺失及线粒体通透性转换孔(mPTP)开放,引起线粒体蛋白渗透压升高和基质水肿的状态(Rodriguez-Enriquezs et al.,2004)。线粒体肿胀后会导致外膜破裂,线粒体功能失调(曹颖等,2010),因此线粒体肿胀常用于评价线粒体对抗外界应激的能力(徐莉等,2012)。本研究结果表明,在23和26 ℃急性高温胁迫下,中间球海胆管足和性腺中的线粒体肿胀度与对照组(20 ℃)相比均呈先升高再下降的变化趋势。经23 ℃急性高温胁迫后,中间球海胆管足和性腺线粒体肿胀度均在胁迫后第1.5和3.0 h极显著高于对照组,随后逐渐下降至与对照组无显著差异,表明23 ℃急性高温胁迫引起的线粒体肿胀现象经3.0 h适应后有所缓解,即23 ℃可能仍在中间球海胆的可适应温度范围内。经26 ℃急性高温胁迫后,在胁迫前6.0 h的管足和胁迫前3.0 h的性腺中,线粒体肿胀度均与对照组无显著差异,但在之后的胁迫过程中线粒体肿胀度均极显著低于对照组,故推测26 ℃已超过中间球海胆的自我调节范围,导致线粒体膜发生破损,且持续高温胁迫导致的损伤难以恢复,也是中间球海胆在高温胁迫时运动能力降低,最后逐渐死亡的主要原因之一。因此,后续研究应准确掌握中间球海胆线粒体自我调节的极限温度。
3. 3 SiCS基因及总SiCS活性的组织表达规律
实时荧光定量PCR检测结果显示,SiCS基因在中间球海胆管足、围口膜、体腔细胞、肠道和性腺等组织中均有表达,且具有鲜明的组织特异性,与赵兰英(2013)研究报道的黄河裸裂尻鱼(Schizopygopsis pylzovi)CS基因组织分布规律相似。在同一组织中,SiCS基因相对表达量与总SiCS活性呈相反的变化趋势。如SiCS基因在体腔细胞中的相对表达量最高,但总SiCS活性最低,可能是体腔细胞中SiCS主要以尚未激活的酶原形式存在。总SiCS活性在中间球海胆的管足和肠道中较高,表明CS除了参与调控机体能量代谢外,还与动植物的抗逆性状存在一定关联。中间球海胆的管足直接暴露于外部环境,肠道可通过口器直接与外部环境接触,较低的SiCS基因表达水平有助于中间球海胆在环境因子快速变化时通过上调表达SiCS基因及时进行响应,维持代谢水平和能量供应以抵抗不利影响,与焦仁和等(2022)、武博琼等(2022)的研究结果相似。
3. 4 急性高温对中间球海胆管足和性腺SiCS基因表达及总SiCS活性的影响
管足是海胆的运动和触觉器官,对外界环境变化敏感,可率先发生响应;性腺是海胆重要的繁殖及能量储存器官,也是经济海胆的主要可食用部分。为揭示中间球海胆管足和性腺响应高温胁迫的分子机制,本研究对中间球海胆管足和性腺中的SiCS基因相对表达量及总SiCS活性进行检测,结果表明,经23和26 ℃急性高温胁迫后,管足和性腺的SiCS基因相对表达量及总SiCS活性均呈波动变化规律,但在不同高温胁迫下和不同组织中有所差异。CS是三羧酸循环中的第一关键酶,而三羧酸循环是动物体内糖类、脂类和氨基酸三大营养素的最终代谢通路,也是糖类、脂类及氨基酸代谢联系的枢纽(樊佳佳等,2014)。此外,CS活性的降低可引起机体能量代谢紊乱(Balaban et al.,2005;Dirks et al.,2006)。本研究结果表明,面对高温胁迫时中间球海胆可能通过增加三羧酸循环代谢酶活性及提高能量供应,以抵抗高温胁迫造成的负面影响;随着CS的不断积累,又负反馈调节SiCS基因表达,二者间波动调节以响应高温胁迫。在酶活性方面,经26 ℃急性高温胁迫后管足和性腺的SiCS活性普遍高于23 ℃急性高温胁迫,说明随着胁迫温度的升高,中间球海胆组织需要更多SiCS活性来调节其生理活动,以缓减高温胁迫造成的负面影响。本研究还发现,经23和26 ℃急性高温胁迫后,中间球海胆性腺总SiCS活性普遍高于管足,说明性腺对高温胁迫更加敏感。Delorme和Sewell(2016)研究发现,逐渐升高的海水温度对海洋生物性腺生长发育可能会产生负面影响,故推测在应对高温胁迫时中间球海胆的性腺比管足需要更多能量以保证其正常的生理功能,即中间球海胆性腺对急性高温胁迫可能较管足更敏感。
综上所述,中间球海胆可能通过调整组织中的SiCS基因相对表达及SiCS活性来响应急性高温胁迫,且这种响应策略存在一定的组织和温度特异性。因此,在后续的研究中应从蛋白水平进一步探究中间球海胆不同组织中SiCS基因响应高温胁迫的表达规律,并在此基础上分析SiCS基因表達、蛋白表达及其酶活性水平与高温胁迫或高温耐受的相关性,系统解析SiCS基因在中间球海胆响应高温胁迫中的分子机制,为制定海水暖化背景下重要海洋经济棘皮类动物的养殖及管理策略提供新思路。
4 結论
中间球海胆可能通过调整组织中的SiCS基因相对表达及SiCS活性来响应急性高温胁迫,且这种响应策略存在一定的组织和温度特异性,具体表现为性腺对急性高温胁迫较管足更敏感。
参考文献:
曹颖,张敏,董嘉良,郭彦青,赵晓丽,王丽艳,陈立军,康英姿. 2010. 有氧运动对大鼠骨骼肌线粒体Na+,K+-ATP酶和Ca2+-ATP酶及线粒体肿胀的影响[J]. 中国组织工程研究与临床康复,14(37):6971-6974. [Cao Y,Zhang M,Dong J L,Guo Y Q,Zhao X L,Wang L Y,Chen L J,Kang Y Z. 2010. Effects of aerobic exercise on the activity of mitochondrial Na+,K+-ATPase,Ca2+-ATPase and mitochondrial swelling[J]. Chinese Journal of Tissue Engineering Research,14(37):6971-6974.] doi:10.3969/j.issn. 1673-8225.2010.37.031.
常亚青,王子臣,王国江. 1999. 温度和藻类饵料对虾夷马粪海胆摄食及生长的影响[J]. 水产学报,23(1):69-76. [Chang Y Q,Wang Z C,Wang G J. 1999. Effect tempe-rature and algae on feeding and growth in sea urchin,Strongylocentrotus intermedius[J]. Journal of Fisheries of China,23(1):69-76.]
常亚青,丁君,宋坚,杨威. 2004. 海参、海胆生物学研究与养殖[M]. 北京:海洋出版社. [Chang Y Q,Ding J,Song J,Yang W. 2004. Biological research and breeding of sea cucumber and sea urchin[M]. Beijing:Ocean Press.]
崔东遥,任丽媛,邢冬飞,孙景贤,李莹莹,常亚青,湛垚垚. 2019. 中间球海胆乳酸脱氢酶基因克隆及其对海水酸化的响应[J]. 水产学报,43(6):1423-1437. [Cui D Y,Ren L Y,Xing D F,Sun J X,Li Y Y,Chang Y Q,Zhan Y Y. 2019. Identification and characterization of LDH gene and its response to seawater acidification in the sea urchin (Strongylocentrotus intermedius)[J]. Journal of Fisheries of China,43(6):1423-1437.] doi:10.11964/jfc.20180811418.
樊佳佳,刘小献,白俊杰,于凌云. 2014. 草鱼柠檬酸合酶基因SNP筛选及与生长性状的关联分析[J]. 华中农业大学学报,33(3):84-89. [Fan J J,Liu X X,Bai J J,Yu L Y. 2014. Detection of SNP incitrate synthase gene and association analysis with growth traits in grass carp (Ctenopharyngodon idellus)[J]. Journal of Huazhong Agricultural University,33(3):84-89.] doi:10.3969/j.issn.1000-2421.2014.03.015.
葛亚东,潘蔚,汪劼,朱国萍. 2010. 柠檬酸合酶的分子生物学研究进展[J]. 生物学杂志,27(3):59-62. [Ge Y D,Pan W,Wang J,Zhu G P. 2010. Advances in molecular biology of citrate synthase[J]. Journal of Biology,27(3):59-62.] doi:10.3969/j.issn.1008-9632.2010.03.059.
胡利华,吴慧敏,周泽民,林拥军. 2006. 利用农杆菌介导法将柠檬酸合成酶基因(CS)导入籼稻品种明恢86[J]. 分子植物育种,4(2):160-166. [Hu L H,Wu H M,Zhou Z M,Lin Y J. 2006. Introduction of citrate synthase gene (CS) into an elite indica rice restorer line minghui 86 by agrobacterium-mediated method[J]. Molecular Plant Bree-ding,4(2):160-166.] doi:10.3969/j.issn.1672-416X.2006. 02.003.
焦仁和,崔东遥,武博琼,宋坚,常亚青,湛垚垚. 2022. 中间球海胆SiPFK基因的克隆及酸化-高温胁迫对其表达的影响[J]. 农业生物技术学报,30(10):1962-1975. [Jiao R H,Cui D Y,Wu B Q,Song J,Chang Y Q,Zhan Y Y. 2022. Cloning of SiPFK gene from Strongylocentrotus intermedius and the effect of acidification-high temperature stress on its expression[J]. Journal of Agricultural Biotechnology,30(10):1962-1975.] doi:10.3969/j.issn.1674-7968.2022.10.011.
李蒙,王金凤,黄骞,李才文. 2019. 三疣梭子蟹含硒谷胱甘肽过氧化物酶基因克隆及其表达分析[J]. 海洋与湖沼,50(1):149-158. [Li M,Wang J F,Huang Q,Li C W. 2019. Molecular cloning and expression of a selenium-dependent glutathione peroxidase gene from Portunus trituberculatus[J]. Oceanologia et Limnologia Sinica,50(1):149-158.] doi:10.11693/hyhz20180500128.
李莹莹,崔东遥,程操,孙景贤,刘丽,赵谭军,尹文露,常亚青,湛垚垚. 2020. 光棘球海胆TGFBR2基因的克隆及其对海水酸化的响应[J]. 基因组学与应用生物学,39(12):5507-5519. [Li Y Y,Cui D Y,Cheng C,Sun J X,Liu L,Zhao T J,Yin W L,Chang Y Q,Zhan Y Y. 2020. Cloning and characterization of TGFBR2 gene in the sea urchin Mesocentrotus nudus and its response to seawater acidification[J]. Genomics and Applied Biology,39(12):5507-5519.] doi:10.13417/j.gab.039.005507.
刘箭,庄野真理子. 2001. 高温下线粒体小分子热激蛋白对柠檬酸合成酶、线粒体和花粉粒的保护作用[J]. 植物生理学报,27(5):375-380. [Liu J,Mariko S. 2001. Mitochondrial small heat-shock protein protects citrate synthase,mitochondria and pollen at high temperature[J]. Acta Phytophysiologica Sinica,27(5):375-380.] doi:10.3321/j.issn:1671-3877.2001.05.003.
柳林,張宝警,李莹莹,姜惠婷,刘丽,刘印,常亚青,湛垚垚. 2019. 中间球海胆smad2/3基因克隆、组织表达及其脂多糖刺激响应[J]. 大连海洋大学学报,34(3):345-354. [Liu L,Zhang B J,Li Y Y,Jiang H T,Liu L,Liu Y,Chang Y Q,Zhan Y Y. 2019. cDNA cloning,expression,and lipopolysaccharide stimulation response of a novel smad2/3 gene in sea urchin Stronglocentrotus intermedius[J]. Journal of Dalian Ocean University,34(3):345-354.] doi:10.16535/j.cnki.dlhyxb.2019.03.007.
武博琼,崔东遥,焦仁和,宋坚,湛垚垚,常亚青. 2022. 中间球海胆己糖激酶基因克隆及高温—酸化胁迫对其表达影响的初步研究[J]. 中国农业科技导报,24(7):205-217. [Wu B Q,Cui D Y,Jiao R H,Song J,Zhan Y Y,Chang Y Q. 2022. Cloning of hexokinase gene from Strongylocentrotus intermedius and its expression response to high temperature-acidification stress[J]. Journal of Agricultu-ral Science and Technology,24(7):205-217.] doi:10. 13304/j.nykjdb.2021.1020.
徐莉,曹颖,张敏. 2012. 线粒体酶活性及线粒体肿胀与不同运动强度的关系[J]. 中国组织工程研究,16(42):7893-7896. [Xu L,Cao Y,Zhang M. 2012. Effects of different exercise intensities on the activity of mitochondrial enzymes and mitochondrial swelling[J]. Chinese Journal of Tissue Engineering Research,16(42):7893-7896.]
闫玉莲,谢小军. 2011. 南方鲇不同组织间线粒体代谢的比较研究[J]. 水生生物学报,35(2):262-269. [Yan Y L,Xie X J. 2011. Comparative studies on metabolism of mitochondria isolated from various tissues of Southern catfish,Silurus meridionalis Chen[J]. Acta Hydrobiologica Sinic,35(2):262-269.] doi:10.3724/SP.J.1035.2011.00262.
姚凤云,张大玲,王炳志,刘春花,翁美芝,左铮云. 2018. 高温对大鼠组织CS、OGDH含量和下丘脑线粒体数量的影响[J]. 动物医学进展,39(4):59-62. [Yao F Y,Zhang D L,Wang B Z,Liu C H,Weng M Z,Zuo Z Y. 2018. Effects of high temperature on CS,OGDH contents and hypothalamus mitochondria numbers in rats[J]. Progress in Veterinary Medicine,39(4):59-62.] doi:10.3969/j.issn. 1007-5038.2018.04.012.
尹文露,崔東遥,李莹莹,孙景贤,李雯琪,常亚青,湛垚垚. 2020. 中间球海胆丙酮酸激酶(PK)基因克隆及其对海水酸化的响应[J]. 大连海洋大学学报,35(3):360-367. [Yin W L,Cui D Y,Li Y Y,Sun J X,Li W Q,Chang Y Q,Zhan Y Y. 2020. Cloning and response of pyruvate kinase (PK) gene to seawater acidification in sea urchin Strongylocentrotus intermedius[J]. Journal of Dalian Ocean University,35(3):360-367.] doi:10.16535/j.cnki.dlhyxb. 2019-175.
曾广恩,练树民,程旭华,华祖林,齐义泉. 2006. 东、黄海海表面温度季节内变化特征的EOF分析[J]. 海洋科学进展,24(2):146-155. [Zeng G E,Lian S M,Cheng X H,Hua Z L,Qi Y Q. 2006. EOF analysis of intra-seasonal varia-bilities of SST in the East China Sea and Yellow Sea[J]. Advances in Marine Science,24(2):146-155.] doi:10. 3969/j.issn.1671-6647.2006.02.002.
张秀梅,杜丽清,孙光明,弓德强,陈佳瑛,李伟才,谢江辉. 2007. 菠萝果实发育过程中有机酸含量及相关代谢酶活性的变化[J]. 果树学报,24(3):381-384. [Zhang X M,Du L Q,Sun G M,Gong D Q,Chen J Y,Li W C,Xie J H. 2007. Changes in organic acid concentr ations and the relative enzyme activities during the development of Cayenne pineapple fruit[J]. Journal of Fruit Science,24(3):381-384.] doi:10.3969/j.issn.1009-9980.2007.03.025.
赵兰英. 2013. 黄河裸裂尻鱼冷适应主要相关蛋白和酶的分子进化特征及其生态学意义[D]. 西宁:青海大学. [Zhao L Y. 2013. Characteristics of molecular evolution for major cold-adapted proteins and enzymes in Schizopygopisis pylzovi and their ecological significance[D]. Xi-ning:Qinghai University.]
赵志刚,李晋南,徐奇友,罗亮,王常安,王连生,都雪,王海. 2016. 不同驯化温度对施氏鲟幼鱼肝脏线粒体代谢的影响[J]. 大连海洋大学学报,31(6):607-611. [Zhao Z G,Li J N,Xu Q Y,Luo L,Wang C A,Wang L S,Du X,Wang H. 2016. Effects of different acclimation temperature on mitochondrial metabolism in liver of juvenile amur sturgeon Acipenser schrenckii Brandt[J]. Journal of Dalian Ocean University,31(6):607-611.] doi:10.16535/j.cnki.dlhyxb.2016.06.004.
郑定发,罗嘉,常亚青. 2019. 温度对不同规格中间球海胆存活、摄食和生长的影响综述[J]. 河北渔业,(3):55-57. [Zheng D F,Luo J,Chang Y Q. 2019. A review of the effects of temperature on survival,feeding and growth of sea urchins with different sizes[J]. Hebei Fisheries,(3):55-57.] doi:10.3969/j.issn.1004-6755.2019.03.014.
Barone P,Rosellini D,LaFayette P,Bouton J,Veronesi F,Parrott W. 2008. Bacterial citrate synthase expression and soil aluminum tolerance in transgenic alfalfa[J]. Plant Cell Reports,27(5):893-901. doi:10.1007/s00299-008-0517-x.
Balaban R S,Nemoto S,Finkel T. 2005. Mitochondria,oxidants,and aging[J]. Cell,120(4):483-495. doi:10.1016/j.cell.2005.02.001.
Cherkasov A A,Overton R A,Sokolov E P,Sokolova I M. 2007. Temperature-dependent effects of cadmium and purine nucleotides on mitochondrial aconitase from a marine ectotherm,Crassostrea virginica:A role of temperature in oxidative stress and allosteric enzyme regulation[J]. The Journal of Experimental Biology,210(1):46-59. doi:10.1242/jeb.02589.
Chen L,Liu T,Zhou J H,Wang Y F,Wang X R,Di W,Zhang S. 2014. Citrate synthase expression affects tumor phenotype and drug resistance in human ovarian carcinoma[J]. PLoS One,9(12):e115708. doi:10.1371/journal.pone.0115708.
Davis B E,Miller N A,Flynn E E,Todgham A E. 2016. Juvenile antarctic rockcod (Trematomus bernacchii) are phy-siologically robust to CO2-acidified seawater[J]. The Journal of Experimental Biology,219(8):1203-1213. doi:10. 1242/jeb.133173.
Dirks A J,Hofer T,MarzettI E,Pahor M,Leeuwenburgh C. 2006. Mitochondrial DNA mutations,energy metabolism and apoptosis in aging muscle[J]. Ageing Research Reviews,5(2):179-195. doi:10.1016/j.arr.2006.03.002.
Delorme N J,Sewell M A. 2016. Effects of warm acclimation on physiology and gonad development in the sea urchin Evechinus chloroticus[J]. Comparative Biochemistry and Physiology. Part A:Molecular & Integrative Physiology,198:33-40. doi:10.1016/j.cbpa.2016.03.020.
Gorenkova N,Robinson E,Grieve D J,Galkin A. 2013. Conformational change of mitochondrial complex I increases ROS sensitivity during ischemia[J]. Antioxidants & Redox Signaling,19(13):1459-1468. doi:10.1089/ars.2012. 4698.
Hawkins T D,Wamer M E. 2017. Warm preconditioning protects against acute heat-induced respiratory dysfunction and delays bleaching in a symbiotic sea anemone[J]. The Journal of Experimental Biology,220(6):969-983. doi:10.1242/jeb.150391.
Jesus T F,Rosa I C,Repolho T,Lopes A R,Pimentel M S,Almeida-Val V M F,Coelho M M,Rosa R. 2018. Different ecophysiological responses of freshwater fish to warming and acidification[J]. Comparative Biochemistry and Phy-siology. Part A:Moleular & Integrative Physiology,216:34-41. doi:10.1016/j.cbpa.2017.11.007.
Li J T,Xu X W,Li W T,Zhang X M. 2019. Linking energy metabolism and locomotor variation to osmoregulation in Chinese shrimp Fenneropenaeus chinensis[J]. Comparative Biochemistry and Physiology. Part B:Biochemistry and Molecular Biology,234:58-67. doi:10.1016/j.cbpb. 2019.05.006.
Livak K J,Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods,25(4):402-408. doi:10.1006/meth.2001.1262.
Martinez E,Hendricks E,Menze M A,Torres J J. 2016. Physio-logical performance of warm-adapted marine ectotherms:Thermal limits of mitochondrial energy transduction efficiency[J]. Comparative Biochemistry and Physiology. Part A:Moleular & Integrative Physiology,191:216-225. doi:10.1016/j.cbpa.2015.08.008.
MacPherson S,Horkoff M,Gravel C,Hoffmann T,Zuber J,Lum J J. 2017. STAT3 regulation of citrate synthase is essential during the initiation of lymphocyte cell growth [J]. Cell Reports,19(5):910-918. doi:10.1016/j.celrep. 2017.04.012.
Pracharoenwattana I,Cornah J E,Smith S M. 2005. Arabidopsis peroxisomal citrate synthase is required for fatty acid respiration and seed germination[J]. The Plant Cell,17(7):2037-2048. doi:10.1105/tpc.105.031856.
Rodriguez-Enriquezs S,He L H,Lemasters J J. 2004. Role of mitochondrial permeability transition pores in mitochondrial autophagy[J]. The International Journal of Biochemi-stry and Cell Biology,36(12):2463-2472. doi:10.1016/j.biocel.2004.04.009.
Sanni B,Williams K,Sokolov E P,Sokolova I M. 2008. Effects of acclimation temperature and cadmium exposure on mitochondrial aconitase and LON protease from a model marine ectotherm,Crassostrea virginica[J]. Comparative Biochemistry and Physiology. Part A:Toxicology & Pharmacology,147(1):101-112. doi:10.1016/j.cbpc. 2007.08.005.
Schnarrenberger C,Martin W. 2002. Evolution of the enzymes of the citric acid cycle and the glyoxylate cycle of higher plants:A case study of endosymbiotic gene transfer[J]. European Journal of Biochemistry,269(3):868-883. doi:10.1046/j.0014-2956.2001.02722.x.
Schlichtholz B,Turyn J M,Goyke E,Biernacki M,Jaskiewicz K,Sledzinski Z,Swierczynski J. 2005. Enhanced citrate synthase activity in human pancreatic cancer[J]. Pancreas,30(2):99-104. doi:10.1097/01.mpa.0000153326.69816.7d.
Tomanek L. 2012. Environmental proteomics of the mussel Mytilus:Implications for tolerance to stress and change in limits of biogeographic ranges in response to climate change[J]. Integrative and Comparative Biology,52(5):648-664. doi:10.1093/icb/ics114.
Vincent A E,Ng Y S,White K,Davey T,Mannella C,Fal-kous G,Feeney C,Schaefer A M,McFarland R,Gorman G S,Taylor R W,Turnbull D M,Picard M. 2016. The spectrum of mitochondrial ultrastructural defects in mitochondrial myopathy[J]. Scientific Reports,6:30610. doi:10.1038/srep30610.
Venkatraman M,Konga D,Peramaiyan R,Ganapathy E,Dhanapal S. 2008. Reduction of mitochondrial oxidative damage and improved mitochondrial efficiency by admini-stration ofcrocetin against benzoa[a] pyrene induced experimental animals[J]. Biological and Pharmaceutical Bulletin,31(9):1639-1645. doi:10.1248/bpb.31.1639.
(責任编辑 兰宗宝)

