鼠源Desmin基因克隆表达及其生物信息学分析
张文 李梦茹 王菁 张传亮 段辰星 宋丹丹 黄茂发 罗廷荣 梁晶晶 李晓宁


摘要:【目的】構建鼠源III型中间丝蛋白Desmin真核/原核表达载体,明确鼠源Desmin蛋白生物学功能,为在体外及细胞内表达系统中鉴定Desmin互作蛋白及探索其作用网络提供理论依据。【方法】通过RT-PCR克隆Desmin基因,分别构建原核表达载体pGEX-4T-1-Desmin-Flag和真核表达载体pcDNA3.0-Desmin-Flag,以IPTG对原核表达载体进行诱导表达,并通过ProtParam、ProtScale、TMHMM-2.0、SignalP-5.0、SOPMA和SWISS-MODEL等在线软件对Desmin蛋白进行生物信息学分析。【结果】鼠源Desmin基因长1410 bp,选用pGEX-4T-1载体和pcDNA3.0载体分别成功构建了原核表达载体pGEX-4T-1-Desmin-Flag和真核表达载体pcDNA3.0-Desmin-Flag。原核表达载体pGEX-4T-1-Desmin-Flag转化大肠杆菌后经IPTG诱导,成功表达出70 kD的融合蛋白Desmin-Flag;真核表达载体pcDNA3.0-Desmin-Flag转染BHK-21细胞,通过Western blotting在56 kD处检测到Flag标签,即Desmin蛋白能在真核细胞成功表达,且主要定位在细胞质。Desmin蛋白由470个氨基酸残基组成,分子量为54 kD,分子式为C2299H3722N688O755S13,理论等电点(pI)为5.21,属于不稳定蛋白;蛋白脂溶系数为79.94,平均亲水系数(GRAVY)为-0.721,推测为亲水性蛋白;无跨膜结构域和信号肽;其二级结构由α-螺旋(占67.59%)、无规则卷曲(占22.39%)、β-转角(占1.92%)和延伸链(占8.10%)构成。【结论】鼠源Desmin蛋白在原核表达体系中主要以包涵体形式进行表达,在真核细胞中表达主要定位于细胞质,呈骨架结构分布,其理化性质不稳定,属亲水性蛋白,无跨膜结构域和信号肽。Desmin作为一种重要的III型中间丝蛋白,在神经肌肉组织信号转导及与相关蛋白发生相互作用方面发挥重要作用。
关键词:鼠源;Desmin基因;原核表达;真核表达;生物信息学分析
中图分类号:S865.13 文献标志码:A 文章编号:2095-1191(2023)02-0609-09
Abstract:【Objective】To construct an eukaryotic/prokaryotic expression vector for murine type III intermediate filamentary Desmin protein, to clarify the biological functions of murine Desmin protein, and to provide a theoretical basis for identifying Desmin-interacting proteins and exploring their action networks in in vitro and intracellular expression systems. 【Method】The Desmin gene was cloned by RT-PCR, and the prokaryotic expression vector pGEX-4T-1-Desmin-Flag and the eukaryotic expression vector pcDNA3.0-Desmin-Flag were constructed respectively, and the expression of the prokaryotic expression vector was induced by IPTG. ProtParam, ProtScale, TMHMM-2.0, SignalP-5.0, SOPMA and SWISS-MODEL were used for bioinformatics analysis of Desmin protein. 【Result】The murine Desmin gene was 1410 bp long. pGEX-4T-1 vector and pcDNA3.0 vector were used to successfully construct the prokaryotic expression vector pGEX-4T-1-Desmin-Flag and the eukaryotic expression vector pcDNA3.0-Desmin-Flag respectively. Prokaryotic expression vector pGEX-4T-1-Desmin-Flag was transformed into Escherichia coli and successfully expressed a 70 kD fusion protein Desmin-Flag, after induction by IPTG. The eukaryotic expression vector pcDNA3.0-Desmin-Flag was transfected with BHK-21 cells and the Flag tag was detected at 56 kD by Western blotting, in other words,the Desmin protein was successfully expressed in eukaryotic cells and was mainly localized in the cytoplasm. Desmin protein consisted of 470 amino acids residues with a molecular weight of 54 kD, a molecular formula of C2299H3722N688O755S13 and a theoretical isoelectric point (pI) of 5.21, which was an unstable protein; its lipolysis coefficient was 79.94 and its mean hydrophilicity coefficient (GRAVY) was -0.721. It was presumed to be a hydrophilic protein; there was no transmembrane structural domain and signal peptide; its secondary structure consisted of α-helix (67.59%), random coil (22.39%), β-turn (1.92%) and extended chain (8.10%). 【Conclusion】In the prokaryotic expression system, murine Desmin protein is mainly expressed in the form of inclusion bodies, while in eukaryotic cells, it is mainly expressed in the cytoplasm, with skeletal structure distribution, unstable physical and chemical properties, and no transmembrane domain or signal peptide. It is a hydrophilic protein, Desmin, as an important type III intermediate filament protein, plays an important role in signal transduction and interaction with related proteins in neuromuscular tissue.
Key words: murine; Desmin gene; prokaryotic expression; eukaryotic expression; bioinformatics analysis
Foundation items:National Natural Science Foundation of China (31902311)
0 引言
【研究意义】动物细胞由细胞膜、细胞浆、细胞核、细胞骨架及细胞器组成,维持其正常功能很大程度上取决于细胞的机械性能,而细胞骨架的完整性决定着细胞机械性能(Charrier et al.,2018)。细胞骨架由微管(Microtubule)、微丝(Microfilament)和中间丝(Intermediate filament)构成。各类真核细胞都包含有微丝和微管,高级真核细胞还特有中间丝。中间丝于1968年首次在肌肉中被描述,此后在生化鉴定中发现III型中间丝蛋白Desmin(Gomes et al.,2022)。大多数疾病会引起细胞骨架发生变化,其中又以中间丝变化最显著。根据其分布位置及功能,可将中间丝蛋白分成5种类型:I型为细胞角蛋白(Cytokeratin,CK),分布在上皮细胞;II型为毛发角蛋白(Hair keratin),分散在毛发及其他附属器官;III型为Desmin蛋白,基本分布在肌肉中(Joanne et al.,2021);IV型为神经原纤维蛋白(Internexin nestin synemin syncoilin),分布在神经纤维和肌纤维等;V型为核层蛋白,广泛存在于各种细胞中。Desmin是一种肌肉特异性蛋白,在维持肌肉机械完整性和肌肉组织收缩性方面发挥重要作用(Paulin and Li,2004;Hakibilen et al.,2022),因此开展Desmin基因生物学特性研究对揭示神经肌肉组织信号转导作用机理具有重要意义。【前人研究进展】近年来的中间丝生物学研究结果表明,细胞骨架张力、细胞核形状所体现的机械化学信号是调节组织发育及其维护的基础。尤其是在肌肉中,机械力的正确传播和感知需要多个细胞质和细胞核成分的协调,而这种胞内通信的主要分子就是Desmin(Capetanaki et al.,2007,2015)。Desmin不仅将收缩的肌原纤维连接到质膜、细胞核和线粒体,还能与线粒体直接相互作用。Desmin突变或缺乏引起的神经网络紊乱致使肌原纤维组织损害,进而导致线粒体分布、形态及其功能发生变化(Dayal et al.,2020)。Desmin蛋白还能调节蛋白平衡及细胞大小,在骨骼肌中Desmin动力学的变化可促进分解代谢,即对环境变化的适应性反应(Agnetti et al.,2021);Desmin蛋白在营养不良肌肉的萎缩、生物性能和脆弱性中也发挥着重要作用(Ferry et al.,2020)。当Desmin纤维网络丢失,肌纤维中的Desmin形成异常聚集体,引起的相关疾病特征为非压实型心肌病、心脏传导缺陷和冠状动脉夹层(Tamiya et al.,2020),临床表现为异质性,如骨骼肌病、心肌病、平滑肌病及呼吸缺陷等(Goldfarb and Dalakas,2009)。还有研究表明,Desmin蛋白对于窦房结的结构及功能至关重要,对心律失常的影响十分显著(Mavroidis et al.,2020),缺乏Desmin蛋白会导致神经肌肉接头的结构和功能障碍(Eiber et al.,2020)。Winter等(2019)研究发现,当骨骼肌蛋白稳态失衡时,机体会产生热休克蛋白,而加速Desmin及其伴侣分子发生转移,进而导致细胞骨架和肌纤维发生障碍。Langer等(2021)研究证实,Desmin基因突变后,即使大鼠偏心负荷其骨骼肌也不受急性肌肉损伤的影响。此外,Desmin蛋白可作为细胞核内的转录调节剂(Kural-Mangit et al.,2021),即揭示Desmin的核功能可为研究其生物学意义提供新见解。【本研究切入点】目前,针对人类Desmin蛋白已有深入研究,但有关于鼠源Desmin的研究相对较少,因此亟待通过构建真核/原核表达载体及开展生物信息学分析进一步揭示鼠源Desmin蛋白的生物学特性。【拟解决的关键问题】通过构建鼠源Desmin基因真核/原核表达载体并进行表达,明确鼠源Desmin蛋白生物学功能,为在体外及细胞内表达系统中鉴定Desmin互作蛋白及探索其作用网络提供理论依据。
1 材料与方法
1. 1 试验材料
BHK-21细胞、pcDNA3.0载体、pGEX-4T-1载体、细胞爬片由亚热带农业生物资源保护与利用国家重点实验室保存提供;总RNA提取试剂盒、胶回收纯化试剂盒、氨苄青霉素购自北京索莱宝科技有限公司;大肠杆菌(DH5α和BL21感受态细胞)、EcoR I/Not I限制性内切酶、质粒小量提取试剂盒、pMD18-T载体及T4 DNA连接酶购自TaKaRa公司;3周龄昆明小白鼠购自广西医科大学实验动物中心。主要仪器设备:超声波破碎仪器(JY92-Ⅱ)和分散均质机(S10)购自宁波新芝生物科技股份有限公司;共聚焦扫描成像显微镜购自德国Leica公司;分光光度计(NanoDrop-1000)购自Limited基因有限公司。
1. 2 鼠源Desmin基因扩增与测序
使用总RNA提取试剂盒提取昆明小白鼠肌肉组织总RNA,反转录合成cDNA作为Desmin基因扩增模板,扩增引物序列信息见表1。PCR反应体系25.0 μL:Max PCR Master Mix(2×Premix)12.5 μL,上、下游引物各1.0 μL,cDNA模板1.0 μL,ddH2O补足至25.0 μL。扩增程序:98 ℃预变性5 min;98 ℃ 10 s,60 ℃ 10 s,72 ℃ 18 s,进行30个循环;72 ℃延伸10 min。PCR扩增产物经琼脂糖凝胶电泳检验后,加入poly(A)尾,反应程序为72 ℃ 30 min,纯化回收后连接至pMD18-T载体,转化DH5α感受态细胞,挑取单克隆进行菌液PCR鉴定,阳性克隆送至深圳华大基因科技有限公司測序。测序正确的阳性克隆质粒命名为pMD18-T-Desmin普通引物。
1. 3 Desmin基因原核表达
以pMD18-T普通引物质粒为模板,选用原核表达引物进行PCR扩增,扩增产物连pMD18-T载体后转化DH5α感受态细胞,挑取单克隆进行菌液PCR鉴定,测序正确后抽提质粒。质粒pMD18-T-Desmin原核引物和pGEX-4T-1载体分别用EcoR I和Not I进行双酶切,使用T4连接酶进行连接,并转化DH5α感受态细胞,构建原核表达载体pGEX-4T-1-Desmin-Flag,同时转化BL21感受态细胞,经菌液PCR鉴定后对阳性重组菌株进行扩大培养,在菌液中按合适比例加入0.5 mmol/L IPTG,选择不同温度(28和30 ℃)进行诱导表达,诱导表达后进行考马斯亮蓝染色鉴定和Western blotting检测。
1. 4 Desmin基因真核表达
以pMD18-T普通引物质粒为模板,选用真核表达引物进行PCR扩增,扩增产物连pMD18-T载体后转化DH5α感受态细胞,挑取单克隆进行菌液PCR鉴定,测序正确后抽提质粒。质粒pMD18-T-Desmin真核引物和pcDNA3.0载体分别用EcoR I和Not I进行双酶切,使用T4连接酶进行连接,并转化DH5α感受态细胞,构建真核表达载体pcDNA3.0-Desmin-Flag,测序正确后转染HEK-293T细胞,收集转染24 h的蛋白样品进行Western blotting验证,采用特异性的Flag标签确认表达情况。
1. 5 Desmin基因生物信息学分析
构建的原核表达载体和真核表达载体经深圳华大基因科技有限公司测序鉴定后,通过ProtParam分析Desmin蛋白理化性质,使用ProtScale预测Desmin蛋白亲/疏水性,采用TMHMM-2.0预测Desmin蛋白跨膜结构域,运用SignalP-5.0预测Desmin蛋白信号肽,并利用SOPMA和SWISS-MODEL分别预测Desmin蛋白二、三级结构。
2 结果与分析
2. 1 鼠源Desmin基因扩增与测序结果
以小鼠肌肉组织总RNA反转录合成的cDNA为模板,首先以普通引物扩增Desmin基因,经琼脂糖凝胶电泳检测,扩增出大小约1400 bp的特异性条带(图1-A),与预期结果一致。取5管克隆载体转化的菌液进行Desmin基因PCR鉴定,结果显示泳道1和泳道4的培养菌液能扩增出Desmin基因(图1-B),送华至深圳华大基因科技有限公司测序,测序合格后抽提质粒,并命名为pMD18-T-Desmin普通引物。
2. 2 Desmin基因原核表达结果
2. 2. 1 Desmin基因原核表达载体构建 以克隆质粒pMD18-T-Desmin普通引物为模板,PCR扩增结果显示得到1410 bp的目的条带(图2-A),与预期结果一致。取克隆质粒pMD18-T-Desmin原核引物转化的DH5α菌液进行Desmin基因PCR鉴定,阳性克隆质粒送至深圳华大基因科技有限公司测序,测序正确后抽提质粒,并命名为pMD18-T-Desmin-Flag。pMD18-T-Desmin-Flag和pGEX-4T-1载体用EcoR I和Not I进行双酶切,然后以T4连接酶连接,并转化DH5α感受态细胞,取3管原核表达载体pGEX-4T-1-Desmin-Flag转化菌液进行Desmin基因PCR检测,结果显示泳道2和泳道3的菌液能扩增出Desmin基因条带(图2-B),测序合格后抽提质粒,再以EcoR I和Not I进行双酶切鉴定,结果获得2条目的条带,分别是4969 bp的pGEX-4T-1载体和1410 bp的Desmin基因(图2-C),因此可确定原核表达载体pGEX-4T-1-Desmin-Flag构建成功。
2. 2. 2 Desmin蛋白原核表达及鉴定结果 以原核表达载体pGEX-4T-1-Desmin-Flag转化BL21感受态细胞,加入0.5 mmol/L IPTG,分别在28和30 ℃下诱导表达6 h,然后采用考马斯亮蓝对融合蛋白Desmin进行鉴定。结果(图3)显示,在28和30 ℃诱导下均有可溶性的融合蛋白Desmin表达,但主要以包涵体的形式表达,蛋白大小与预期结果相符,在70 kD处出现目的条带。
2. 2. 3 融合蛋白Desmin表达检测结果 由于pGEX-4T-1载体本身携带有GST标签,而构建的原核表达载体设计有Flag标签,因此在诱导表达后取相应的融合蛋白样品以GST标签(图4-A)和Flag标签(图4-B)进行Western blotting检测,进一步验证诱导表达情况。结果表明,在28和30 ℃下以0.5 mmol/L IPTG诱导表达时,均有可溶性Desmin蛋白表达。
2. 3 Desmin基因真核表达结果
2. 3. 1 Desmin基因真核表達载体构建 以克隆质粒pMD18-T-Desmin普通引物为模板,PCR扩增结果显示得到1410 bp的目的条带(图5-A),与预期结果相符。取克隆载体pMD18-T-Desmin真核引物转化的DH5α菌液进行Desmin基因PCR检测,阳性克隆质粒送至深圳华大基因科技有限公司测序,测序正确后抽提质粒,并命名为pMD18-T-Desmin-Flag。pMD18-T-Desmin-Flag和pcDNA3.0载体用EcoR I和Not I进行双酶切,然后以T4连接酶连接,并转化DH5α感受态细胞,取4管真核表达载体pcDNA 3.0-Desmin-Flag转化的菌液进行Desmin基因PCR检测,结果显示泳道1~泳道4的菌液均能扩增出Desmin基因条带(图5-B),测序合格后抽提质粒,再以EcoR I和Not I进行双酶切鉴定,结果获得2条目的条带,分别是5427 bp的pcDNA 3.0载体和1410 bp的Desmin基因(图5-C),因此可确定真核表达载体pcDNA3.0-Desmin-Flag构建成功。
2. 3. 2 真核表达载体Western blotting检测结果 培养BHK-21细胞,待其状态良好时转移至6孔板中,以空载体pcDNA3.0和真核表达载体pcDNA3.0-Desmin-Flag分别转染BHK-21细胞,于转染24 h后收集蛋白样品,采用Flag标签进行Western blotting检测,结果表明,转染真核表达载体pcDNA3.0-Desmin-Flag的孔细胞在56 kD处能检测到Flag标签,而转染空载体pcDNA3.0的细胞孔检测不到Flag标签(图6),表明真核表达载体pcDNA3.0-Desmin-Flag能成功表达。
2. 3. 3 pcDNA 3.0-Desmin-Flag在BHK-21细胞中的共聚焦定位 培养BHK-21细胞,待其状态良好时转移至6孔板中,同时在6孔板中铺上细胞爬片,以真核表达载体pcDNA3.0-Desmin-Flag转染BHK-21细胞。转染24 h后以鼠源Flag抗体为一抗进行间接免疫荧光试验(IFA),抗小鼠绿色荧光为二抗,同时用DAPI对细胞核进行染色(蓝色),结果证实Desmin蛋白主要定位在细胞质(图7)。
2. 4 Desmin基因生物信息学分析结果
2. 4. 1 Desmin蛋白理化性质分析结果 在不考虑蛋白翻译后修饰、蛋白多聚体的情况下,利用ProtParam对Desmin蛋白进行理化性质分析,结果表明该蛋白由470个氨基酸残基组成(表2),分子量为54 kD,分子式为C2299H3722N688O755S13,理论等电点(pI)为5.21。Desmin蛋白不稳定系数为52.24,属于不稳定蛋白;蛋白脂溶系数为79.94,平均亲水系数(GRAVY)为-0.721,故推测该蛋白为亲水性蛋白。
2. 4. 2 Desmin蛋白亲/疏水性、信号肽及跨膜结构预测结果 通过ProtScale对Desmin蛋白亲/疏水性进行预测,结果(图8)显示,分数<0的区域较密集,分数>0的区域较分散,综合蛋白理化性质中的GRAVY为-0.721,初步判断该蛋白为亲水性蛋白。TMHMM 2.0预测结果(图9)表明,Desmin蛋白不存在跨膜螺旋结构,即该蛋白是以非跨膜蛋白的形式表达。利用SignalP-5.0对Desmin蛋白进行信号肽预测,结果(图10)表明该蛋白无信号肽位点,即Desmin蛋白不属于分泌蛋白,而是经游离核糖体合成后进入细胞质。
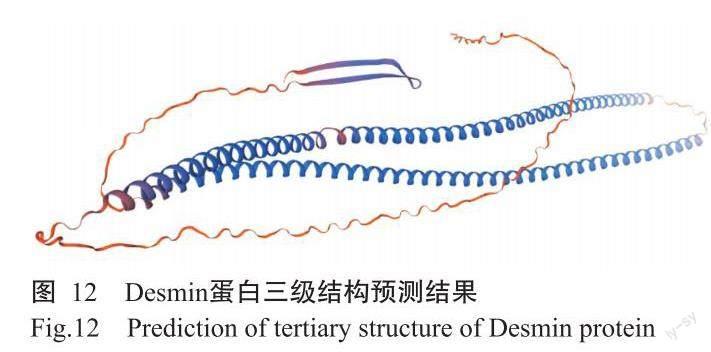
2. 4. 3 Desmin蛋白二、三级结构预测结果 SOPMA预测结果(图11)显示,Desmin蛋白二级结构由α-螺旋(占67.59%)、无规则卷曲(占22.39%)、β-转角(占1.92%)和延伸链(占8.10%)构成。利用SWISS-MODEL构建Desmin蛋白可能的三级结构模型,结果表明,Desmin蛋白三级结构GMQE值为0.77,与模板序列匹配度高(图12),Seq Identity为96.38%,即预测结果可靠。
3 讨论
鼠源Desmin是由470个氨基酸组成的一种不稳定肌肉组织中间丝蛋白,其N端主要调控蛋白结合,C端提供二聚化结合位点,且包含1个α-螺旋的杆状体区,此杆状体区又分成1A、1B、2A和2B等4个主要结构域,存在于细胞核周边,通过网格蛋白作用使Desmin蛋白连接于肌原纤维的Z线上,促使相近的肌原纤维相互连接,而发挥动力传输效应,在维持肌肉组织收缩器官的结构及机械完整性方面发挥关键作用(Paulin and Li,2004)。Desmin是翻译后修饰的目标,如磷酸化及非酶修饰。其中,磷酸化和二磷酸腺苷—核糖基化的主要作用是分解中间丝,涉及多个重要的生物过程,包括肌细胞的产生与融合、肌肉收缩、肌肉萎缩及肌细胞分裂(Winter et al.,2014)。已有研究表明,通过野生AB型斑马鱼肌肉组织Desmin蛋白和层黏连蛋白B间免疫共沉淀,证实Desmin蛋白与层黏连蛋白B间的相互作用可能是新型核细胞质通信网络的线索(Kural-Mangit and Din?er,2021)。Desmin蛋白作为基于酵母双杂交筛选的基质相互作用分子1(STIM1)结合伙伴,通过免疫共沉淀和免疫定位证实,STIM1的CC1-SOAR结构域与Desmin蛋白相互作用能增强STIM1寡聚。Zhang等(2021)通过对Desmin缺失小鼠的研究,发现Desmin蛋白在神经肌肉Z线上连接STIM1以调节肌质网的Ca2+填充效率,即Desmin-STIM1组装形成了细胞骨架—肌质网连接,对骨骼肌中的Ca2+信號传导起重要作用。Desmin作为神经肌肉接头处的重要蛋白,还能将肌原纤维的被动成分连接到肌肉细胞侧表面(Tidball,1992)。
目前,原核表达载体构建使用较多的是pGEX-4T-1和pET-32a(+),操作简单且可高效表达,pGEX-4T-1载体本身携带有GST标签,可通过检测特异性标签以确定融合蛋白的诱导表达情况(赵祥秀等,2020)。融合蛋白在表达过程中可能会出现表达量较少或不表达的情况,最适诱导条件难以把握,诱导表达的蛋白量达不到免疫量要求(李玉霄等,2020)。本研究的鼠源Desmin基因原核诱导表达选用pGEX-4T-1载体,构建的原核表达载体pGEX-4T-1-Desmin-Flag在28和30 ℃下以0.5 mmol/L IPTG诱导6 h后,通过特异性的GST标签可成功检测到在菌体沉淀和上清液中均有Desmin蛋白表达,但在28 ℃诱导条件下产生的可溶性蛋白较30 ℃诱导的多,说明在低温诱导条件下可产生更多的可溶性Desmin蛋白,因此后期采用28 ℃进行诱导表达。切胶纯化法是经KCl染色后针对目的蛋白条带位置处切胶纯化,原核表达纯化的融合蛋白再进行SDS-PAGE分析和Western blotting检测(黄茂发等,2021),纯化后的融合蛋白可作为钓饵通过体外Pull-down鉴定与Desmin直接结合的互作蛋白。此外,本研究构建了真核表达载体pcDNA3.0-Desmin-Flag并成功表达,共聚焦定位结果显示Desmin蛋白主要定位在细胞质,同时有部分定位在细胞核周围。真核表达载体的构建进一步验证Desmin蛋白的互作网络及细胞内分布定位情况,为了解物理互作的蛋白是否具有功能性关联提供了理论依据。
鼠源Desmin蛋白为亲水性蛋白,其理化性质不稳定,无跨膜结构和信号肽,其二级结构中α-螺旋(由317个氨基酸残基组成)占67.59%、无规则卷曲(由105个氨基酸残基组成)占22.39%、β-转角(由9个氨基酸残基组成)占1.92%、延伸链(由38个氨基酸残基组成)占8.10%,α-螺旋是最主要的二级结构。Desmin作为一种重要的III型中间丝蛋白,在神经肌肉组织信号转导及与相关蛋白发生相互作用方面发挥重要作用,為后续研究其生物学特性打下了基础。
4 结论
鼠源Desmin蛋白在原核表达体系中主要以包涵体形式进行表达,在真核细胞中表达主要定位于细胞质,呈骨架结构分布,其理化性质不稳定,属亲水性蛋白,无跨膜结构域和信号肽。Desmin作为一种重要的III型中间丝蛋白,在神经肌肉组织信号转导及与相关蛋白发生相互作用方面发挥重要作用。
参考文献:
黄茂发,梁晶晶,赵祥秀,唐榕泽,高跃美,张文,李晓宁,罗廷荣. 2021. 猪TNF-α高效表达及其多克隆抗体的制备[J]. 南方农业学报,52(9):2572-2581. [Huang M F,Liang J J,Zhao X X,Tang R Z,Gao Y M,Zhang W,Li X N,Luo T R. 2021. Porcine TNF-α high level expression and preparation of its polyclonal antibody[J]. Journal of Southern Agriculture,52(9):2572-2581.] doi:10.3969/j.issn.2095-1191.2021.09.028.
李玉霄,唐榕泽,高跃美,冯佳佳,梁晶晶,李晓宁,罗廷荣. 2020. ISG15蛋白泛素结合酶UBCH6的原核表达及多克隆抗体制备[J]. 动物医学进展,41(12):28-33. [Li Y X,Tang R Z,Gao Y M,Feng J J,Liang J J,Li X N,Luo T R. 2020. Prokaryotic expression of ISG15 protein ubiquitin-binding enzyme UBCH6 and preparation of polyclonal antibodies[J]. Progress in Veterinary Medicine,41(12):28-33.] doi:10.16437/j.cnki.1007-5038.2020.12.006.
赵祥秀,黄茂发,高跃美,唐榕泽,胡任俊,梁晶晶,李晓宁,罗廷荣. 2020. 猪源IKKγ在原核和真核表达系统中的表达及其多克隆抗体制备[J]. 南方农业学报,51(12):3099-3108. [Zhao X X,Huang M F,Gao Y M,Tang R Z,Hu R J,Liang J J,Li X N,Luo T R. 2020. Expression of porcine IKKγ in prokaryotic and eukaryotic expression systems and preparation of polyclonal antibodies[J]. Journal of Southern Agriculture,51(12):3099-3108.] doi:10.3969/j.issn.2095-1191.2020.12.028.
Agnetti G,Herrmann H,Cohen S. 2022. New roles for desmin in the maintenance of muscle homeostasis[J]. The FEBS Journal,289(10):2755-2770. doi:10.1111/febs. 15864.
Capetanaki Y,Bloch R J,Kouloumenta A,Mavroidis M,Psarras S. 2007. Muscle intermediate filaments and their links to membranes and membranous organelles[J]. Experimental Cell Research,313(10):2063-2076. doi:10. 1016/j.yexcr.2007.03.033.
Capetanaki Y,Papathanasiou S,Diokmetzidou A,Vatsellas G,Tsikitis M. 2015. Desmin related disease:A matter of cell survival failure[J]. Current Opinion in Cell Biology,32:113-120. doi:10.1016/j.ceb.2015.01.004.
Charrier E E,Montel L,Asnacios A,Delort F,Vicart P,Gallet F,Batonnet-Pichon S,Hénon S. 2018. The desmin network is a determinant of the cytoplasmic stiffness of myoblasts[J]. Biology of the Cell,110(4):77-90. doi:10. 1111/boc.201700040.
Dayal A A,Medvedeva N V,Nekrasova T M,Duhalin S D,Surin A K,Minin A A. 2020. Desmin interacts directly with mitochondria[J]. International Journal of Molecular Sciences,21(21):8122. doi:10.3390/ijms21218122.
Eiber N,Fr?b F,Schowalter M,Thiel C,Clemen C S,Schr?der R,Hashemolhosseini S. 2020. Lack of desmin in mice causes structural and functional disorders of neuromuscular junctions[J]. Frontiers in Molecular Neuroscien-ce,13:567084. doi:10.3389/fnmol.2020.567084.
Ferry A,Messéant J,Parlakian A,Lemaitre M,Roy P,Delacroix C,Lilienbaum A,Hovhannisyan Y,Furling D,Klein A,Li Z L,Agbulut O. 2020. Desmin prevents muscle wasting,exaggerated weakness and fragility,and fatigue in dystrophic mdx mouse[J]. The Journal of Physiology,598(17):3667-3689. doi:10.1113/JP279282.
Goldfarb L G,Dalakas M C. 2009. Tragedy in a heartbeat:Malfunctioning desmin causes skeletal and cardiac muscle disease[J]. The Journal of Clinical Investigation,119(7):1806-1813. doi:10.1172/JCI38027.
Gomes G,Seixas M R,Azevedo S,Audi K,Jurberg A D,Mermelstein C,Costa M L. 2022. What does desmin do:A bibliometric assessment of the functions of the muscle intermediate filament[J]. Experimental Biology and Medicine,247(7):538-550. doi:10.1177/15353702221075035.
Hakibilen C,Delort F,Daher M T,Joanne P,Cabet E,Cardoso O,Bourgois-Rocha F,Tian C X,Rivas E,Madruga M,Ferreiro A,Lilienbaum A,Vicart P,Agbulut O,Hénon S,Batonnet-Pichon S. 2022. Desmin modulates muscle cell adhesion and migration[J]. Frontiers in Cell and Deve-lopmental Biology,10:783724. doi:10.3389/fcell.2022. 783724.
Joanne P,Hovhannisyan Y,Bencze M,Daher M T,Parlakian A,Toutirais G,Gao-Li J,Lilienbaum A,Li Z L,Kordeli E,Ferry A,Agbulut O. 2021. Absence of desmin results in impaired adaptive response to mechanical overloading of skeletal muscle[J]. Frontiers in Cell and Developmental Biology,9:662133. doi:10.3389/fcell.2021.662133.
Kural-Mangit E,Düz N,Din?er P R. 2021. A cytoplasmic escapee:Desmin is going nuclear[J]. Turkish Journal of Biology,45(6):711-719. doi:10.3906/biy-2107-54.
Kural-Mang?t E,Din?er P R. 2021. Physical evidence on desmin-lamin B interaction[J]. Cytoskeleton,78(1):14-17. doi:10. 1002/cm.21651.
Langer H T,Mossakowski A A,Avey A M,Wohlgemuth R P,Smith L R,Zbinden-Foncea H,Baar K. 2021. A mutation in desmin makes skeletal muscle less vulnerable to acute mus-cle damage after eccentric loading in rats[J]. The FASEB Journal,35(9):e21860. doi:10.1096/fj.202100711RR.
Mavroidis M,Athanasiadis N C,Rigas P,Kostavasili I,Kloukina I,Te Rijdt W P,Kavantzas N,Chaniotis D,van Tintelen J P,Skaliora I,Davos C H. 2020. Desmin is essential for the structure and function of the sinoatrial node:Implications for increased arrhythmogenesis[J].American Journal of Physiology. Heart and Circulatory Physiology,319(3):H557-H570. doi:10.1152/ajpheart.00594.2019.
Paulin D,Li Z L. 2004. Desmin:A major intermediate filament protein essential for the structural integrity and function of muscle[J]. Experimental Cell Research,301(1):1-7. doi:10.1016/j.yexcr.2004.08.004.
Tamiya R,Saito Y,Fukamachi D,Nagashima K,Aizawa Y,Ohkubo K,Hatta T,Sezai A,Tanaka M,Ishikawa T,Makita N,Sumitomo N,Okumura Y. 2020. Desmin-rela-ted myopathy characterized by non-compaction cardiomyo-pathy,cardiac conduction defect,and coronary artery dissection[J]. ESC Heart Failure,7(3):1338-1343. doi:10. 1002/ehf2.12667.
Tidball J G. 1992. Desmin at myotendinous junctions[J]. Experimental Cell Research,199(2):206-212. doi:10.1016/0014-4827(92)90425-8.
Winter D L,Paulin D,Mericskay M,Li Z L. 2014. Posttranslational modifications of desmin and their implication in biological processes and pathologies[J]. Histochemistry and Cell Biology,141(1):1-16. doi:10.1007/s00418-013-1148-z.
Winter L,Unger A,Berwanger C,Sp?rrer M,Türk M,Chevessier F,Strucksberg K H,Schl?tzer-Schrehardt U,Wittig I,Goldmann W H,Marcus K,Linke W A,Clemen C S,Schr?der R. 2019. Imbalances in protein homeostasis caused by mutant desmin[J]. Neuropathology and Applied Neurobiology,45(5):476-494. doi:10.1111/nan. 12516.
Zhang H T,Bryson V G,Wang C J,Li T Y,Kerr J P,Wilson R,Muoio D M,Bloch R J,Ward C,Rosenberg P B. 2021. Desmin interacts with STIM1 and coordinates Ca2+ signa-ling in skeletal muscle[J]. JCI Insight,6(17):e143472. doi:10.1172/jci.insight.143472.
(責任编辑 兰宗宝)

