笋壳鱼源柱状黄杆菌的分离鉴定及致病性和药物敏感性
刘丽娟 王红莉 王亚军 任燕 王庆 石存斌 张德锋


摘要:【目的】明确2022年5月广东省珠海市某养殖场笋壳鱼烂鳃病的病原,为防控笋壳鱼相关病害提供参考依据。【方法】从患病笋壳鱼的腐烂鳃丝、肾脏和体表病灶等部位分离细菌,并纯化优势菌落,通过PCR方法扩增分離菌株的16S rRNA序列并进行测序分析,同时构建该基因的系统发育进化树,鉴定患病笋壳鱼的病原菌。选取代表菌株Om2202进行毒力基因检测和斑马鱼人工感染试验。测定中草药和消毒剂对分离菌株Om2202的抑菌和杀菌活性,分析菌株Om2202的致病性和药物敏感性。【结果】从患病鱼鳃部和肾脏分离到的优势菌落呈细长的弯曲或直杆状,菌体表面未见鞭毛和菌毛,有荚膜,有胞外分泌物;通过特异性PCR检测和16S rRNA序列的系统发育进化树分析,结合菌落形态分析结果,确定分离菌株Om2202为柱状黄杆菌(Flavobacterium columnare)。毒力基因检测结果显示,菌株Om2202携带gldD、hly、cslA、ompA和chiA等11种毒力相关基因。斑马鱼致病性试验结果显示,菌株Om2202对斑马鱼具有较强致病性,其LC50为7.50×106 CFU/mL。药物敏感性试验结果显示,Om2202菌株对芦荟大黄素、大黄素和苯扎溴铵等药物敏感,对连翘精油、二氧化氯、蛋氨酸碘和过氧化钙等药物不敏感。【结论】引起笋壳鱼烂鳃的主要致病菌为柱状黄杆菌,属于广泛流行的基因Ⅱ型菌株,且携带大量的毒力相关基因,对斑马鱼具有较强的致病性,可用芦荟大黄素、大黄素和苯扎溴铵等药物进行防控。
关键词:笋壳鱼;柱状黄杆菌;分离鉴定;致病性;药物敏感性
中图分类号:S943 文献标志码: A 文章编号:2095-1191(2023)02-0638-09
Abstract:【Objective】In order to clarify the pathogen of gill rot of Oxyeleotris marmoratus in a farm in Zhuhai City, Guangdong Province in May 2022, and to provide reference for prevention and control of the related diseases of O. marmoratus. 【Method】Bacteria were isolated from the rotten gill, kidneys and surface ulceration of the diseased fish, and the dominant pathogen was purified, and the 16S rRNA gene of the isolate was amplified by PCR, and then was sequenced and analyzed.Furthermore, phylogenetic tree of the 16S rRNA gene was constructed to identify pathogenic bacteria. A representative strain Om2202 was selected for detection of virulence genes and artificial infection test of Danio rerio. In addition, the antibacterial and bactericidal activities of Chinese herbal medicines and disinfectants against the isolate Om2202 were determined, and the pathogenicity and drug susceptibility of strain Om2202 were analyzed. 【Result】The dominant strains isolated from the gill and kidney of the diseased fish were slender curved or straight rod-like, without flagella and fimbriae, with capsules and extracellular secretions. The isolate Om2202 was identified as Flavobacterium columnare based on specific PCR, phylogenetic tree analysis of 16S rRNA gene, and colony morphology analysis. The results of detection of virulence genes showed that the strain Om2202 carried 11 virulence-related genes including gldD,hly, cslA, ompA and chiA. The results of pathogenicity test showed that Om2202 strain had strong pathogenicity to D. rerio, and its LC50 was 7.50×106 CFU/mL. The results of drug susceptibility test showed that strain Om2202 was sensitive to aloe-emodin, emodin and benzalkonium bromide, but not sensitive to Forsythia suspensa essential oil, chlorine dioxide, methionine iodine and calcium peroxide. 【Conclusion】F. columnare is the main pathogenic bacteria causing the gill rot of O. marmoratus, which belongs to the widespread genotype II and carries a large number of virulence-related genes. It has a strong pathogenicity to D. rerio and can be controlled with aloe-emodin, emodin and benzalonium bromide.
Key words:Oxyeleotris marmoratus; Flavobacterium columnare; isolation and identification; pathogenicity; drug susceptibility
Foundation item:China Agriculture Research System-Bulk Freshwater Fish Industry(CARS-45);Guangdong Provincial Special Fund For Modern Agriculture Industry Technology Innovation Team(2019KJ150);Guangzhou Science and Technology Plan Project (201904020004)
0 引言
【研究意義】笋壳鱼是尖塘鳢属(Oxyeleotris)鱼类的俗称,包括云斑尖塘鳢(O. marmoratus)、线纹尖塘鳢(O. lineolatus)和尾斑尖塘鳢(O. urophthalmus)等,主要分布在东南亚国家及澳洲大陆地区(唐邵林等,2018;邓海燕等,2021)。目前我国人工养殖的主要是云斑尖塘鳢(俗称泰国笋壳鱼)和线纹尖塘鳢(俗称澳洲笋壳鱼),以及由云斑尖塘鳢和线纹尖塘鳢杂交而成的杂交笋壳鱼。笋壳鱼因肉质细嫩、无肌间刺、味道鲜美,已成为一种具有重要经济价值且深受广大养殖户和消费者青睐的鱼类,市场售价通常在100~300元/kg(邓海燕等,2021)。笋壳鱼在我国广东和海南地区已实现规模化养殖,且养殖面积逐步扩大,年产量已达10多万t(樊佳佳等,2022)。柱状黄杆菌(Flavobacterium columnare)是水产养殖中淡水鱼类常见的病原菌,也是鱼类细菌性烂鳃病的主要致病菌,感染的宿主范围较广(Farmer,2004;Klesius et al.,2008;Dikesavalu et al.,2015;Patra et al.,2016;Ravindra et al.,2019)。随着我国笋壳鱼养殖业的迅速发展,养殖规模和集约化程度不断提高,包括烂鳃病在内的病害也日渐增多,危害程度不断加剧,制约了笋壳鱼养殖产业的健康发展。因此,分离和鉴定笋壳鱼腐烂鳃病原,分析其致病性,并进行优势菌株Om2202毒力基因检测和斑马鱼(Danio rerio)人工感染试验,对笋壳鱼养殖业的可持续发展具有重要意义。【前人研究进展】2009年8—10月,广东省多个水产养殖场曾爆发云斑尖塘鳢虹彩病毒病,死亡率高达85%(Wang et al.,2011)。国内已报道养殖笋壳鱼的病原主要有传染性脾肾坏死病毒(Infectious spleen and kidney necrosis virus,ISKNV)(陈智光等,2018)、嗜水气单胞菌(Aeromonas hydrophi-la)、温和气单胞菌(A. sobria)、维氏气单胞菌(A. veronii)(宋长江,2019;邓海燕等,2021)、虹彩病毒(Turbot reddish body irido virus,TRBIV)和锚头鳋等(王学耕等,2023)。我国水产养殖工作者为建立一系列笋壳鱼病害防治技术做了大量工作,其中疫苗接种是预防病毒病最有效的手段(麦耀宝等,2018;唐绍林等,2018;陈灼均,2020)。周阳等(2019)从转录组水平分析传染性脾肾坏死病毒和弹状病毒(Siniperca chuatsi rhabdovirus,SCRV)二联灭活疫苗诱导的云斑尖塘鳢脾脏差异表达基因,为阐明云斑尖塘鳢免疫应答机制提供了依据,也证实鱼类疫苗接种可产生免疫保护作用。Guo等(2020)构建的可诱导鱼类适应性免疫二价灭活疫苗,能降低笋壳鱼感染虹彩病毒和弹状病毒的感染概率。与国内一样,随着笋壳鱼集约化养殖的快速发展,国外笋壳鱼寄生虫病(Székely et al.,2009)、病毒病(Prasankok et al.,2005)和细菌病(Lam et al.,2008)等疾病的爆发也日益频繁。柱状黄杆菌为革兰氏阴性菌,是柱状黄杆菌病(细菌性烂鳃病)的病原(Bader and Starliper,2002;Declercq et al.,2013),具有多种毒力因子(Declercq et al.,2013;李烨等,2015;Bhattacharya et al.,2020)及多个基因型(Ⅰ~Ⅳ型)(Lafrentz et al.,2018;Sebastiao et al.,2021),是一种危害极广的细菌性疾病病原,可感染多种鱼类,并导致柱状黄杆菌病(Zhou et al.,2015; Ravindra et al.,2019;Chen et al.,2020),造成严重的经济损失。【本研究切入点】目前,针对笋壳鱼烂鳃病病原菌分离、鉴定及感染柱状黄杆菌的研究鲜见报道。【拟解决的关键问题】对广东省珠海市某养殖场患烂鳃病的笋壳鱼进行疾病诊断,通过细菌分离鉴定及致病性分析,明确其主要病原菌,并选取代表菌株Om2202进行毒力基因检测和斑马鱼人工感染试验,同时测定分析菌株Om2202的抑菌和杀菌活性,旨在为笋壳鱼烂鳃病的诊断和利用绿色药物防控提供科学依据。
1 材料与方法
1. 1 试验材料
患病笋壳鱼于2022年5月7日采自广东省珠海市某笋壳鱼养殖场,人工感染试验所用健康斑马鱼由中国水产科学研究院珠江水产研究所水生实验动物研究中心提供。蛋白胨和酵母粉购自美国赛默飞世尔科技公司(Thermo Fisher Scientific);牛肉膏购自北京索莱宝科技有限公司;醋酸钠、氯化钡、磷酸氢二钾、磷酸二氢钾、硫酸镁、氯化钙、硫酸铁和碳酸氢钠购自上海麦克林生化科技有限公司;琼脂粉购自北京奥博星生物技术有限责任公司。消毒剂二氧化氯购自新乡市华畜商贸有限公司;苯扎溴铵溶液、戊二醛苯扎溴铵购自江苏渔医生水产科技有限公司;滥申停购自南京渔丰生物科技有限公司;蛋氨酸碘购自广州先得生物技术有限公司;过氧化钙购自广东省湛江市永昂生物科技有限公司。连翘精油购自四川省维克奇生物科技有限公司;大黄素和黄连素购自北京华越洋生物科技有限公司;芦荟大黄素购自大连美仑生物技术有限公司。
1. 2 试验方法
1. 2. 1 药物、培养基及菌液制备 中草药溶液制备:连翘精油以无水乙醇稀释至1024.0 μg/mL,0.22 μm滤膜过滤除菌后备用;黄连素、大黄素和芦荟大黄素以DMSO溶解至51.2 mg/mL,以无菌水稀释50倍至1024.0 μg/mL备用。消毒剂溶液制备:将6种消毒剂分别用无菌水稀释至8192.0 mg/L,通过0.22 μm滤膜分别过滤除菌。培养基制备:①参考黄锦炉等(2010)的方法制备Shieh液体培养基,称取蛋白胨5.0 g、酵母提取物0.5 g、硫酸镁0.3 g、牛肉膏0.2 g、磷酸氢二钾0.1 g、氯化钡0.01 g、醋酸钠0.01 g、碳酸氢钠0.05 g、磷酸二氢钾0.05 g、氯化钙0.0067 g和硫酸铁0.001 g加入1000 mL蒸馏水中,调节pH至7.2,121 ℃下灭菌25 min;②在Shieh营养肉汤培养基原配方基础上配置Shieh固体纯化培养基,加入1.5%琼脂粉,调节pH至7.2,121 ℃下灭菌25 min。分离菌培养及菌悬液制备:将纯化后的分离菌接种于Shieh固体培养基进行活化,28 ℃培养箱静置培养24 h后,接种于Shieh液体培养基,28 ℃摇床振荡培养24 h,取新鲜菌液离心获得菌体,使用无菌PBS重悬,调整菌液浓度。
1. 2. 2 样品采集和细菌分离培养 选取具有典型烂鳃或体表溃烂症状的笋壳鱼,在无菌操作条件下取其鳃丝、体表病灶和肾脏组织划线接种于Shieh平板,28 ℃培养48 h,并挑取平板上优势形态的单菌落继续分离划线3次直至获得纯化的单克隆,收集菌体并以培养基重悬后加入终体积为15%的甘油,保藏于-80 ℃冰箱备用。
1. 2. 3 分离菌株鉴定 形态学方法:将分离菌株接种于Shieh平板上28 ℃培养48 h,然后挑取单克隆菌落接种至Shieh液体培养基,置于28 ℃摇床培养箱中振荡培养12 h(200 r/min);将菌液按1∶4(v/v)比例与无菌生理盐水混合均匀,浸泡30 min,若膜外分泌物较多,则将浸泡时间酌情延长;制备电镜负染标本:吸取约20.0 μL菌液滴于锡箔纸上,用尖头镊子夹取铜网边缘,将支持膜面覆扣于菌液滴上停留2 min,用滤纸从铜网的边沿吸去剩余菌液,滴加约20.0 μL的0.5%磷钨酸染液于锡箔纸上,将铜网带菌样品面(即碳膜面)朝下覆扣于染液上,各染色30~45 s,以滤纸从铜网边沿吸去剩余染液,自然晾干后进行透射电镜观察,并采集图片。
分子生物学方法:将纯化的分离菌株接种至Shieh液体培养基扩大培养,收集菌体,采用细菌基因组DNA提取试剂盒提取分离菌株的基因组DNA,以基因组DNA为模板,通过PCR扩增其16S rRNA序列。分离菌株的16S rRNA序列PCR扩增引物为27F:5'-AGAGTTTGATCCTGGCTCAG-3'和1492R:5'-GGTTACCTTGTTACGACTT-3'(戚建华等,2020),PCR产物预期大小约1500 bp。对阳性PCR扩增产物进行测序分析,并根据16S rRNA序列构建系统发育进化树。通过柱状黄杆菌特异性PCR引物(F:5'-CG GCTGGATCACCTCCTTTCTAG-3'和R:5'-TAAAGTG TTCTTTCTACTTGTTTG-3')(Welker et al.,2005),对所有分离菌株进行特异PCR扩增。根据柱状黄杆菌特异性PCR检测和16S rRNA序列分析结果,对分离菌株进行种属鉴定。
1. 2. 4 主要毒力基因检测 通过PCR扩增检测病原菌的主要毒力基因,包括gldD、gldG、gldJ、gldK、gldN、sprF、hly、cslA、ompA、chiA和col,其引物序列和扩增条件见表1。将与预期片段大小一致的PCR扩增产物片段进行测序验证。
1. 2. 5 致病性试验 参考Guz等(2014)的方法,选用成年斑马鱼(平均体质量0.21±0.02 g)作为感染动物模型用于人工感染试验。分离菌株活化后接种于Shieh液体培养基,28 ℃振荡培养24 h,离心去除培养基后以无菌生理盐水制成菌悬液,调整浓度为1.20×108 CFU/mL,并依次稀释2、4、8、16、32、64和128倍等7个浓度梯度,分别设为试验1~7组,其对应浓度依次为6.00×107、3.00×107、1.50×107、7.50×106、3.75×106、1.88×106和9.38×105 CFU/mL。以无菌生理盐水为对照组,每组20尾斑马鱼,采用腹腔注射感染方式。试验组每尾各注射10.0 μL菌液,对照组注射等体积无菌PBS。试验期间持续增氧,水温为(30±1)℃,连续观察7 d,每天记录各组斑马鱼的死亡情况,根据寇氏法(李翠萍等,2012)判定其半数致死浓度(LC50),观察病症并剖检死亡个体,再次对人工感染后具有典型症状的病鱼进行病原菌分离和鉴定。
1. 2. 6 药物敏感性测定 参考陶莎等(2022)的方法测定中草药和消毒剂对分离菌株的最小抑菌浓度(MIC),以确定抑菌效果。先将新鲜培养的菌株调整菌液浓度为2×106 CFU/mL备用,在96孔板中每孔加入50.0 ?L Shieh液体培养基后,再在首列孔中分别加入中草药和消毒剂,以二倍稀释法进行系列梯度稀释,最后加入50.0 ?L菌液,此時每孔中的菌液浓度均为5.00×105 CFU/mL。阳性对照组仅加菌液不加药物,阴性对照组仅加药物不加菌液。28 ℃静置培养36 h后,观察药敏结果,重复3次。分离菌株的培养液不易通过肉眼观察判断是否明显变浑浊,因此以酶标仪测定其OD600是否有显著变化,用于确定每种药物对应的MIC。
分别测定中草药和消毒剂对分离菌株的最小杀菌浓度(MBC),以确定各药物的杀菌效果。根据上述MIC试验结果,选取MIC对应小孔前的5个孔,分别吸取孔中的培养液100.0 ?L,均匀涂布于Shieh固体养基上,置于28 ℃恒温培养箱培养36 h,观察是否有菌落生长。在Shieh固体平板上无菌落生长则对应的药物浓度即为该药对分离菌株的MBC。
2 结果与分析
2. 1 笋壳鱼烂鳃病的细菌分离
患烂鳃病笋壳鱼的体表有轻微腐烂,尤其是鳍条,病变严重的部位是鳃部,肉眼可见鳃丝末端腐烂并有少量淤泥附着(图1)。使用Shieh培养基从笋壳鱼烂鳃的病灶处可分离到大量浅黄色菌落,菌落扁平、类根状、边缘不规则和黏附性强(图2)。从患病严重的笋壳鱼肾脏组织中可分离到上述相似的菌落。根据分离菌株的菌落形态特征,选取从鳃丝分离纯化的代表菌株Om2202进行后续试验。对Om2202菌株进行电镜负染观察,结果显示该菌呈细长的弯曲或直杆状,菌体表面未见鞭毛和菌毛,有荚膜,有胞外分泌物(图3)。
2. 2 笋壳鱼烂鳃病细菌的鉴定
根据细菌的分离培养特性和形态特征可初步判断分离菌株Om2202疑似为柱状黄杆菌。以分离菌株的基因组DNA,通过PCR扩增其16S rRNA序列,通过BLAST比对分析可知,Om2202菌株16S rRNA序列与柱状黄杆菌的相似性均达100.0%。构建Om2202菌株16S rRNA序列与相近物种的系统发育进化树,发现该菌株与柱状黄杆菌聚为一支,且属于基因群Ⅱ型(图4)。进行特异性PCR扩增,发现该菌株的PCR扩增片段大小与阳性参考菌株相同。综合菌落形态和分子生物学鉴定结果,判定分离菌株Om2202为柱状黄杆菌。
2. 3 分離菌株Om2202的毒力相关基因
以分离菌株Om2202的基因组DNA为模板,通过PCR检测其携带毒力基因的情况。从图5可看出,菌株Om2202的gldD、gldG、gldJ、gldK、gldN、sprF、hly、cslA、ompA、chiA和col毒力基因的PCR扩增结果均为阳性,目的条带大小均符合预期,扩增产物测序结果经BLAST序列比对分析,与已知的以上11种基因序列相似性均在98.0%以上。说明菌株Om2202携带以上11种相关毒力基因,具有较强的致病性。
2. 4 分离菌株Om2202的致病性分析
斑马鱼作为模式动物,常用于开展水产动物病原菌感染试验。以分离菌株Om2202不同浓度梯度菌悬液分别对健康斑马鱼进行腹腔注射感染,结果(表2)显示,试验组7的7 d累计死亡率为0;随着菌液浓度的增加,试验组斑马鱼的累计死亡率呈上升趋势;试验组1的斑马鱼腹腔注射后12 h内即出现急性死亡现象,2 d内的累计死亡率达100.0%;而试验组7与对照组均未出现任何临床症状及死亡现象。根据寇氏法计算,分离菌株Om2202的LC50为7.50×106 CFU/mL。人工感染Om2202菌株后患病斑马鱼的临床症状主要表现为游动缓慢、反应迟缓和摄食减少,胸腹部出现不同程度出血(图6)。对人工感染发病的斑马鱼再次进行病原菌分离,经16S rRNA序列PCR扩增鉴定为柱状黄杆菌,因此,判定Om2202菌株是引起斑马鱼死亡的致病菌。
2. 5 菌株Om2202的药物敏感性分析
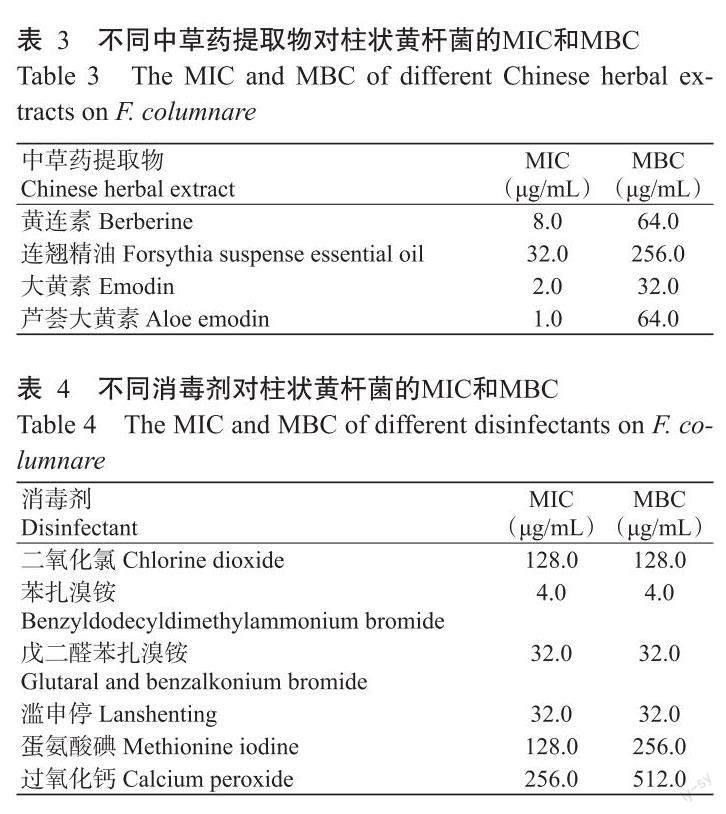
由表3可知,不同中草药对菌株Om2202的MIC和MBC存在差异。其中,芦荟大黄素和大黄素对柱状黄杆菌的MIC分别为1.0和2.0 μg/mL,MBC分别为64.0和32.0 μg/mL;黄连素对柱状黄杆菌的MIC为8.0 μg/mL,MBC为64.0 μg/mL;连翘精油对柱状黄杆菌的MIC为32.0 μg/mL,MBC为256.0 μg/mL。说明菌株Om2202对芦荟大黄素和大黄素较敏感,对黄连素次之,对连翘精油不敏感。
由表4可知,同种消毒剂对Om2202的MIC和MBC基本一致。其中,苯扎溴铵对菌株Om2202的杀菌效果最好,其MIC和MBC均为4.0 mg/L;其次为戊二醛—苯扎溴铵和滥申停(主要成分为戊二醛-苯扎溴铵),其MIC和MBC均为32.0 mg/L;二氧化氯、蛋氨酸碘和过氧化钙对柱状黄杆菌的抑菌效果一般,其MIC分别为128.0和256.0 mg/L。可见,菌株Om2202对消毒剂苯扎溴铵最敏感,对二氧化氯、蛋氨酸碘和过氧化钙不敏感。
3 讨论
柱状黄杆菌隶属于拟杆菌门(Bacteroidetes)黄杆菌纲(Flavobacteria)黄杆菌目(Flavobacteriales)黄杆菌科(Flavobacteriaceae)黄杆菌属(Flavobacte-rium),为革兰氏阴性菌,是柱状黄杆菌病(细菌性烂鳃病)的病原(Bader and Starliper,2002;Declercq et al.,2013),具有滑动能力和团聚性,广泛分布于世界各地的淡水环境和土壤中,是一种危害极广的细菌性疾病病原。柱状黄杆菌还能感染斑点叉尾鮰(Ictalurus Sertatus)(Dikesavalu et al.,2015)、鳜鱼(Siniperca chuatsi)(Zhou et al.,2015)、尼罗罗非鱼(Oreochromis niloticus)(Patra et al.,2016)、鲤(Cyprinus carpio)(Ravindra et al.,2019)、大西洋鲑(Salmo salar)(Chen et al.,2020)和草鱼(Ctenopharyngodon idella)(Chen et al.,2020)等多种鱼类,并导致鱼类柱状黄杆菌病。本研究综合从患烂鳃病笋壳鱼鳃丝分离获得优势菌株Om2202的形态特征和分子生物学鉴定结果,确定其为柱状黄杆菌,该菌对斑马鱼具有较强的致病性。此外,患烂鳃病笋壳鱼内脏组织中并未检测到ISKNV病毒(结果未显示)。因此,确定引起本研究中笋壳鱼烂鳃和死亡的主要病原菌为柱状黄杆菌。已有研究表明,柱状黄杆菌具有多个基因型(Ⅰ~Ⅳ型),世界范围内流行的柱状黄杆菌主要为基因Ⅰ型和Ⅱ型,而菌株Om2202属于优势基因型Ⅱ型(Lafrentz et al.,2018;Sebastiao et al.,2021),表明该基因型柱状黄杆菌的宿主范围较广。
硫酸软骨素AC裂解酶是柱状黄杆菌产生的一种降解酶类,可有效降解宿主组织细胞外基质中的酸性多糖,有效促进柱状黄杆菌对宿主的感染,因此学术界普遍认为硫酸软骨素AC裂解酶是柱状黄杆菌的毒力因子之一(Stringer-roth et al.,2002;Declercq et al.,2013)。溶血素作为细菌的一种重要毒力因子,在该细菌的致病机制中发挥着重要作用(Wiles and Mulvey,2013;李烨等,2015)。张晓林(2016)研究发现,在相同条件下几丁质酶基因突变株对草鱼的侵染能力明显弱于野生株,表明几丁质酶可能与柱状黄杆菌的毒力有关。谢海侠(2005)研究发现,与野生株相比,gldH基因缺失的菌株滑动能力丧失,分解几丁质能力下降,对鱼体鳃部组织的粘附能力减弱。Li等(2017)研究表明,野生型柱状黄杆菌缺失GldN时,其对斑马鱼、斑点叉尾鮰和虹鳟(Oncorhynchus mykiss)的毒力降低,表明滑动基因与柱状黄杆菌的致病力密切相关。Laanto等(2014)、Bhattacharya等(2020)研究表明,柱状黄杆菌的外膜蛋白(OMPs)在疾病传播中起着关键作用,外膜蛋白可能是柱状黄杆菌的毒力因子。可见,柱状黄杆菌的致病性与其携带的相关毒力基因密切相关。本研究结果显示,菌株Om2202携带gldD、gldG、gldJ、gldK、gldN、sprF、hly、cslA、ompA、chiA和col等多种与几丁质酶、胶原酶、滑动性、溶血素、硫酸软骨素和外膜蛋白等相关的毒力基因,且与强毒株的毒力基因型相同或相近(Barony et al.,2015),暗示该菌株具有较强的致病性;斑马鱼人工感染试验结果显示,菌株Om2202对斑马鱼具有较强的致病力,在高剂量感染条件下造成的死亡率达100.0%,可能与该菌株携带较多的毒力相关基因有关。
本研究结果表明,芦荟大黄素、大黄素和消毒剂苯扎溴铵对柱状黄杆菌的抑菌杀菌效果最佳。中草药在防治细菌感染引起的疾病方面具有悠久历史及良好的效果(Zhong et al.,2012;顾艳丽等,2022),在抗生素滥用导致细菌耐药性日益严重的背景下,本研究推荐具有绿色、安全及无耐药性等特点的芦荟大黄素和大黄素作为防控柱状黄杆菌的绿色候选药物,以期在水产养殖过程中能更合理、更广泛地利用中草药。在水体消毒方面,本研究发现苯扎溴铵在体外对柱状黄杆菌具有较好的抑菌效果,与刘丽娟等(2021)的研究结果相似,可作为水体消毒剂的候选药物用于鱼类柱状黄杆菌病防控。
4 结论
柱状黄杆菌是引起本次笋壳鱼烂鳃的主要致病菌,该菌属于广泛流行的基因Ⅱ型菌株,且携带大量的毒力相关基因,对斑马鱼具有较强的致病性,药敏试验结果表明芦荟大黄素、大黄素和苯扎溴铵等药物可作为防控该病原菌的候选药物。
参考文献:
陈智光,麦耀宝,李本旺,黄永强,陈灼均. 2018. 笋壳鱼暴发传染性脾肾坏死病毒病的风险评估[J]. 海洋与渔业,(7):66-67. [Chen Z G,Mai Y B,Li B W,Huang Y Q,Chen Z J. 2018. Risk assessment of outbreaks of ISKNV disease in Oxyeleotris marmoratus[J]. Ocean and Fishery,(7):66-67.] doi:10.3969/j.issn.1672-4046.2018.07.032.
陈灼均. 2020. 笋壳鱼虹彩病毒病的防控[J]. 广东蚕业,54(4):51-52. [Chen Z J. 2020. Prevention and control strategy of iridovirus disease in shoot shell fish[J]. Guangdong Sericulture,54(4):51-52.] doi:10.3969/j.issn. 2095-1205.2020.04.25.
鄧海燕,李本旺,李希国,张端秀,林强. 2021. 华南地区笋壳鱼病害防治技术[J]. 黑龙江水产,40(3):51-54. [Deng H Y,Li B W,Li X G,Zhang D X,Lin Q. 2021. Disease prevention and control technology of Oxyeleotris in South China[J]. Northern Chinese Fisheries,40(3):51-54.] doi:10.3969/j.issn.1674-2419.2021.03.017.
樊佳佳,马冬梅,朱华平,林明辉,池金泉. 2022. 杂交尖塘鳢人工繁殖及饲料驯化技术要点[J]. 科学养鱼,(4):9-10. [Fan J J,Ma D M,Zhu H P,Lin M H,Chi J Q. 2022. Key points of artificial propagation and feed domestication of hybrid Oxyeleotris[J]. Scientific Fish Farming,(4):9-10.] doi:10.14184/j.cnki.issn1004-843x.2022. 04.003.
顾艳丽,曹艳子,王效禹,单春乔,刘艳,江国托. 2022. 发酵中药对禽大肠杆菌病肉鸡肠道菌群的影响[J]. 河南农业科学,51(7):145-153. [Gu Y L,Cao Y Z,Wang X Y,Shan C Q,Liu Y,Jiang G T. 2022. Effect of fermented traditional Chinese medicine on intestinal microflora of broilers with avian colibacillosis[J]. Journal of Henan Agricultural Sciences,51(7):145-153.] doi:10.15933/j.cnki.1004-3268.2022.07.015.
黄锦炉,汪开毓,姜婷婷,黄小丽,耿毅,陈德芳. 2010. 柱状黄杆菌部分生物学特性的研究[J]. 大连海洋大学学报,25(6):506-510. [Huang J L,Wang K Y,Jiang T T,Huang X L,Geng Y,Chen D F. 2010. The biological characteristics of bacterium Flavobacterium columnare[J]. Journal of Dalian Fisheries University,25(6):506-510.] doi:10. 16535/j.cnki.dlhyxb.2010.06.005.
李翠萍,吴民耀,王宏元. 2012. 3种半数致死浓度计算方法之比较[J]. 动物医学进展,33(9):89-92. [Li C P,Wu M Y,Wang H Y. 2012. LC50 caculated by kochi,probit ana-lysis and linear regression method[J]. Progress in Veterinary Medicine,33(9):89-92.] doi:10.16437/j.cnki.1007-5038.2012.09.012.
李烨,李楠,张晓林,秦婷,聂品. 2015. 鱼类烂鳃病病原柱状黄杆菌溶血素基因的初步研究[J]. 水生生物学报,39(3):604-607. [Li Y,Li N,Zhang X L,Qin T,Nie P. 2015. Preliminary study on haemolysin gene in Flavobacterium columnare,the pathogen of columnaris disease of fish[J]. Acta Hydrobiologica Sinica,39(3):604-607.] doi:10.7541/2015.79.
刘丽娟,王亚军,石存斌,王庆,张德锋. 2021. 水产常见消毒剂对鱼源柱状黄杆菌的抑菌和杀菌效果研究[J]. 科学养鱼,(11):47-49. [Liu L J,Wang Y J,Shi C B,Wang Q,Zhang D F. 2021. Antibacterial and bactericidal effects of common aquatic disinfectants on Flavobacterium columnare from fish[J]. Scientific Fish Farming,(11):47-49.] doi:10.14184/j.cnki.issn1004-843x.2021.11.026.
麦耀宝,陈智光,陈灼均,李本旺,林强. 2018. 云斑尖塘鳢烂身病病原分离鉴定及药敏试验[J]. 广东农业科学,45(6):116-119. [Mai Y B,Chen Z G,Chen Z J,Li B W,Lin Q. 2018. Isolation,identification and drug susceptibi-lity of Aeromonas veronii isolated from Oxyeleotris marmoratus[J]. Guangdong Agricultural Sciences,45(6):116-119.] doi:10.16768/j.issn.1004-874X.2018.06.019.
戚建华,刘韵怡,童文涛,肖翎,赵祯,宋增福. 2020. 牛蛙腐皮病病原菌分离鉴定及药敏试验[J]. 南方农业学报,51(2):461-469. [Qi J H,Liu Y Y,Tong W T,Xiao L,Zhao Z,Song Z F. 2020. Isolation and identification of the pathogen of rot skin disease in Rana catesbiana and its drug sensitive test[J]. Journal of Southern Agriculture,51(2):461-469.] doi:10.3969/j.issn.2095-1191.2020. 02.028.
宋長江. 2019. 尖塘鳢常见病害及防治方法[J]. 海洋与渔业,(7):2. [Song C J. 2019. Common diseases and control methods of Oxyeleotris[J]. Ocean and Fishery,(7):2.] doi:10.3969/j.issn.1672-4046.2019.07.041.
唐绍林,卢稀,雷燕,王娟,席云清. 2018. 笋壳鱼神经坏死病毒病的流行特点及防控建议,有助降低发病率和死亡率[J]. 当代水产,43(1):84-85. [Tang S L,Lu X,Lei Y,Wang J,Xi Y Q. 2018. Epidemiological characteristics and prevention and control suggestions of NNV disease in Oxyeleotris,which can help reduce morbidity and mortality[J]. Current Fisheries,43(1):84-85.] doi:10.3969/j.issn.1674-9049.2018.01.030.
陶莎,张效平,商宝娣,李小义,姚俊杰. 2022. 中草药及复方对嗜水气单胞菌体外抑菌作用研究[J]. 水产科学,41(5):883-890. [Tao S,Zhang X P,Shang B D,Li X Y,Yao J J. 2022. In vitro effect of single and compound chinese herbal medicines on bacteriostasis of Aeromonas hydrophila[J]. Fisheries Science,41(5):883-890.]doi:10. 16378/j.cnki.1003-1111.20069.
王學耕,余杰,苗玉涛,麦康森,汪蕾. 2023. 云斑尖塘鳢研究进展与前景展望[J/OL]. 水产学报. https://kns.cnki.net/kcms/detail//31.1283.S.20230111.1140.002.html. [Wang X G,Yu J,Miao Y T,Mai K S,Wang L. 2023. Research progress and prospect of marble goby(Oxyeleotris marmorata)[J/OL]. Journal of Fisheries of China. https://kns.cnki.net/kcms/detail//31.1283.S.20230111.1140.002.html.]
谢海侠. 2005. 柱状黄杆菌毒力相关因子的研究[D]. 武汉:中国科学院水生生物研究所. [Xie H X. 2005. Cloning and characterization of possible virulence factors of Flavobacterium columnare[D]. Wuhan:Institute of Hydrobio-logy,Chinese Academy of Sciences.]
张晓林. 2016. 柱状黄杆菌几丁质酶基因的缺失突变及其突变株的生长,致病力与转录组研究[D]. 北京:中国科学院大学. [Zhang X L. 2016. Deletion mutation of chiti-nase gene in Flavobacterium columnare and its growth,pathogenicity and transcriptome study[D]. Beijing:University of Chinese Academy of Sciences.].
周阳,李本旺,林强,付小哲,李敏,梁红茹,刘礼辉,卢伟华,李宁求. 2019. 病毒灭活疫苗诱导云斑尖塘鳢脾脏转录组分析[J]. 基因组学与应用生物学,38(10):4404-4412. [Zhou Y,Li B W,Lin Q,Fu X Z,Li M,Liang H R,Liu L H,Lu W H,Li N Q. 2019. Transcriptome analysis of spleen induced by inactivated viral vaccine in marbled sand goby,Oxyeleotris marmoratus[J]. Genomics and Applied Biology,38(10):4404-4412.] doi:10.13417/j.gab.038.004404.
Bader J,Starliper C E. 2002. The genera Flavobacterium and Flexibacter[M]. Molecular Diagnosis of Salmonid Di-seases,Springer,Dordrecht. doi:10.1007/978-94-017-2315-2_5.
Barony G M,Tavares G C,Assis G B,Luz R K,Leal C A G. 2015. New hosts and genetic diversity of Flavobacterium columnare isolated from Brazilian native species and Nile tilapia[J]. Diseases of Aquatic Organisms,117(1):1-11. doi:10.3354/dao02931.
Bhattacharya M,Malick R C,Mondal N,Patra P,Pal B B,Patra B C,Das B K. 2020. Computational characterization of epitopic region within the outer membrane protein candidate in Flavobacterium columnare for vaccine development[J]. Journal of Biomolecular Structure & Dynamics,38(2):450-459. doi:10.1080/07391102.2019.1580222.
Chen T,Zhou J,Qu Z,Yuan G. 2020. Administration of die-tary recombinant hepcidin on grass carp(Ctenopharyngodon idella) against Flavobacterium columnare infection under cage aquaculture conditions[J]. Fish & Shellfish Immunology,99:27-34. doi:10.1016/j.fsi.2020.01.042.
Declercq A M,Haesebrouck F,Broeck W. 2013. Columnaris disease in fish:A review with emphasis on bacterium-host interactions[J]. Veterinary Research,44(1):27. doi:10.1186/1297-9716-44-27.
Dikesavalu H,Patra A,Banerjee S,Sarkar A,Abraham T J. 2015. Phenotypic and molecular characterization and pathology of Flectobacillus roseus causing flectobacillosis in captive held carp Labeo rohita(Ham.) fingerlings[J]. Aquaculture,43960-43965. doi:10.1016/j.aquaculture. 2014.12.036.
Farmer B. 2004. Improved methods for the isolation and cha-racterization of Flavobacterium columnare[D]. Natchitoches:Northwestern State University.
Guo X X,Zhou Y,Fu X Z,Lin Q,Liu L H,Liang H R,Niu Y J,Li N Q. 2020. Transcriptomic profiles reveal that inactivated iridovirus and rhabdovirus bivalent vaccine eli-cits robust adaptive immune responses against lethal challenge in marbled sleepy goby[J]. Fish & Shellfish Immunology,98:429-437. doi:10.1016/j.fsi.2020.01.047.
Guz L,Puk K,Walczak N,Oniszczuk T,Oniszczuk A. 2014. Effect of dietary supplementation with Echinacea purpurea on vaccine efficacy against infection with Flavobacterium columnare in zebrafish(Danio rerio)[J]. Po-lish Journal of Veterinary Sciences,17(4):583-586. doi:10.2478/pjvs-2014-0087.
Klesius P H,Shoemaker C A,Evans J J. 2008. Flavobacterium columnare chemotaxis to channel catfish mucus[J]. FEMS Microbiology Letters,288(2):216-220. doi:10.1111/J.1574-6968.2008.01348.X.
Laanto E,Penttinen R K,Bamford J K,Sundberg L R. 2014. Comparing the different morphotypes of a fish pathogeni-mplications for key virulence factors in Flavobacterium columnare[J]. BMC Microbiology:14170. doi:10.1186/1471-2180-14-170.
Lafrentz B R,García J C,Waldbieser G C,Evenhuis J P,Loch T P,Liles M R,Wong F S,Chang S F. 2018. Identification of four distinct phylogenetic groups in Flavobacterium columnare with fish host associations[J]. Frontiers in Microbiology,13(9):452. doi:10.3389/fmicb. 2018.00452.
Lam S S,Ambak M A,Jusoh A,Law A T. 2008. Waste excretion of marble goby(Oxyeleotris marmorata Bleeker) fed with different diets[J]. Aquaculture,274:49-56. doi:10.1016/j.aquac ulture.2007.11.023.
Li N,Zhu Y T,LaFrentz B R,Evenhuis J P,Hunnicutt D W,Conrad R A,Barbier P,Gullstrand C W,Roets J E,Powers J L,Kulkarni S S,Erbes D H,García J C,Nie P,McBride M J. 2017. The type IX secretion system is required for virulence of the fish pathogen Flavobacterium columnare[J]. Applied and Environmental Microbiology,83(23):e01769-17. doi:10.1128/AEM.01769-17.
Patra A,Sarker S,Banerjee S,Adikesavalu H,Biswas D,Abraham T J. 2016. Rapid detection of Flavobacterium columnare infection in fish by speciesspecific polymerase Chain reaction[J]. Journal of Aquaculture Research and Development,7(9):1-4. doi:10.4172/2155-9546.1000445.
Prasankok P M,Chutmongkonkul M,Kanchanakhan S,2005. Characterization of iridovirus isolated from diseased marbled sleepy goby,Oxyelrotris marmoratus[J]. Asian Fisher-ies Society,34(5):197-206..
Ravindra,Pradhan P K,Paria A,Pande V,Sood N. 2019. Expression of immune genes in Indian major carp,Catla catla challenged with Flavobacterium columnare[J]. Fish & Shellfish Immunology,94:599-606. doi:10.1016/j.fsi.2019.09.052.
Sebastiao F,Shahin K,Heckman T I,Lafrentz B R,Griffin M J,Loch T P,Mukkatira K,Veek T,Richey C,Adkison M. 2021. Genetic characterization of Flavobacterium columnare isolates from the Pacific Northwest,USA[J]. Di-seases of Aquatic Organisms,144:151-158. doi:10.3354/dao03588.
Stringer-roth K M,Yunghans W,Caslake L F. 2002. Differen-ces in chondroitin AC lyase activity of Flavobacterium columnare isolates[J]. Journal of Fish Diseases,25(11):687-691. doi:10.1046/j.1365-2761.2002.00421.x.
Székely C,Shaharom-Harrison F,Cech G,Ostoros G,Molnár K. 2009. Myxozoan infections in fishes of the Tasik Kenyir water reservoir Terengganu,Malaysia[J]. Diseases of Aquatic Organisms,83:37-48. doi:10.3354/dao01991.
Wang Q,Zeng W W,Li K B,Chang O Q,Liu C,Wu G H,Shi C B,Wu S Q. 2011. Outbreaks of an iridovirus in marbled sleepy goby,Oxyeleotris marmoratus(Bleeker),cultured in southern China[J]. Journal of Fish Diseases,34(5):399-402. doi:10.1111/j.1365-2761.2011.01244.x.
Welker T L,Shoemaker C A,Arias C R,Klesius P H. 2005. Transmission and detection of Flavobacterium columnare in channel catfish Ictalurus punctatus[J]. Diseases of Aqua-tic Organisms,63(2-3):129-138. doi:10.3354/DAO063129.
Wiles T J,Mulvey M A. 2013. The RTX pore-forming toxin α-hemolysin of uropathogenic Escherichia coli:Progress and perspectives[J]. Future Microbiology,8(1):73-84. doi:10.2217/FMB.12.131.
Zhong Q L,Guan R Z,Wang L H,Liu H W. 2012. Antibacterial activity analysis for six kinds of Chinese herbs and their compounds against pathogenic Aeromonas from cultured eels in vitro[J]. Acta Hydrobiologica Sinica,36(1):85-92. doi:10.3724/SP.J.1035.2012.00085.
Zhou W D,Zhang Y L,Wen Y,et al. 2015. Analysis of the transcriptomic profilings of mandarin fish(Siniperca chua-tsi) infected with Flavobacterium columnare with an emphasis on immune responses[J]. Fish & Shellfish Immunology,43:111-119. doi:10.1016/j.fsi.2014.12.006.
(責任编辑 思利华)

