miR-93-5p 靶向下调ROCK2 表达对类风湿性关节炎成纤维样滑膜细胞增殖、迁移和侵袭的影响
杨 舟, 林书典, 詹宇威, 肖 璐, 符克英, 黄小蝶
(海南省人民医院 海南医学院附属海南医院风湿免疫科,海南 海口 570000)
类风湿性关节炎(rheumatoid arthritis,RA)是以关节滑膜炎为主要特征的系统性疾病。作为滑膜的主要组成细胞,成纤维样滑膜细胞(fibroblastlike synoviocytes,FLSs)在RA 患者滑膜组织中具有肿瘤细胞的特点,呈增殖、迁移和侵袭能力异常,可诱发致炎因子和蛋白酶的分泌,导致关节内软骨和骨的破坏及滑膜炎症[1-2]。Rho 相关螺旋卷曲蛋白激酶(Rho associated coiled-coil containing protein kinases,ROCK)作为小型Rho 三磷酸鸟苷(guanosine triphosphate,GTP)酶的主要下游效应蛋白,是细胞黏附、迁移、收缩和增殖等过程的多功能调节剂,参与癌症、糖尿病和RA 等各种疾病的发生发展[3]。ROCK2 作为ROCK 蛋白家族成员之一,已被证实在RA 中高表达,并促进RA-FLSs的增殖、迁移和侵袭[4]。近年来,微小RNA(microRNA,miRNA)常作为各种疾病的治疗靶点。miR-93-5p 是炎症抑制因子,可抑制骨关节炎软骨细胞凋亡和炎症反应[5]。过表达miR-93-5p 可通过靶向下调ROCK2 表达进而抑制糖尿病肾病细胞增殖和纤维化并加速细胞凋亡[6]。目前有关miR-93-5p 与RA 关系的研究尚未完全阐明,因此本研究探讨miR-93-5p 对RA-FLSs 增殖、迁移和侵袭的影响,并初步阐明其作用机制,旨在为临床RA 的治疗提供新的思路。
1 资料与方法
1.1 临床资料选择2020 年1 月—2021 年6 月在海南省人民医院风湿免疫科接受治疗的RA 患者(RA 组)37 例和接受关节置换手术的关节创伤患者(对照组)30 例作为研究对象,收集新鲜滑膜组织样本。所有RA 患者均符合美国风湿病学会(american college of rheumatology,ACR)1987 年RA 诊断标准[7],所有关节创伤患者无关节炎病史、未用过激素和慢作用药物等。所有患者均签订知情同意书,并获得海南省人民医院伦理委员会批准。
1.2 细胞、主要试剂和仪器293T 细胞购自武汉普诺赛生命科技有限公司。DMEM 完全培养基、Ⅰ型胶原酶、Matrigel 基质胶和结晶紫购自美国Sigma 公司,LipofectamineTM2000 转染试剂购自美国Thermo Fisher 公司,TaqMan miRNA 逆转录试剂盒、TaqMan miRNA 定量PCR 试剂盒、Golden MLV 反转录酶和RAPA3G Probe qPCR MasterMix购自哈尔滨新海基因检测有限公司,miR-93-5p mimics 及其阴性对照mimics NC 和ROCK2 过表达质粒载体(OE-ROCK)及其空载质粒载体(OENC)购自广州锐博生物科技有限公司,抗体CD14-PE、CD55-PE、CD68-FITC 及同型阴性对照抗体购自美国BD 公司,Vimentin 抗体(免疫荧光)、ROCK2 抗体、Ki-67 抗体、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体、基质金属蛋白酶(matrix metallopeptiase,MMP)-2抗体、MMP-9 抗体和GAPDH 抗体购自英国Abcam 公司,BeyoClickTMEdU-488 细胞增殖检测试剂盒购自上海碧云天生物技术有限公司,CCK-8试剂盒和双荧光素酶报告基因检测试剂盒购自北京索莱宝科技有限公司,Transwell小室(孔径8.0 μm)购自美国Corning 公司。流式细胞仪(型号:AttuneTMNxT)、CO2培养箱(型号:HeracellTMVios 250i)和多功能酶标仪(型号:Varioskan LUX)购自美国Thermo Fisher 公司,实时荧光定量PCR (real-time fluorescence quantitative PCR,RT-qPCR)仪(型号:CFX96-Connect 96)购自美国Bio-Rad 公司,激光共聚焦显微镜(型号:DMIL LED)购自日本Nikon 公司。
1.3 RA-FLSs 的分离、培养和鉴定将RA 组患者滑膜组织于无菌条件下剪碎,并加入1 % Ⅰ型胶原酶消化2 h,吸取组织块转移至培养瓶中,置于37 ℃、5% CO2培养箱培养2 h。取出培养瓶加入DMEM 完全培养基,继续置于CO2培养箱中培养;每隔2 d 换液1 次,发现有细胞爬出后,去除组织块,继续培养至细胞密度达80 %以上,采用0.25 %胰蛋白酶消化细胞,并按1∶3 比例进行传代。采用免疫荧光法和流式细胞术鉴定所培养的细胞为RA-FLSs。免疫荧光法:将第3 代RA-FLSs培养于细胞爬片上,待细胞生长至80 %时,弃去培养基,PBS 缓冲液洗涤2 次,加入4 %多聚甲醛室温固定30 min,PBS 缓冲液洗涤2 次,加入0.5 %Triton X-100 室温通透20 min,PBS 缓冲液洗涤2 次,加入5 %BSA 溶液于37 ℃封闭1 h,弃去封闭液,加入一抗Vimentin 抗体,4 ℃条件下孵育过夜,PBS 缓冲液洗涤2 次,加入荧光二抗,于37 ℃孵育1 h,PBS 缓冲液洗涤2 次,加入500 μL含DAPI 抗荧光淬灭封片液,激光共聚焦显微镜拍照并记录。流式细胞术:将第3 代RA-FLSs 消化调整密度为1×106mL-1的细胞悬液,取100 μL 细胞悬液加入至各个检测管中,分别加入荧光标记的CD14-PE、CD55-PE 和CD68-FITC 抗体及同型阴性对照抗体,避光孵育30 min,1 500 r·min-1离心5 min,弃上清,将细胞沉淀加入PBS 缓冲液重悬后,流式细胞术检测RA-FLSs 表面抗原表达情况。
1.4 细胞转染和分组将第3 代RA-FLSs 以每孔2×105个细胞的密度接种于6 孔细胞培养板上,细胞密度生长至80 %时,按照LipofectamineTM2000转染试剂盒说明书操作进行转染。将RA-FLSs 分为空白组、mimics NC 组(转染miR-93-5p mimics NC)、mimics 组(转染miR-93-5p mimics)、OENC 组(转染ROCK2 过表达空载质粒)、OEROCK2 组(转染ROCK2 过表达质粒)、mimics+OE-NC 组(共转染miR-93-5p mimics 和ROCK2 过表达空载质粒)和mimics+OE-ROCK2 组(共转染miR-93-5p mimics 和ROCK2 过表达质粒)。
1.5 RT-qPCR 法检测2 组患者滑膜组织和各组RA-FLSs 中miR-93-5p 及ROCK2 mRNA 表达水平将2 组患者滑膜组织和各组RA-FLSs 裂解,提取总RNA,各取2 μg 滑膜组织和细胞中总RNA,反转录为cDNA,配置RT-qPCR 反应体系,进行RT-qPCR 反应,引物序列:miR-93-5p F 5′-GAGTGTCAAAGTGCTGTTCGTG-3′,miR-93-5p R 5′-GCAG GGTCCGAGGTATTC-3′;U6 F 5′-CTCGCTTCGGCAGCACA-3′,U6 R 5′-AACGCTTCACGAATTTGCGT-3′;ROCK2 F 5′-GAACGTCAGGATGCAGATGG-3′,ROCK2 R 5′-GCCAAAGAGTCCCGTTCATC-3′;β-actin F 5′-CCCTGGAGAAGAGCTACGAG-3′,β-actin R 5′-GGAAGGAAGGCTGGAAGAGT-3′。反应条件:95 ℃ 热启动5 min;95 ℃变性5 s;55 ℃退火10 s,72 ℃延伸 30 s,循环40 次。以U6 作为miR-93-5p 的内参,β-actin 作为ROCK2 mRNA 的内参,采用2-△△Ct法计算目的基因mRNA 表达水平。
1.6 CCK-8 法检测各组RA-FLSs 增殖活性取各组对数生长期RA-FLSs 进行细胞计数,并将其调整至密度为5×104mL-1的细胞悬液。于96 孔细胞培养板中每孔加入100 μL RA-FLSs 悬液,置于培养箱中过夜。分别培养24 和48 h,取出细胞培养板,加入CCK-8 溶液,继续培养4 h 后置入酶标仪,于波长450 nm 处检测各孔吸光度(A)值,同时设置调零孔(每孔100 μL 培养基),每组设定4 个复孔。以A 值代表各组细胞增殖活性。
1.7 EdU 染色检测各组RA-FLSs 中EdU 阳性细胞率将各组对数生长期RA-FLSs 接种至96 孔细胞培养板上,待细胞贴壁后,每孔加入100 μL EdU 培养基(50 μmol·L-1)孵育2 h,PBS 缓冲液清洗2 次,加入4 %多聚甲醛固定液室温孵育30 min,含0.5 %Triton X-100 的PBS 处理10 min,PBS 缓冲液清洗后,加入Apollo 染色反应液,室温避光脱色摇床孵育30 min,再以Hoechst33342 反应液复染进行DNA 染色。染色完成立即置于显微镜下观察细胞染色情况,并随机选取5 个视野进行计数,计算各组RA-FLSs 中EdU 阳性细胞率。EdU阳性细胞率=EdU 阳性细胞数/细胞总数×100%。
1.8 Transwell 小室实验检测各组RA-FLSs 迁移和侵袭数迁移实验:将RA-FLSs 制成密度为5×105mL-1的细胞悬液,取100 μL 加入Transwell 上室,下室加入600 μL 含10 %血清的培养基,于37 ℃、5 % CO2培养箱中培养24 h,取出小室,用棉签拭去上室细胞,加入70% 甲醛固定1 h,0.1 %结晶紫溶液染色30 min,取出小室内聚碳酸酯膜,移至载玻片上,用中性树胶封片,于显微镜下观察细胞迁移情况,并随机选取5 个视野,计数迁移细胞数并取其平均值。侵袭实验:将Matrigel胶置于4 ℃冰箱过夜,已融化的Matrigel 胶采用无血清的培养基稀释至300 mL·L-1,取100 μL 均匀涂抹在聚碳酸酯膜上表面,室温放置3 h 成胶状,后续操作同迁移实验,于显微镜下随机选取5 个视野,计数穿膜细胞数,并取其平均值作为侵袭细胞数。实验重复3 次。
1.9 Western blotting 法检测各组RA-FLSs 中ROCK2、Ki-67、PCNA、MMP-2 和MMP-9 蛋白表达水平收集各组细胞,加入RIPA 裂解液裂解后,13 000 r·min-1离心10 min,收集上清,置于酶标仪中测定蛋白浓度。将检测蛋白样品置于沸水浴中10 min,使蛋白充分变性,取30 μg 总蛋白上样行10% SDS-PAGE 电泳,采用湿式电转PVDF膜,转膜结束后,标记Marker,并进行丽春红染色后剪膜,TBST 溶液洗膜2 次,将膜完全浸没5 %脱脂奶粉封闭液内室温轻摇1 h,将封闭后的膜放入杂交袋中,分别加入一抗ROCK2 抗体(1∶1 000)、Ki-67 抗体(1∶1 000)、PCNA 抗体(1∶1 000)、MMP-2抗体(1∶1 000)、MMP-9抗体(1∶1 000)和GAPDH 抗体(1∶1 000),室温孵育10 min,4 ℃过夜。次日,室温孵育30 min,TBST 溶液洗膜5 次,加入二抗(1∶10 000)室温轻摇40 min,TBST 溶液洗膜5 次,滴加增强型化学发光液(enhanced chemiluminescence,ECL)至膜上反应2 min,于凝胶成像系统中观察拍照。采用Image J 软件分析蛋白条带灰度值,以GAPDH 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.10 miR-93-5p 与ROCK2 的靶向关系验证和细胞中双荧光素酶活性检测采用TargetScan 7.2 在线网站预测miR-93-5p 和ROCK2 的靶向结合位点。根据结合位点序列,设计合成ROCK2-3′-UTR 野生型(ROCK2-WT)和ROCK2-3′-UTR 突变型(ROCK2-MUT)片段序列,并分别构建至荧光素酶报告载体中,得到ROCK2-WT 和ROCK2-MUT荧光素酶报告质粒。采用Lipofectamine 2000 试剂分别将miR-93-5p mimic 和mimic NC 与ROCK2-WT 或ROCK2-MUT 质粒共同转染对数生长期293T 细胞。转染48 h 后,将已充分裂解的细胞按照双荧光素酶报告检测试剂盒说明书进行操作,并采用酶标仪测定细胞中萤火虫和海肾荧光素酶活性,计算荧光素酶活性。荧光素酶活性=萤火虫荧光素酶活性/海肾荧光素酶活性。
1.11 统计学分析采用SPSS 22.0 统计软件进行统计学分析。2 组患者滑膜组织和各组细胞中miR-93-5p 及ROCK2 mRNA 表达水平,各组细胞增殖活性、EdU 阳性细胞率、迁移和侵袭细胞数、细胞中ROCK2、Ki-67、PCNA、MMP-2 和MMP-9 蛋白表达水平及细胞中荧光素酶活性均符合正态分布,以±s 表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 RA-FLSs 鉴定免疫荧光法检测结果显示:Vimentin 蛋白表达呈阳性。流式细胞术检测结果显示:第3 代RA-FLSs 表面CD55 呈阳性表达,阳性表达率为(95.4%±4.9%),CD14 和CD68 呈阴性表达,阴性表达率为(4.1%±1.3%)和(3.3%±1.0%)。由此证实所分离的细胞是RAFLSs。见图1。
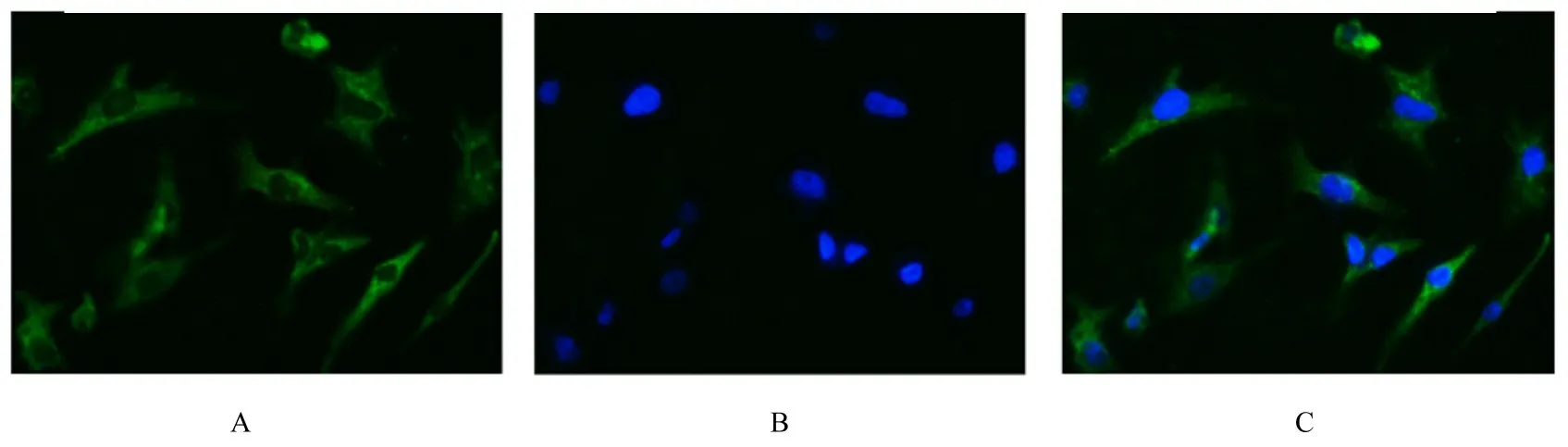
图1 免疫荧光法检测RT-FLSs 中Vimentin 表达(×400)Fig.1 Expressions of Vimentin in RT-FLSs detected by immunofluorescence method(×400)
2.2 2 组患者滑膜组织中miR-93-5p 和ROCK2 mRNA 表达水平与对照组(1.00±0.02 和1.00±0.01)比较,RA 组患者滑膜组织中miR-93-5p 表达水平(0.26±0.05)明显降低(P<0.01),ROCK2 mRNA 表达水平(5.87±0.30)明显升高(P<0.01)。
2.3 各组 RA-FLSs 中 miR-93-5p 和 ROCK2 mRNA 及蛋白表达水平与空白组[(1.00±0.02)、(1.00±0.01)和 (1.00±0.05)]和mimics NC 组[(1.00±0.02)、(1.00±0.01)和(1.00±0.05)]比较,mimics 组细胞中miR-93-5p表达水平(8.06±0.05)明显升高(P<0.01),ROCK2 mRNA (0.19±0.05)和蛋白(0.11±0.03)表达水平明显降低(P<0.01)。见图2。

图2 miR-93-5p mimics 转染后RA-FLSs 中ROCK2 蛋白表达电泳图Fig.2 Electrophoregram of expression of ROCK2 protein in RA-FLSs after transfected with miR-93-5p mimics
2.4 各组RA-FLSs 细胞增殖活性和EdU 阳性细胞率培养24 和48 h 时,与mimics NC 组比较,mimics 组细胞增殖活性和EdU 阳性细胞率明显降低(P<0.01),OE-ROCK2 组细胞增殖活性和EdU 阳性细胞率明显升高(P<0.01),而OE-NC组上述指标差异均无统计学意义(P>0.05)。培养24 和48 h 时,与mimics 组比较,mimics+OEROCK2 组细胞增殖活性和EdU 阳性细胞率明显升高(P<0.01),而mimics+OE-NC 组细胞上述指标差异均无统计学意义(P>0.05)。见图3~5。

图3 CCK-8 法检测各组细胞增殖活性Fig.3 Proliferation activity rates of cells in various groups detected by CCK-8 method
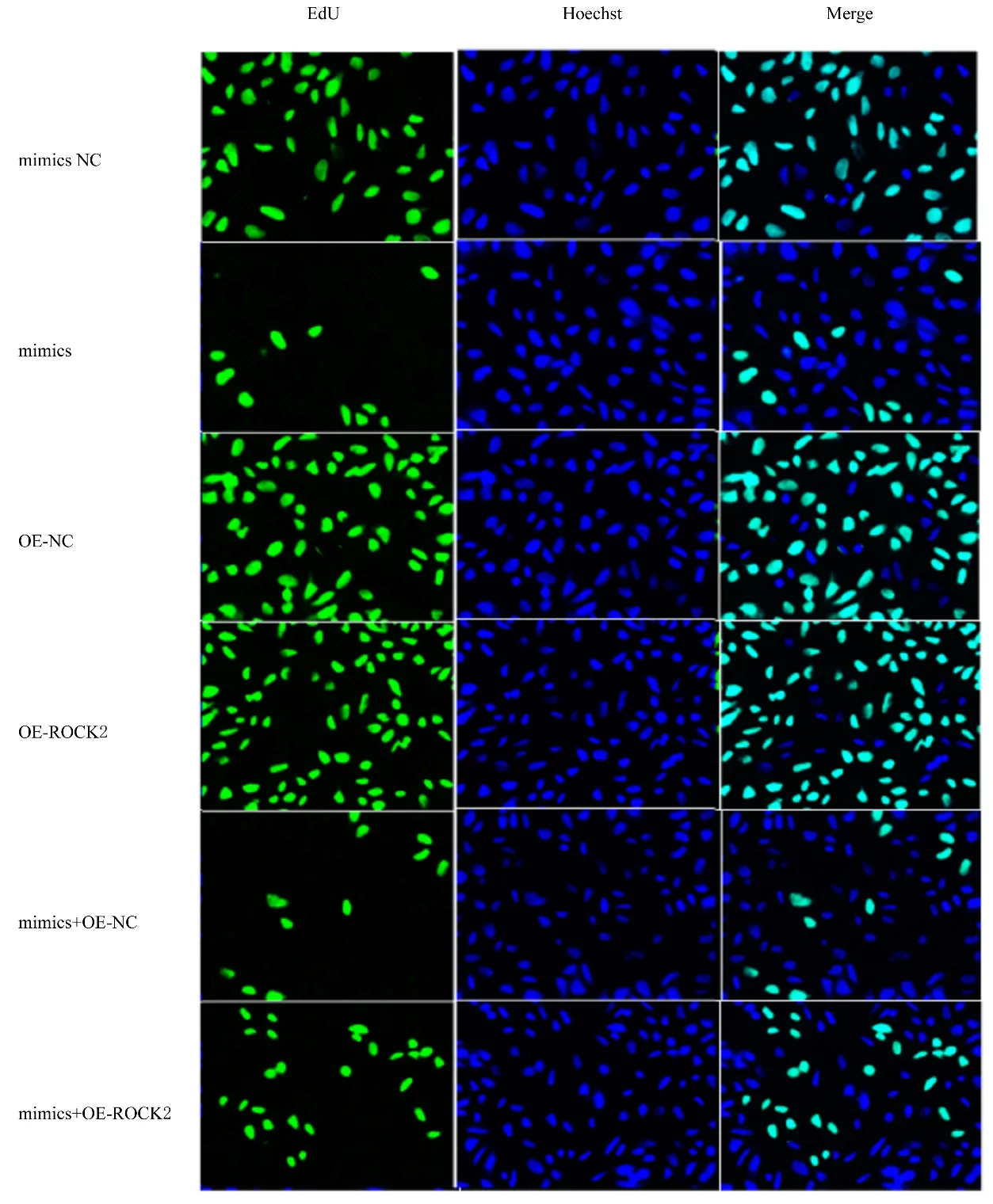
图4 EdU 染色检测各组EdU 阳性细胞(×400)Fig.4 EdU positive cells in various groups detected by EdU staining(×400)

图5 各组EdU 阳性细胞率Fig.5 Rates of EdU positive cells in various groups
2.5 各组RA-FLSs 的迁移和侵袭数与mimics NC 组比较,mimics 组RA-FLSs 的迁移和侵袭数明显减少(P<0.01),OE-ROCK2 组RA-FLSs 的迁移和侵袭数明显增加(P<0.01),而OE-NC 组RA-FLSs 的迁移和侵袭数差异均无统计学意义(P>0.05)。与mimics 组比较,mimics+OE-ROCK2 组RA-FLSs 的迁移和侵袭数明显增加(P<0.01),而mimics+OE-NC 组RA-FLSs 的迁移和侵袭数差异均无统计学意义(P>0.05)。见图6 和7。

图6 Transwall 小室实验检测各组迁移细胞数Fig.6 Numbers of migration cells in various groups detected by Transwell champer assay

图7 Transwell 小室实验检测各组细胞侵袭细胞数Fig.7 Numbers of invasion cells in various groups detected by Transwell champer assay
2.6 各组RA-FLSs 中ROCK2、Ki-67、PCNA、MMP-2 和MMP-9 蛋白表达水平与mimics NC 组比较,mimics 组细胞中ROCK2、Ki-67、PCNA、MMP-2 和MMP-9 蛋白表达水平明显降低(P<0.01),OE-ROCK2 组细胞中ROCK2、Ki-67、PCNA、MMP-2 和MMP-9 蛋白表达水平明显升高(P<0.01),OE-NC 组细胞中ROCK2、Ki-67、PCNA、MMP-2 和MMP-9 蛋白表达水平差异均无统计学意义(P>0.05)。与mimics 组比较,mimics+OE-ROCK2 组细胞中ROCK2、Ki-67、PCNA、MMP-2 和MMP-9 蛋白表达水平明显升高(P<0.01),mimics+OE-NC 组细胞中ROCK2、Ki-67、PCNA、MMP-2 和MMP-9 蛋白表达水平差异均无统计学意义(P>0.05)。见图8。

图8 Western blotting 法检测各组细胞中ROCK2、Ki-67、PCNA、MMP-2 和MMP-9 蛋白表达电泳图(A)和直条图(B)Fig.8 Electrophoregram (A) and histogram(B) of expressions of ROCK2,Ki-67,PCNA,MMP-2, and MMP-9 proteins in cells in various groups detected by Western blotting method
2.7 miR-93-5p 与ROCK2 的靶向关系验证
TargetScan7.2 在线网站分析结果显示:miR-93-5p 与ROCK2 -3′-UTR 之间存在靶向结合位点,提示miR-93-5p 可靶向调控ROCK2。双荧光素酶报告结果显示:转染miR-93-5p mimic 可明显降低ROCK2-WT 组细胞中荧光素酶活性(P<0.01),但ROCK2-MUT 组细胞中荧光素酶活性差异无统计学意义(P>0.05)。见图9。

图9 ROCK2-WT(A)和ROCK2-MUT(B)组细胞中荧光素酶活性Fig.9 Luciferase activies in cells in ROCK2-WT (A) and ROCK2-MUT (B) groups
3 讨 论
FLSs 作为RA 的主要效应细胞,可产生各种致病介质,如趋化因子和MMP,促进炎症反应和骨坏死[8-9]。研究[10-12]发现:在RA-FLSs 中出现多种miRNA 表达异常,miRNA 在FLSs 和破骨细胞中表达失调,促进MMP 分泌,引起炎症和细胞外基质降解,破坏关节。miR-124a 在RA 患者滑膜组织中呈低表达,通过靶向调控AKT2 基因抑制RAFLSs 的增殖、迁移和侵袭[13]。而miR-93-5p 作为一种细胞增殖、迁移和侵袭的抑制基因,常用于治疗各种癌症疾病,目前其在RA 疾病中的作用尚未完全阐明[14]。本研究结果显示:RA-FLSs 中Vimentin 表达呈阳性,细胞表面CD55 呈阳性表达,而CD14 和CD68 呈阴性表达,提示所分离的细胞是RA-FLSs。进一步研究发现:过表达miR-93-5p 可抑制RA-FLSs 的增殖、迁移和侵袭,而抑制miR-93-5p 表达则促进RA-FLSs 增殖、迁移和侵袭,提示miR-93-5p 可能参与RA 的发生。
本研究结果显示:miR-93-5p 在RA 患者滑膜组织中低表达,ROCK2 在RA 患者滑膜组织中高表达。miR-93-5p mimics 转染后,RA-FLSs 中miR-93-5p 高表达,而ROCK2 低表达。双荧光素酶报告基因实验证实:miR-93-5p 靶向负调控ROCK2。ROCK2 是一种参与细胞黏附和收缩过程中细胞骨架重组的蛋白质[15]。ROCK2 参与RA 疾病的发生,表现为上调ROCK2 促进FLSs 增殖、迁移和侵袭[16-17]。本研究结果显示:过表达miR-93-5p 能显著降低RA-FLSs 增殖、迁移和侵袭能力,而过表达ROCK2 呈现相反效果。共转染miR-93-5p mimics 和OE-ROCK2 后,ROCK2 可以明显逆转单一过表达miR-93-5p 对RA-FLSs 的增殖、迁移和侵袭能力的抑制作用。提示过表达miR-93-5p 通过下调ROCK2 表达,从而降低RA-FLSs 的增殖、迁移和侵袭能力。
细胞的增殖、迁移和侵袭能力受多种机制调控[18]。陈盛烨等[19]认为:下调肾癌细胞中Ki-67、PCNA、MMP-2 和MMP-9 蛋白表达,可抑制细胞的增殖、迁移和侵袭。Ki-67 和PCNA 是细胞增殖标记蛋白,MMP-2 和MMP-9 是细胞迁移和侵袭标记蛋白,调控多种癌细胞的增殖、迁移和侵袭能力[20]。研究[21-22]显示:在癌细胞中降低ROCK2 表达水平可引起Ki-67 和MMP-2 表达下调,进而抑制癌细胞的迁移和侵袭。本研究进一步分析miR-93-5p 靶向ROCK2 表达影响RA-FLSs 增殖、迁移和侵袭能力机制的结果显示:过表达miR-93-5p 后RA-FLSs 中ROCK2、Ki-67、PCNA、MMP-2 和MMP-9 蛋白表达水平明显降低,而过表达ROCK2后,RA-FLSs 中ROCK2、Ki-67、PCNA、MMP-2和MMP-9 蛋白表达水平明显升高。提示ROCK2表达与细胞增殖、迁移和侵袭相关蛋白表达呈正相关关系。同时,过表达ROCK2 可以明显逆转过表达miR-93-5p 引起的ROCK2、Ki-67、PCNA、MMP-2 和MMP-9 蛋白表达水平降低。提示过表达miR-93-5p 可能通过靶向下调ROCK2 表达进而调控细胞增殖、迁移和侵袭等标记蛋白并影响RAFLSs 的增殖、迁移和侵袭能力。
综上所述,RA 患者滑膜组织中miR-93-5p 呈低表达,ROCK2 呈高表达,过表达miR-93-5p 可抑制RA-FLSs 增殖、迁移和侵袭,其机制可能与靶向下调ROCK2 表达有关。

