卵泡抑素样蛋白1 对阿霉素所致小鼠急性心肌损伤的改善作用及其机制
赵荫涛, 杨莹莹, 张相钦, 郑 璐, 徐亚威, 杨海波, 刘 源
(郑州大学第一附属医院心血管内科, 河南 郑州 450052)
心力衰竭是各种原发性和继发性心血管疾病发展至一定阶段的共同表现,不仅严重危害人类健康,并且给患者家庭和社会带来沉重的经济负担[1-2]。随着我国经济水平、环境和医疗卫生健康方面的发展,人口预期寿命明显延长,人口老年化也会伴随着罹患恶性肿瘤患者数量显著增加[3]。部分抗肿瘤药物具有心脏毒性,导致肿瘤患者承受治疗能力下降,严重影响抗肿瘤治疗的效果。阿霉素(doxorubicin,DOX)作为一种广谱高效的蒽醌类抗肿瘤药物,临床上广泛应用于多种抗肿瘤治疗。但DOX 可引起剂量依赖性的心脏毒性,导致进行性和不可逆性心脏损伤及充血性心力衰竭[4]。因此,DOX 的心脏毒性严重限制了其临床应用。目前普遍认为DOX 诱导心脏损伤的机制是由多因素组成的,其中一个因素为氧化应激反应[5-6]。
卵泡抑素样蛋白1(follistatin-like 1,FSTL1)也称为转化生长因子β(transforming growth factor-β,TGF-β)诱导基因蛋白,是一种在心脏代谢疾病中起关键作用的细胞外糖蛋白。研究[7-8]发现:FSTL1 可抑制小鼠心脏缺血性损伤和心肌细胞凋亡,并且具有降低射血分数以保护心力衰竭患者心室的有益效应。此外,血清中FSTL1 水平升高与脑钠肽(brain natriuretic peptide,BNP)释放密切相关,BNP 是心肌损伤的重要生物标记物[9]。目前尚未证实FSTL1 对DOX 诱导的心脏损伤是否具有治疗作用。本研究通过DOX 诱导建立小鼠心肌损伤动物模型和诱导心肌过表达FSTL1,探讨FSTL1 对DOX 相关心脏毒性的抑制作用,并阐明其可能的作用机制。
1 材料与方法
1.1 实验动物、主要试剂和仪器12 周雄性C57BL/6J 小鼠112 只,体质量25~28 g,购于中国医学科学院,动物使用许可证号:SYXK (沪)2020-0001。小鼠饲养于SPF 级动物房中独立送回风净化笼具内,自由进食进水,饮用水经高压处理,饲料经钴60 照射灭菌,温度维持于22 ℃~24 ℃,湿度为50%~60%,12 h 明暗交替。DOX购于无锡辉瑞制药有限公司,小鼠N 端BNP 前体(N-terminal pro-BNP,NT-proBNP)、肌钙蛋白T(cardiac troponin-T,cTn-T)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、超氧化物歧化酶(superoxide dismutase,SOD)、4-羟基壬烯醛(4-hydroxynonenal,4-HNE)和 丙 二 醛(malondialdehyde,MDA)试剂盒购于美国Sigma公司,小鼠15-F2t-isoprostane 试剂盒购于美国Cell Biolabs 公司,腺相关病毒 FSTL1 (AAV9-FSTL1)购于美国Vigene Bioscience 公司,TRIzol试剂购于美国Invitrogen 公司,BCA 试剂盒购于美国Thermo Fisher Scientific 公司。动物心脏超声仪由加拿大Visual Sonics 公司生产,酶标仪由芬兰Thermo 公司生产。本研究的动物实验方案已由郑州大学第一附属医院伦理委员会批准。
1.2 实验动物造模和分组采用单次腹腔内注射DOX 建立小鼠急性心肌损伤模型,小鼠按DOX 不同剂量(0、5、10、15 和20 mg·kg-1)分为5 组,每组8 只;按不同干预时间(0、0.5、1.0、2.0 和3.0 d)分为5 组,每组8 只。另取32 只小鼠随机分为生理盐水组、FSTL1 组、DOX 组和DOX+FSTL1 组。FSTL1 组和DOX+FSTL1 组通过小鼠尾静脉单次注射AAV9-FSTL1,剂量为5×1011个微粒;生理盐水组和DOX 组单次注射AAV9-β-gal作为阴性对照,剂量为5×1011个微粒[10-11]。AVV9注射4 周后,DOX 组和DOX+FSTL1 组小鼠单次腹腔内注射20 mg·kg-1DOX[12]。DOX 干预3 d 后进行血流动力学分析和心脏超声检测,然后腹腔内注射苯巴比妥钠150 mg·kg-1处死小鼠,留取血液和心脏标本以待后续实验。
1.3 各组小鼠心脏超声心动图和血流动力学指标测定1.5%~2.0%异氟烷持续吸入麻醉小鼠,待小鼠麻醉状态稳定后,心脏超声测定心率(heart rate,HR)、左心室舒张末期容积(left ventricular end-diastolic volume,LVEDV)、左心室射血分数(left ventricular ejection fraction,LVEF)和左心室短轴缩短率(left ventricular fraction shortening,LVFS)。于小鼠第7 和8 肋间暴露左心室,采用压力容积导管系统评估心功能,采用Labchart 软件分析各组小鼠左心室收缩压(left ventricular systolic pressure,LVSP)、左心室舒张压(left ventricular diastolic pressure,LVDP)、左心室内压最大上升速率(maximum rise rate of left ventricular pressure,+dP/dtmax)和左心室内压最大下降速率(maximum drop rate of left ventricular pressure,-dP/dtmax)。
1.4 酶 联 免 疫 吸 附 测 定(enzyme-linked immunosorbent assay,ELISA)法检测各组小鼠血清中TNF-α、NT-proBNP 和cTn-T 水平取小鼠血4 mL,于4 ℃、1 500 r·min-1离心10 min,去上清液,分装冻存于-80 ℃冰箱。采用ELISA 法检测各组小鼠血清中TNF-α、NT-proBNP 和cTn-T水平。
1.5 氧化应激试剂盒检测各组小鼠心肌组织中SOD 活性和MDA、4-HNE 及15-F2t-isoprostane 水平按照氧化应激试剂盒说明书操作,水溶性四唑盐1(water-soluble tetrazolium-1,WST-1)法检测各组小鼠心肌组织中SOD 活性,硫代巴比妥酸(thibabituric acid,TBA)法检测各组小鼠心肌组织中MDA 水平,ELISA 法检测各组小鼠心肌组织中4-HNE 和15-F2t-isoprostane 水平。
1.6 实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)法检测各组小鼠心肌组织中FSTL1 mRNA 表达水平提取小鼠心肌组织中总RNA,采用Superscript Ⅲ逆转录酶合成cDNA,RT-qPCR 法检测各组小鼠心肌组织中FSTL1 mRNA 表达水平,以GAPDH 为内参。FSTL1 上游引物:5′-GCCTATGCCTACTCCGTGAAGT-3′,下游引物:5′-GTGCTCTGTGCCTCTTCTTAGATCT-3′;GAPDH 上游引物:5′ -ACAGCAACAGGGTGGTGGAC-3′,下游引物:5′-TTTGAGGGTGCAGCGAACTT-3′。采用2-△△Ct法计算各组小鼠心肌组织中FSTL1 mRNA表达水平。
1.7 Western blotting 法检测各组小鼠心肌组织中核因子E2 相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)和FSTL1 蛋白表达水平冰冻小鼠心脏标本经RIPA 裂解液匀浆,离心后获取各组小鼠心肌组织总蛋白。按照说明书操作提取心肌组织总蛋白,测定蛋白表达水平。8%SDSPAGE 电泳分离蛋白溶液,将含蛋白质的凝胶转印至硝酸纤维膜上,加入特异性待测抗体(一抗),加入标记辣根过氧化物酶(horseradish peroxidase,HRPO)偶联的二抗,化学发光法显色,以GAPDH 为内参,采用Gene Tools 密度分析软件分析蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.8 统计学分析采用SPSS 19.0 统计软件进行统计学分析。各组小鼠HR、LVEDV、LVEF、LVFS、LVSP、LVDP、+dP/dtmax和-dP/dtmax,血清中TNF-α、NT-proBNP 和cTn-T 水平,心肌组织中SOD 活性和MDA、4-HNE 及15-F2tisoprostane 水平,FSTL1 mRNA 和蛋白表达水平及Nrf2 蛋白表达水平均符合正态分布,以¯x±s 表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组小鼠心脏超声心动图和血流动力学参数与生理盐水组比较,DOX组和DOX+FSTL1 组小鼠 LVEF 和 LVFS、LVSP、+dP/dtmax和-dP/dtmax降低 (P<0.05),HR、LVEDV 和LVDP 升高(P<0.05)。与DOX 组比较,DOX+FSTL1 组小鼠LVEF、+dP/dtmax和-dP/dtmax升高(P<0.05),LVEDV降低(P<0.05)。见表1和2。
表1 各组小鼠心脏超声心动图参数Tab.1 Echocardiographic parameters of mice in various groups(n=8,±s)

表1 各组小鼠心脏超声心动图参数Tab.1 Echocardiographic parameters of mice in various groups(n=8,±s)
*P<0.05 compared with normal saline group;△P<0.05 compared with DOX group.
Group Normal saline FSTL1 DOX DOX+FSTL1 FP HR (beat·min-1)424±27 438±31 491±45*476±40*52.32 0.021 LVFS (η/%)74.12±8.02 75.95±8.46 49.43±5.13*47.11±4.54*89.63 0.012 LVEDV (V/μL)52.78±5.12 53.29±4.84 68.34±5.05*62.44±4.83*△102.44 0.004 LVEF (η/%)95.73±10.10 94.36±9.84 75.45±9.69*84.37±8.67*△32.85 0.040
表2 各组大鼠心脏血流动力学参数Tab.2 Cardiac hemodynamic parameters of mice in various groups(n=8,±s)

表2 各组大鼠心脏血流动力学参数Tab.2 Cardiac hemodynamic parameters of mice in various groups(n=8,±s)
*P<0.05 compared with normal saline group;△P<0.05 compared with DOX group.
Group Normal saline FSTL1 DOX DOX+FSTL1 FP-dP/dtmax (mmHg·s-1)5 217.45±295.19 5 102.75±295.04 2 982.70±228.14*4 193.57±188.41*△98.74 0.009 LVSP (P/mmHg)122.31±12.85 132.47±12.56 90.89±13.93*94.76±14.36*74.52 0.017 LVDP (P/mmHg)6.07±1.81 5.97±1.50 11.55±2.66*9.79±2.03*65.12 0.029+dP/dtmax (mmHg·s-1)6 400.07±366.45 6 548.54±356.22 4 000.35±292.07*5 178.07±358.12*△118.17<0.01
2.2 各组小鼠血清中TNF-α、NT-proBNP和cTn-T水平与生理盐水组比较,DOX 组和DOX+FSTL1 组小鼠血清中TNF-α、NT-proBNP 和cTn-T 水平升高(P<0.05)。与DOX 组比较,DOX+FSTL1 组小鼠血清中NT-proBNP 和cTn-T水平降低(P<0.05),TNF-α 水平差异无统计学意义(P>0.05)。见表3。
表3 各组小鼠血清中TNF-α、NT-proBNP 和cTn-T 水平Tab.3 Levels of TNF-α,NT-proBNP,and cTn-T in serum of mice in various groups [n=8,±s,ρB/(ng·L-1)]

表3 各组小鼠血清中TNF-α、NT-proBNP 和cTn-T 水平Tab.3 Levels of TNF-α,NT-proBNP,and cTn-T in serum of mice in various groups [n=8,±s,ρB/(ng·L-1)]
*P<0.05 compared with normal saline group;△P<0.05 compared with DOX group.
Group Normal saline FSTL1 DOX DOX+FSTL1 FP cTn-T 88.82±9.34 82.29±10.16 301.14±27.64*143.89±18.56*△148.43<0.01 TNF-α 13.65±3.04 14.05±2.93 64.67±16.92*50.77±13.14*55.22 0.027 NT-proBNP 83.65±11.67 90.50±12.08 256.48±26.76*139.19±20.50*△139.06<0.01
2.3 各组小鼠心肌组织中 SOD 活性和MDA、4-HNE 及15-F2t-isoprostane 水平与生理盐水组比较,DOX 组小鼠心肌组织中SOD 活性降低(P<0.05),MDA、4-HNE 和15-F2t-isoprostane 水平升高(P<0.05);DOX+FSTL1 组小鼠心肌组织中15-F2t-isoprostane 水平升高(P<0.05)。与DOX 组比较,DOX+FSTL1 组小鼠心肌组织中SOD 活性升高(P<0.05),MDA、4-HNE 和15-F2t-isoprostane 水平降低(P<0.05)。见表4。
表4 各组小鼠心肌组织中SOD 活性和MAD、4-HNE 及15-F2t-isoprostane 水平Tab.4 Activities of SOD and levels of MAD, 4-HNE and 15-F2t-isoprostane in myocardium tissue of mice in various groups(n=8,±s)
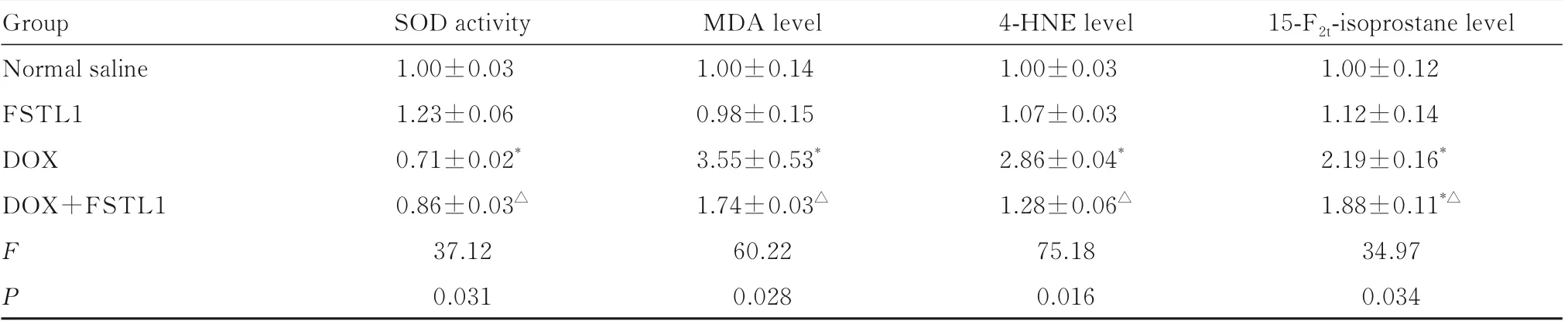
表4 各组小鼠心肌组织中SOD 活性和MAD、4-HNE 及15-F2t-isoprostane 水平Tab.4 Activities of SOD and levels of MAD, 4-HNE and 15-F2t-isoprostane in myocardium tissue of mice in various groups(n=8,±s)
*P<0.05 compared with normal saline group;△P<0.05 compared with DOX group.
Group Normal saline FSTL1 DOX DOX+FSTL1 FP 15-F2t-isoprostane level 1.00±0.12 1.12±0.14 2.19±0.16*1.88±0.11*△34.97 0.034 SOD activity 1.00±0.03 1.23±0.06 0.71±0.02*0.86±0.03△37.12 0.031 MDA level 1.00±0.14 0.98±0.15 3.55±0.53*1.74±0.03△60.22 0.028 4-HNE level 1.00±0.03 1.07±0.03 2.86±0.04*1.28±0.06△75.18 0.016
2.4 各组小鼠心肌组织中FSTL1 mRNA 表达水平与0 mg·kg-1DOX 组比较,随着DOX 剂量增加,其他各组小鼠心肌组织中FSTL1 mRNA 表达水平降低(P<0.05)。与DOX 0 d 组比较,随着DOX 应用时间延长,其他各组小鼠心肌组织中FSTL1 mRNA 表 达 水 平 降 低(P<0.05)。见表5 和6。
表5 不同剂量DOX 干预后各组小鼠心肌组织中FSTL1 mRNA 表达水平Tab.5 Expression levels of FSTL1 mRNA in myocardium tissue of mice in various groups after intervented with different doses of DOX (n=8,±s)

表5 不同剂量DOX 干预后各组小鼠心肌组织中FSTL1 mRNA 表达水平Tab.5 Expression levels of FSTL1 mRNA in myocardium tissue of mice in various groups after intervented with different doses of DOX (n=8,±s)
*P<0.05 compared with 0 mg·kg-1 DOX group.
Group DOX( mg·kg-1)FSTL1 mRNA 0 5 10 15 20 FP 1.00±0.17 0.78±0.05*0.57±0.11*0.49±0.13*0.38±0.10*64.12 0.028
表6 DOX 干预不同时间后各组小鼠心肌组织中FSTL1 mRNA 表达水平Tab.6 Expression levels of FSTL1 mRNA in myocardium tissue of mice in various groups after intervented with DOX for different time(n=8,±s)

表6 DOX 干预不同时间后各组小鼠心肌组织中FSTL1 mRNA 表达水平Tab.6 Expression levels of FSTL1 mRNA in myocardium tissue of mice in various groups after intervented with DOX for different time(n=8,±s)
*P<0.05 compared with DOX 0 d group.
Group DOX intervertion time FSTL1 mRNA 0 d 0.5 d 1.0 d 2.0 d 3.0 d FP 1.00±0.16 0.77±0.08*0.58±0.05*0.51±0.05*0.28±0.01*79.17 0.015
2.5 各组小鼠心肌组织中FSTL1 和Nrf2 蛋白表达水平与生理盐水组比较,DOX 组和DOX+FSTL1 组小鼠心肌组织中FSTL1 和Nrf2 蛋白表达水平降低(P<0.05)。与DOX 组比较,DOX+FSTL1 组小鼠心肌组织中FSTL1 和Nrf2 蛋白表达水平升高(P<0.05)。见图1 和表7。

图1 各组小鼠心肌组织中FSTL1(A)和Nrf2(B)蛋白表达电泳图Fig.1 Electrophoregrams of expressions of FSTL1(A) and Nrf2(B) proteins in myocardium tissue of mice in various groups
表7 各组小鼠心肌组织中FSTL1 和Nrf2 蛋白表达水平Tab.7 Expression levels of FSTL1 and Nrf2 proteins in myocardium tissue of mice in various groups(n=8,±s)

表7 各组小鼠心肌组织中FSTL1 和Nrf2 蛋白表达水平Tab.7 Expression levels of FSTL1 and Nrf2 proteins in myocardium tissue of mice in various groups(n=8,±s)
*P<0.05 compared with normal saline group;△P<0.05 compared with DOX group.
Group Normal saline FSTL1 DOX DOX+FSTL1 FP FSTL1 protein 0.92±0.12 1.12±0.08 0.39±0.04*0.72±0.09*△71.24 0.013 Nrf2 protein 0.81±0.06 0.92±0.15 0.44±0.08*0.77±0.12*△83.16 0.010
3 讨 论
DOX 是一种蒽醌类抗肿瘤化疗药物,临床用于各种实体肿瘤和血液系统肿瘤的治疗,但由于心脏毒性作用使其在临床上的应用受到一定的限制[13]。DOX 诱导的心肌病病理特征多与扩张型心肌病相似,包括心肌细胞凋亡、线粒体肿胀、心肌细胞能量代谢紊乱和活性氧(reactive oxygen species,ROS)聚集[14]。提示从抗氧化应激方面干预可能对改善DOX 心脏毒性有一定效果。本研究结果显示:FSTL1 对DOX 引起的小鼠心肌损伤有一定的保护作用,能够改善心脏的血流动力学指标,在机制上可能通过上调心肌组织中Nrf2 表达,以达到抑制氧化应激反应从而减轻心肌损伤的有益效应。
DOX 引发心肌病的发病机制目前尚未完全阐明,并且对于严重的DOX 诱导的心肌病,心脏移植可能是唯一的治愈方法[14]。因此,寻找一种有效的预防DOX 诱导心肌损伤的方法显得尤为重要。既往研究[15-17]发现:具有ROS 清除作用的部分天然物质可以抑制DOX 引起的急性心肌损伤。研究[18]证实:FSTL1 可以抑制压力负荷诱导的小鼠心脏肥厚,并可以缓解心肌缺血再灌注损伤。本研究结果显示:FSTL1 可以降低DOX 诱导的心肌损伤标记物和氧化应激标记物大量释放,提高小鼠心脏功能,提示FSTL1 可以作为预防和治疗DOX 相关心肌损伤的潜在药物。
DOX 导致急性心脏毒性的一个重要病理基础是急性炎症反应。研究[19]显示:抑制心肌炎症反应可以减轻DOX 相关的小鼠心肌细胞凋亡。本研究结果显示:FSTL1 无法降低DOX 导致的急性心肌损伤的炎症反应,表明FSTL1 可能不是通过调节心肌炎症反应保护心肌损伤。15-F2t-isoprostane属于异构前列腺素家族成员,被认为是反映机体氧化应激和脂质过氧化损伤强度的理想生化指标。本研究结果显示:急性心肌损伤模型小鼠心肌组织中15-F2t-isoprostane 水平升高,FSTL1 干预后小鼠心肌组织中15-F2t-isoprostane 水平降低,提示FSTL1可能通过抑制机体氧化应激反应,维持氧化和抗氧化平衡以达到保护心脏的作用。研究[20-22]显示:ROS 与DOX 相关的心肌损伤密切相关,而过氧化氢酶和金属硫蛋白可以改善DOX 导致的小鼠心脏毒性,提示氧化损伤在DOX 性心脏毒性发病机制中起到重要作用。DOX 代谢产物导致心肌细胞线粒体损伤和4-HNE 生成,其可以修饰线粒体多种活性蛋白[23]。本研究结果显示:FSTL1 可以改善被DOX 抑制的SOD 活性,并抑制心肌组织中MDA 和4-HNE 生成,这可能是FSTL1 保护心肌损伤的原因之一。Nrf2 是一种转录因子,在保护组织免受氧化损伤中起重要作用[24]。本研究结果显示:FSTL1 能恢复DOX 导致的心肌组织中Nrf2 低水平表达,提示FSTL1 可能通过激活Nrf2 信号通路以拮抗DOX 导致的急性心肌损伤。
综上所述,FSTL1 可以通过激活Nrf2 信号通路抑制心肌组织氧化损伤,保护DOX 引起的急性心脏毒性反应并改善心脏功能,为FSTL1 治疗DOX 诱导的心脏毒性提供新的研究方向。

