GRK5 过表达对P301S Tau 转基因小鼠抑郁样行为的影响及其机制
章天珍, 沈洪涛, 龚 正, 赵 斌, 王 岩
(1.广东医科大学附属医院神经病学研究所 广东省衰老相关心脑疾病重点实验室,广东 湛江524001;2.广东医科大学实验动物中心,广东 湛江 524001)
G 蛋白偶联受体(G protein-coupled receptor,GPCR)激酶5(GPCR kinases 5,GRK5)是一种丝氨酸/苏氨酸激酶,调节GPCR 的磷酸化和脱敏[1-2]。GRK5 与微管蛋白和α-突触核蛋白等非GPCR 底物磷酸化有关联[3-4]。GRK5 可参与多种疾病进展,如社交障碍、成瘾行为、精神分裂症和帕金森病等,也参与心血管疾病及癌症等疾病过程[5-12]。研究[13]显示:GRK5 与抑郁有关,参与抑郁的进展。Tau 蛋白改变不仅是阿尔茨海默病(Alzheimer’s disease,AD)的主要病理表现之一,亦与多种神经系统疾病有关[14]。研究[15]显示:Tau 蛋白沉积很可能是重度抑郁症的基础。P301S Tau 转基因小鼠以朊病毒蛋白启动子(prion protein promoter,Prnp)插入P301S 突变基因,表达人源Tau 蛋白,其表达量约为小鼠内源性Tau 蛋白表达量的5 倍。6 月龄P301S 小鼠可表现出空间认知障碍、后肢瘫痪和精神异常等行为学表现,病理上出现Tau 蛋白过度磷酸化、胶质细胞激活和突触损伤等[16-18]。研究[13]证实:Tau 增强N-甲基-D- 天冬氨酸受体 (N-methyl-D-aspartic acid receptor,NMDAR)依赖性去电位,NMDAR 是兴奋性谷氨酸盐神经递质的受体,在脑内广泛分布,与神经元突触传递、突触可塑性、学习记忆、疼痛和神经系统发育等密切相关。当NMDAR 功能低下时,其与重度抑郁症(major depressive disorder,MDD)的发病过程有关,表明携带P301S 突变基因的Tau 小鼠可能与抑郁表现有关,GRK5 对P301S Tau 转基因小鼠抑郁样行为的影响尚未完全阐明。本研究采用脑立体定位仪向小鼠海马区中注射GRK5 过表达病毒,探讨GRK5 对P301S Tau 转基因小鼠抑郁样行为的影响,进一步阐明其病理过程及其相关机制。
1 材料与方法
1.1 实验动物、病毒、主要试剂和仪器3 月龄P301S Tau 转基因小鼠购自江苏华创信诺医药科技有限公司,动物生产许可证号:SCXK(苏)2020-0009。饲养于室温(22±2)℃、相对湿度(60±5)%、12 h 光照/12 h 黑暗周期环境中,自由进食。GRK5 过表达腺相关病毒购自上海吉凯基因医学科技股份有限公司。BCA 试剂盒购自美国Novagen 公司,Western blotting 抗体稀释液和免疫荧光抗体稀释液购自上海碧云天生物技术有限公司。脑立体定位注射仪购自德国Neurostar 公司,OLYMPUS FV3000 激光扫描共聚焦显微镜购自日本Olympus 公司,悬尾仪和强迫游泳仪购自北京众实迪创科技发展有限公司。
1.2 动物分组和处理P301S Tau 转基因小鼠在标准环境下饲养,小鼠5 月龄时,采用5%水合氯醛麻醉 (0.9 mL·100 g-1),脱毛暴露头部皮肤,将小鼠固定于脑立体定位仪,剪开头皮暴露前后囟门,将前囟设为0 点,根据小鼠脑图谱设置注射参数,前后:-2.3 mm,左右:±2.0 mm,背腹:-1.8 mm。根据上述参数在颅骨相应位置钻孔。采用微量进样器给予小鼠每侧海马区1.5 μL病毒,注射速度0.1 μL·min-1。每次注射结束后,针头停留5 min。结束后,缝合伤口,将小鼠安放于温暖环境。17 只雄性P301S Tau 小鼠随机分为空白对照组(n=6,不进行任何处理)、阴性对照组(n=5,双侧海马区注射GRK5 阴性对照腺相关病毒)和过表达组(n=6,双侧海马区注射GRK5 腺相关病毒并插入目的基因空载体AAV-GRK5-EGFP-3FLAG)。
1.3 糖水偏好实验检测各组小鼠糖水偏好率实验开始前训练小鼠适应含糖饮水:每笼同时放置2 个水瓶,第一个24 h 内给予2 瓶1%蔗糖水;随后的24 h 内,给予1 瓶1 %蔗糖水和1 瓶纯水。实验开始后,首先禁食禁水24 h,再给予1 瓶1 %蔗糖水和1 瓶纯水,实验期间每6 h 更换水瓶位置,24 h 后,取2 瓶水称质量,计算各组小鼠糖水偏好率。小鼠糖水偏好率=糖水消耗量/总液体消耗量×100%。
1.4 悬尾实验(tail suspension test,TST)检测各组小鼠不动时间百分率将小鼠尾部距末端约2 cm 处采用胶带固定,倒悬于30 cm× 25 cm×25 cm 箱内的支架上,使小鼠头部距箱底约5 cm。悬挂时间为6 min,统计后4 min 内不动时间,计算各组小鼠不动时间百分率。不动时间百分率=4 min 内不动时间(min)/240 min×100%。
1.5 强迫游泳实验(forced swimming test,FST)检测各组小鼠不动时间百分率在直径15 cm,高50 cm 透明玻璃圆缸内,装入30 cm 深的清水,水温(23±2)℃,实验开始后将小鼠放入水中,测试持续时间为6 min,统计小鼠后4 min 内不动时间。实验结束后,将小鼠从水中移出,擦干水放回笼中,计算各组小鼠不动时间百分率。不动时间百分率=4 min 内不动时间(min)/240 min×100%。
1.6 Western blotting 法检测各组小鼠海马组织中神经功能相关蛋白表达水平取各组小鼠半脑海马组织,加入裂解液进行研磨,4 ℃离心提取蛋白,采用BCA 法测定各样品蛋白浓度。蛋白样品加入Loading Buffer 后,100 ℃煮沸5 min,上样量为30 μg。60 V 电压电泳直至样品到达分离胶,调节电压至100 V 电泳直至溴酚蓝在分离胶底部。200 V 恒压转膜2 h 后,5%脱脂牛奶封闭1 h,一抗4 ℃孵育过夜,GRK5(1∶200),小胶质细胞标记物抗体(ionized calciumbiding adapter molecule 1,IBA1)(1∶500),胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)(1∶1 000),突触小泡蛋白(synatotagmin,SYN)(1∶1 000),突触后致密蛋白95(postsynaptic density 95,PSD95)(1∶1 000),神经元特异性核蛋白(neuronspecific nuclear protein,NeuN)(1∶1 000),Tau T205(1∶1 000),β-actin(1∶1 000),TBST 缓冲液洗涤3 次,每次10 min;室温下孵育二抗羊抗鼠或羊抗兔(1∶10 000)1 h;TBST 缓冲液洗涤3 次,每次10 min,ECL 发光液使条带显影。以β-actin 为内参,采用Image J 软件分析蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.7 免疫荧光染色检测各组小鼠海马组织中IBA1、NeuN 和GFAP 表达情况小鼠麻醉后,4%多聚甲醛灌注取脑组织,采用10%、20%和30%蔗糖梯度脱水,OCT 包埋剂包埋脑组织,存放于-80℃环境中。采用冰冻切片机切10 μm 薄片,PBS 缓冲液室温下洗涤3 次,每次5 min,4%多聚甲醛固定20 min,PBS 缓冲液室温下洗涤3 次,每次5 min,通透液作用10 min,PBS 缓冲液室温下洗涤3 次,每次5 min,10%山羊血清室温下封闭30 min,孵育一抗IBA1(1∶200),GFAP(1∶200),NeuN(1∶500),4 ℃过夜,PBS 缓冲液室温下洗涤3 次,每次5 min,室温孵育荧光二抗1 h,DAPI染色3 min。采用OLYMPUS FV3000 共聚焦显微镜拍摄荧光图像并记录各组小鼠海马组织中IBA1、NeuN 和GFAP 表达情况。
1.8 统计学分析采用GraphPad Prism6.0 统计软件进行统计学分析。各组小鼠糖水偏好率、不动时间百分率、海马组织中神经功能相关蛋白GRK5、IBA1、GFAP、SYN、PSD95、NeuN 和 Tau T205 蛋白表达水平均符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用Tukey 事后检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠糖水偏好率和不动时间百分率糖水偏好实验检测结果显示:与空白对照组比较,阴性对照组小鼠糖水偏好率差异无统计学意义(P>0.05)。与空白对照组和阴性对照组比较,过表达组小鼠糖水偏好率升高(P<0.05)。TST 和FST检测结果显示:与空白对照组比较,阴性对照组小鼠不动时间百分率差异无统计学意义(P>0.05)。与空白对照组和阴性对照组比较,过表达组小鼠不动时间百分率升高(P<0.05)。见表1。
表1 各组小鼠糖水偏好率和不动时间百分率Tab.1 Sugar-water perference rate and percentages of immobility time of mice in various groups (±s,η/%)

表1 各组小鼠糖水偏好率和不动时间百分率Tab.1 Sugar-water perference rate and percentages of immobility time of mice in various groups (±s,η/%)
*P<0.05 compared with blank control group;ΔP<0.05 compared with negative control group.
Group Blank control Negative control Over-expression Percentage of immobility time in TST 14.70±13.46 12.64±6.07 44.03±16.17*Δ n655 Sugar-water perference rate 43.40±19.88 38.56±13.21 78.65±5.47*Δ Percentage of immobility time in FST 13.65±11.77 15.46±3.85 46.46±16.83*Δ
2.2 各组小鼠海马组织中神经功能相关蛋白表达水平Western blotting 法检测结果显示:与空白对照组和阴性对照组比较,过表达组小鼠海马组织中GRK5、Tau T205 和IBA1 蛋白表达水平升高(P<0.05),SYN 蛋白表达水平降低(P<0.05),GFAP、NeuN 和PSD95 蛋白表达水平差异无统计学意义(P>0.05)。见图1 和表2。

图1 各组小鼠海马组织神经功能相关蛋白表达电泳图Fig.1 Electrophoregram of expressions of neurological funcion-related-proteins in hippocampus tissue of mice in various groups
表2 各组小鼠海马组织中GRK5、Tau T205、IBA1、GFAP、NeuN、PSD95 和SYN 蛋白表达水平Tab.2 Expression levels of GRK5, Tau T205, IBA1, GFAP, NeuN, PSD95, and SYN proteins in hippocampus tissue of mice in various groups[n=3,±s,ρB/(g·L-1)]

表2 各组小鼠海马组织中GRK5、Tau T205、IBA1、GFAP、NeuN、PSD95 和SYN 蛋白表达水平Tab.2 Expression levels of GRK5, Tau T205, IBA1, GFAP, NeuN, PSD95, and SYN proteins in hippocampus tissue of mice in various groups[n=3,±s,ρB/(g·L-1)]
*P<0.05 compared with blank control group;ΔP<0.05 compared with negative control group.
Group Blank control Negative control Over-expression SYN 1.05±0.07 1.05±0.08 0.74±0.10*Δ GRK5 0.98±0.02 1.25±0.30 2.56±0.14*Δ Tau T205 1.08±0.10 1.24±0.04 1.54±0.11*Δ IBA1 1.07±0.13 1.29±0.12 2.03±0.27*Δ GFAP 1.05±0.05 1.14±0.08 1.05±0.10 NeuN 0.85±0.22 0.69±0.09 0.57±0.13 PSD95 1.02±0.03 1.12±0.09 1.06±0.10
2.3 各组小鼠海马组织中增强绿色荧光蛋白(enhanced green fluorescence protein,EGFP)表达免疫荧光染色检测结果显示:与空白对照组比较,阴性对照组和过表达组小鼠海马组织中均有EGFP 表达,表明病毒成功注射至海马区。脑细胞中EGFP 主要与NeuN 发生共定位,而小胶质细胞和星形胶质细胞中几乎未观察到EGFP,表明EGFP 主要在神经元细胞核中表达。与阴性对照组比较,过表达组小鼠海马组织中EGFP 表达更集中于神经元的细胞核中。见图2。

图2 各组小鼠海马组织中EGFP 和NeuN 表达(免疫荧光,×10)Fig.2 Expressions of EGFP and NeuN in hippocampus tissue of mice in various groups(Immunofluorescence,×10)
2.4 GRK5 过表达后各组小鼠海马组织中小胶质细胞数和星形胶质细胞数与空白对照组和阴性对照组比较,过表达组小鼠海马组织中小胶质细胞数增加(P<0.05),星形胶质细胞数差异无统计学意义(P>0.05),表明GRK5 主要影响小胶质细胞的激活。见图3 和4。
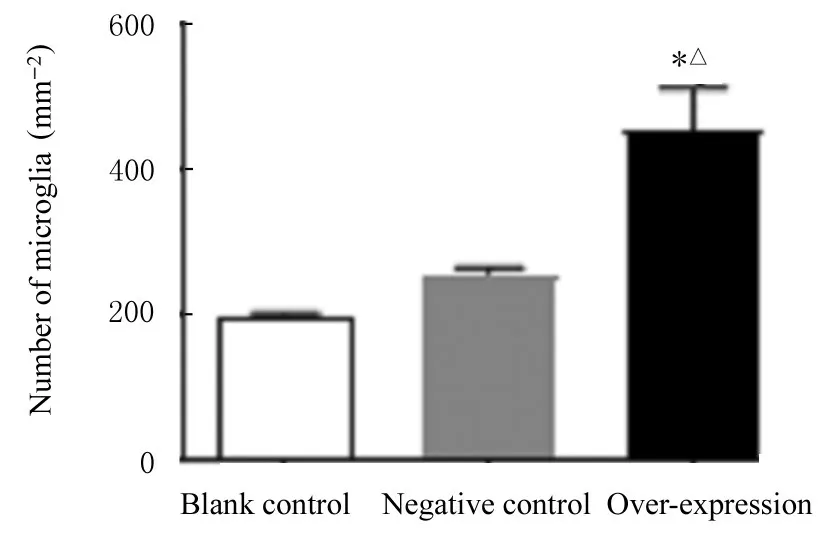
图3 各组小鼠海马组织中小胶质细胞数Fig.3 Number of microglia in hippocampus tissue of mice in various groups
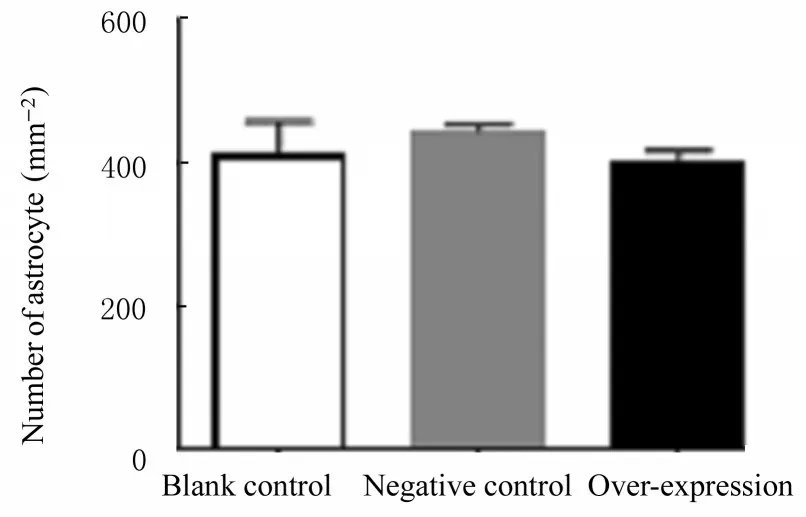
图4 各组小鼠海马组织中星形胶质细胞数Fig.4 Number of astrocytes in hippocampus tissue of mice in various groups
3 讨 论
抑郁症是目前常见的心理疾病,是以持久的情绪低落、思维迟缓、认知功能损害、意志活动减退和躯体症状为主要临床特征的一类心境障碍[19]。其病因不清,发病机制复杂,涉及基因遗传、人格和环境等多种因素,目前研究的机制有炎症反应假说、单胺类神经递质及其受体假说、谷氨酸及其受体假说、下丘脑-垂体-肾上腺(hypothalamicpituitary-adrenal,HPA)轴功能失调假说、神经营养因子假说和多因素综合等[20]。研究[13]显示:GRK5 基因与抑郁筛查量表患者健康问卷(patient health questionnaire,PHQ)评分显著相关,通过对具有社会经济特性的汤森德剥夺指数(townsend deprivation index,TDI)组成的数据进行分析并以TDI 为环境因子进行全基因组基因-环境相互作用研究,确定了GRK5 为抑郁的候选基因之一。研究[5]显示:在旷场试验中,GRK5 缺陷小鼠在中心区的时间较其野生型同窝小鼠延长,但在TST 和FST 中表现正常,表明GRK5 缺陷小鼠可表现出焦虑样行为。
本研究结果显示:与空白对照组和阴性对照组比较,过表达组小鼠海马组织中GRK5 和IBA1 蛋白表达水平升高;与空白对照组比较,阴性对照组和过表达组小鼠海马组织均有EGFP 表达,表明在P301S Tau 小鼠海马组织中实现了GRK5 的过表达,提示GRK5 过表达的小鼠模型构建成功。
P301S Tau 小鼠GRK5 过表达后,在无压迫环境中糖水偏好率升高,在TST 和FST 压迫环境中小鼠不动时间百分率升高,表现为抑郁样行为。这种矛盾的行为学表现可能与环境有关,表明GRK5可能是抑郁的风险基因,这项结果与YE 等[13]研究结果一致,该风险基因GRK5 可以与环境等因素协同作用诱导抑郁样行为的发生。
抑郁症发病与海马组织体积减小、神经元衰亡和丢失及突触和神经发生减少等神经可塑性改变有关[21]。SYN 缺失可能导致突触间信息传递功能缺损,进而导致神经元突触可塑性受损,引发抑郁症等多种认知及情感相关精神障碍[22]。研究[15,23]显示:Tau 蛋白积累与抑郁的发生有关联。本研究结果显示:GRK5 过表达后,P301S Tau 小鼠海马组织中小胶质细胞明显增生,Tau T205 蛋白表达水平升高,提示抑郁症发病机制可能与海马组织和Tau 蛋白有关联。
GRK5 是一种多功能蛋白,在不同类型的细胞中均有表达,在不同的信号传导过程中GRK5 在亚细胞器中表达存在差异。GRK5 可调节GPCR,也可与非GPCR 相关蛋白和DNA 自身相互作用[24]。心肌细胞在促肥大刺激条件下,GRK5 易位至细胞核,并且在核内积累,促进活化的T 细胞核内因子(nuclear factor of activated T-cells,NFAT)活性,从而介导核内信号转导[25]。GRK5 在神经元中过表达可负性调控5-羟色胺受体介导的细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)通路激活,以介导核内信号的传导[9]。本研究结果显示:过表达的GRK5 蛋白主要出现在神经元核内,表明GRK5 具有入核功能,提示模型小鼠抑郁样行为表现可能与GRK5 在神经元核内积累有关联。
综上所述,GRK5 过表达P301S Tau 小鼠海马组织中小胶质细胞增生,SYN 和NeuN 蛋白表达减少等病理改变可能与GRK5 入核并在核中表达增加有关联,从而诱导抑郁样行为。

