Cav3.2 基因在盆底电刺激治疗小鼠压力性尿失禁中的作用及其机制
刘剑锋, 汤剑明, 阳 莲, 张舒飞, 洪 莉
(武汉大学人民医院妇产科,湖北 武汉 430060)
女 性 压 力 性 尿 失 禁 (stress urinary incontinence,SUI)是指女性患者腹压升高时尿液不自主外漏,多见于经产妇和高龄女性患者,其发病率逐年升高,严重影响了患者的生活质量和心理健康[1-2]。SUI 的治疗方法主要分为手术和非手术治疗。对于轻中度SUI 患者和无法接受手术治疗的患者多采用行为疗法、盆底肌锻炼和药物治疗等非手术治疗,其中盆底电刺激(pelvic floor electrical stimulation,PES)治疗作为非手术治疗方法之一,能有效防治SUI,但其治疗相关机制尚未完全阐明[3-4]。研究[5-6]发现:盆底支持结构细胞外基质(extracellular matrix,ECM)重构是SUI 的主要发病机制,包含Ⅰ型胶原(collagen type Ⅰ,ColⅠ)、Ⅲ型胶原(collagen type Ⅲ,Col Ⅲ)和细胞内Ca2+浓度等一系列变化。T 型钙通道是一种电压依赖型Ca2+通道,在盆底组织中广泛分布,在神经电生理、激素分泌和平滑肌收缩等生理过程中发挥重要作用。T 型钙通道蛋白包括 Cav 3.1、Cav 3.2 和Cav 3.3,本课题组前期研究[7-8]已经证实:在小鼠成纤维细胞中以Cav 3.2 为主,且Cav 3.2 参与了PES 治疗并升高细胞内Ca2+浓度。本研究在野生型和Cav 3.2 基因敲除型小鼠SUI 模型上观察电刺激产生的盆底胶原水平变化及其与Cav 3.2 基因的作用关系,进一步探讨PES 治疗SUI 的作用及其相关机制,为临床SUI 治疗提供依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器选取8~10 周、体质量17~22 g、雌性、未生育的C57BL/6 小鼠30 只,由武汉大学人民医院实验动物中心提供,动物生产许可证号:SCXK(湘)2019-0004,小鼠Cav 3.2 基因敲除委托北京维通利华实验动物技术有限公司进行,购自美国Jackson 实验室(编号:013707)。0.25% 胰蛋白酶、磷酸盐(phosphate buffer solution,PBS)缓冲液和胎牛血清(fetal bovine serum,FBS)[翌圣生物科技(上海)股份有限公司],青-链霉素、兔抗小鼠整合素β1、钙蛋白酶2、ColⅠ和ColⅢ多克隆抗体(美国 Santa 公司),山羊抗兔多克隆抗体(英国Abcam 公司)。钢制砝码(上海众渊公司),超净工作台、25 cm²细胞培养瓶、6 孔细胞培养板和CO2培养箱(香港Healforce 公司),离心机(德国Eppendorf 公司)。
1.2 实验动物造模和分组采用4%异氟烷气体吸入麻醉小鼠,采用校正的6-Fr 弗利导尿管确保尖端球囊密闭性良好,石蜡油润滑并将其缓慢插入小鼠阴道,采用 5 /0 丝线收缩阴道周围皮肤将导尿管固定,向球囊内注入0.3 mL 生理盐水扩张阴道,导尿管末端固定于手术台缘高度的定滑轮,滑轮末端悬挂钢制砝码30 g 牵引1 h 后撤去牵引球囊,放水后拔出导尿管,拆除缝线,继续常规饲养[9-11]。根据干预措施将30 只C57BL/6 小鼠分为对照组[未进行阴道扩张(vaginal dilatation,VD)造模]、VD 组(VD 造模)和VD+PES 组(VD 造模联合PES)。每组各10 只小鼠,均按随机原则分组。根据基因型和干预措施将小鼠分为WT-VD 组(野生型VD 造模)、WT-VD+PES 组(野生型VD 造模联合PES)、KO-VD 组(Cav 3.2 敲除型VD 造模)和KO-VD+PES 组(Cav 3.2 敲除型VD 造模联合PES)。
1.3 小鼠PES 实验异氟烷气体麻醉小鼠后,采用直径 3 mm 的针灸针自制电刺激针电极,放置并固定在小鼠阴道内,连接 Powerlab 35 生理信号采集系统,并采用 LabChart7.2 软件设置参数:恒流 2 mA,频率 50 Hz,脉冲刺激,每日1 次,每次15 min,连续刺激7 d[12]。
1.4 Masson 染色观察各组小鼠尿道和阴道前壁组织中ColⅠ和ColⅢ胶原纤维沉积情况和胶原纤维表达水平颈椎脱臼处死并取小鼠尿道和阴道前壁组织,4%多聚甲醛固定后石蜡包埋切片。切片脱蜡至水,依次采用自来水和蒸馏水洗涤,苏木精染液染核10 min,清洗后再采用Masson 丽春红酸性复红液染色10 min,0.2%冰醋酸水溶液浸洗片刻。95%酒精和无水酒精脱水各5 min,二甲苯透明5 min,最后用中性胶封片。待封片吹干后于光学显微镜下观察各小组小鼠尿道和阴道前壁组织中ColⅠ和ColⅢ胶原纤维沉积情况。胶原纤维呈蓝色,肌纤维胞质呈红色,细胞核呈蓝褐色。采用Image-Pro Plus 6.0 图像分析仪测量系统,选择HSI 模式(将吸管颜色设定为黄色),设置H 117~200、S 0~255 和I 180~240 参数。测量各组小鼠胶原纤维阳性表达区域总积分吸光度(A)值,每张切片取 5 个视野(上、下、左、右和中央),定量检测 Masson 染色切片的积分A值,计算平均A 值,以平均A 值代表各组小鼠ColⅠ和ColⅢ胶原纤维表达水平。平均A值=总积分A 值/测量区域总面积。
1.5 小鼠尿动力学参数测定异氟烷气体麻醉小鼠后,暴露膀胱并将硬膜外导管插入膀胱并缝合固定于导管上,置管后第2 天进行尿动力学检测。将膀胱导管分别连接至注射泵和压力转换器上,计算机收集转换器信号并进行数据处理。小鼠仰卧位,排空膀胱,1 mL·min-1注入生理盐水,当尿道口出现第1 滴尿液时的注入量为膀胱最大容积(maximum bladder capacity,MBC),此时膀胱内压力记录为漏尿点压力(leakage point pressure,LPP)。各测量 3 次取平均值。
1.6 Western blotting 法检测各组小鼠尿道和阴道前壁组织中整合素β1、钙蛋白酶2、ColⅠ及ColⅢ蛋白表达水平颈椎脱臼处死并取小鼠尿道和阴道前壁组织,液氮磨碎组织并加入裂解液冰上裂解30 min,超声1 min,充分裂解后4 ℃、12 000 r·min-1离心15 min,取上清液,采用 BCA 蛋白浓度测定试剂盒检测样品蛋白浓度。10% SDS-PAGE 凝胶电泳分离蛋白质,采用全湿电转移法将蛋白质分子转移至PVDF 膜上,TBST 溶液洗涤PVDF膜1次5 min,室温下5%脱脂奶粉封闭1 h。分别采用一抗孵育,整合素1 (1 ∶1 000)、钙蛋白酶2(1∶1 000)、ColⅠ(1∶1 000)、ColⅢ(1∶1 000)和内参 GAPDH (1∶1 000),4 ℃摇床过夜。次日TBST 溶液洗膜 3 次,每次10 min,置入带有羊抗兔荧光标记的相应二抗稀释液 (1∶1 000)室温下避光孵育1 h,TBST 溶液洗膜3 次,每次5 min,Odyssey 双色红外激光成像系统扫描收集荧光信号,获取并分析蛋白条带。实验独立重复 3 次,采用Image J 软件分析蛋白条带灰度值,以GAPDH为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.7 统计学分析采用SPSS 22.0 统计软件进行统计学分析。各组小鼠尿道和阴道前壁组织中ColⅠ及ColⅢ胶原纤维表达水平,MBC 和LPP,整合素β1、钙蛋白酶2、ColⅠ和ColⅢ蛋白表达水平均符合正态分布,以±s 表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用 LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组小鼠尿道和阴道前壁组织中COL Ⅰ及COL Ⅲ胶原纤维表达水平与对照组比较,VD 组小鼠尿道和阴道前壁组织中Col Ⅰ及Col Ⅲ胶原纤维表达水平差异无统计学意义(P>0.05)。与VD 组比较,VD+PES 组小鼠尿道和阴道前壁组织中Col Ⅰ及Col Ⅲ胶原纤维表达水平明显升高(P<0.01)。与WT-VD 组比较,WT-VD+PES 组小鼠尿道和阴道前壁组织中Col Ⅰ及Col Ⅲ胶原纤维表达水平明显升高(P<0.01)。与WT-VD+PES组比较,KO-VD 组和KO-VD+PES 组小鼠尿道和阴道前壁组织中Col Ⅰ及Col Ⅲ胶原纤维表达水平明显降低(P<0.01);KO-VD 组和KO-VD+PES 组小鼠尿道和阴道前壁组织中Col Ⅰ及Col Ⅲ胶原纤维表达水平差异无统计学意义(P>0.05)。见图1~3。
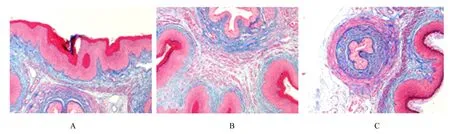
图1 Masson 染色检测各组小鼠尿道和阴道前壁组织中Col Ⅰ及Col Ⅲ胶原纤维沉积情况(×200)Fig.1 Deposition of Col Ⅰ and Col Ⅲ collagen in urethral and anterior vaginal wall tissue of mice in various groups detected by Masson staining(×200)
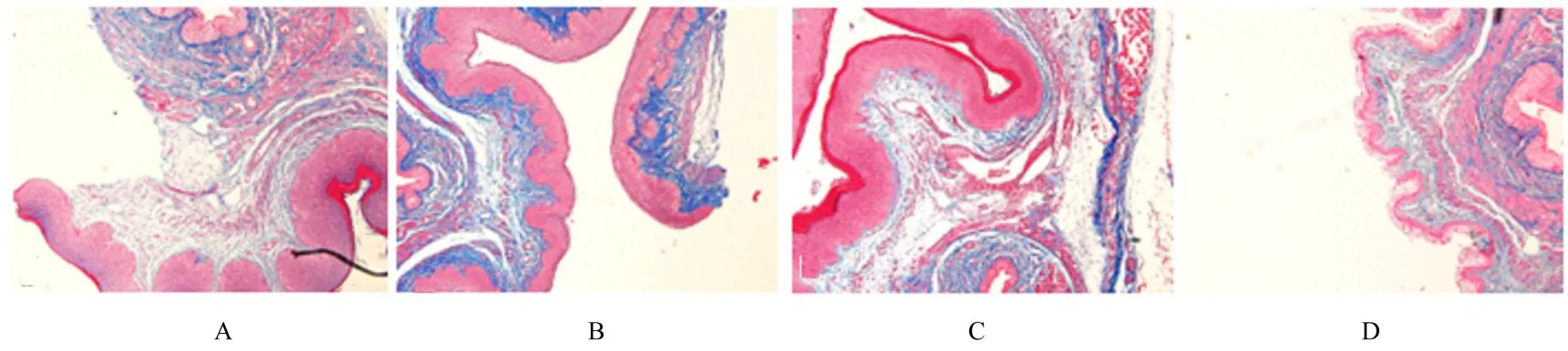
图2 Masson 染色检测各组小鼠尿道和阴道前壁组织中Col Ⅰ及Col Ⅲ胶原纤维表达(×200)Fig.2 Expressions of Col Ⅰ and Col Ⅲ collagen fibers in urethral and anterior vaginal wall tissue of mice in various groups detected by Masson staining(×200)
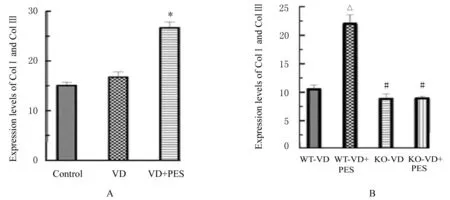
图3 各组小鼠尿道和阴道前壁组织中ColⅠ及Col Ⅲ胶原纤维表达水平Fig.3 Expression levels of Col Ⅰ and Col Ⅲ collagen fibers in urethral and anterior vaginal wall tissue of mice in various groups
2.2 各组小鼠尿动力学功能参数与对照组比较,VD 组小鼠MBC 和LPP 均降低(P<0.05)。与VD 组比较,VD+PES 组小鼠MBC 和LPP 均升高(P<0.05)。见表1。
表1 各组小鼠MBC 和LPPTab.1 MBC and LPP of mice in various groups(n=10,±s)

表1 各组小鼠MBC 和LPPTab.1 MBC and LPP of mice in various groups(n=10,±s)
*P<0.05 compared with control group;△P<0.05 compared with VD group.
LPP(P/cmH2O)38.37±2.62 24.83±3.93*29.33±3.25△Group Control VD VD+PES MBC(V/mL)0.11±0.01 0.07±0.01*0.08±0.01△
2.3 各组小鼠尿道和阴道前壁组织中ColⅠ及ColⅢ蛋白表达水平与对照组比较,VD 组小鼠尿道和阴道前壁组织中Col Ⅰ及Col Ⅲ蛋白表达水平差异均无统计学意义(P>0.05)。与VD 组比较,VD+PES 组小鼠尿道和阴道前壁组织中Col Ⅰ及Col Ⅲ蛋白表达水平均明显升高(P<0.01)。与WT-VD组比较,WT-VD+PES 组小鼠尿道和阴道前壁组织中Col Ⅰ及Col Ⅲ蛋白表达水平明显升高(P<0.01)。与WT-VD+PES 组比较,KO-VD 组和KO-VD+PES 组小鼠尿道和阴道前壁组织中ColⅠ及Col Ⅲ蛋白表达水平明显降低(P<0.01)。KO-VD 组和KO-VD+PES 组小鼠尿道和阴道前壁组织中Col Ⅰ及Col Ⅲ蛋白表达水平差异均无统计学意义(P>0.05)。见图4 和5。
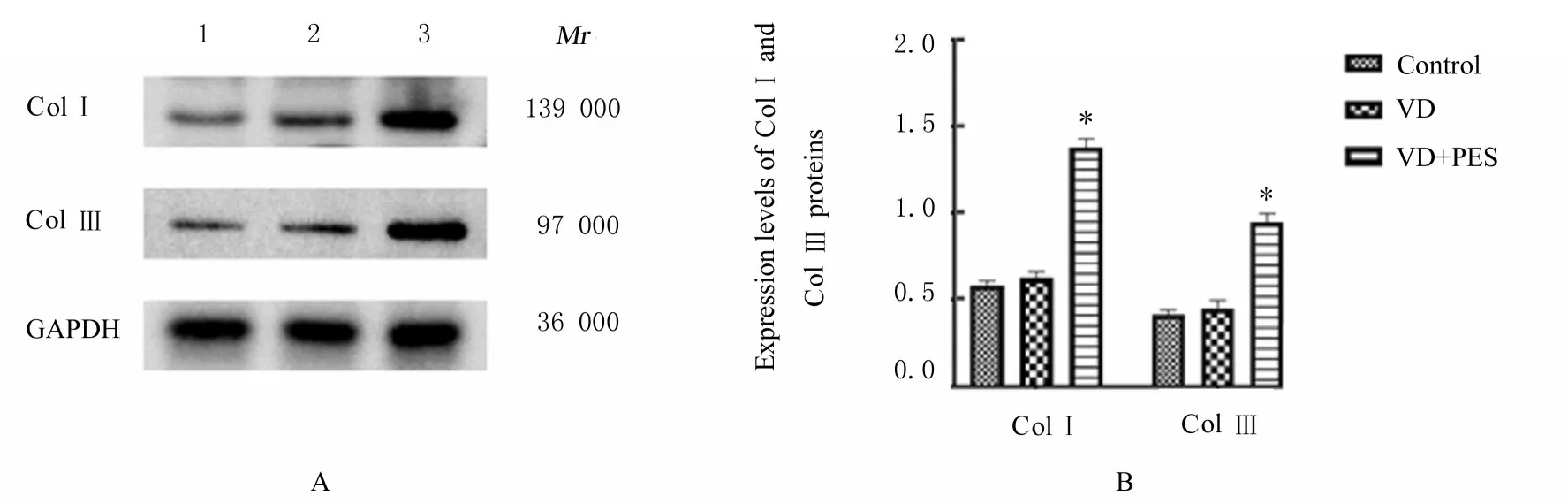
图4 Western blotting 法检测各组小鼠尿道和阴道前壁组织中ColⅠ和Col Ⅲ蛋白表达电泳图(A)和直条图(B)Fig.4 Electrophoregram(A) and histograms(B) of expressions of Col Ⅰ and Col Ⅲ proteins in urethral and anterior vaginal wall tissue of mice in various groups detected by Western blotting method
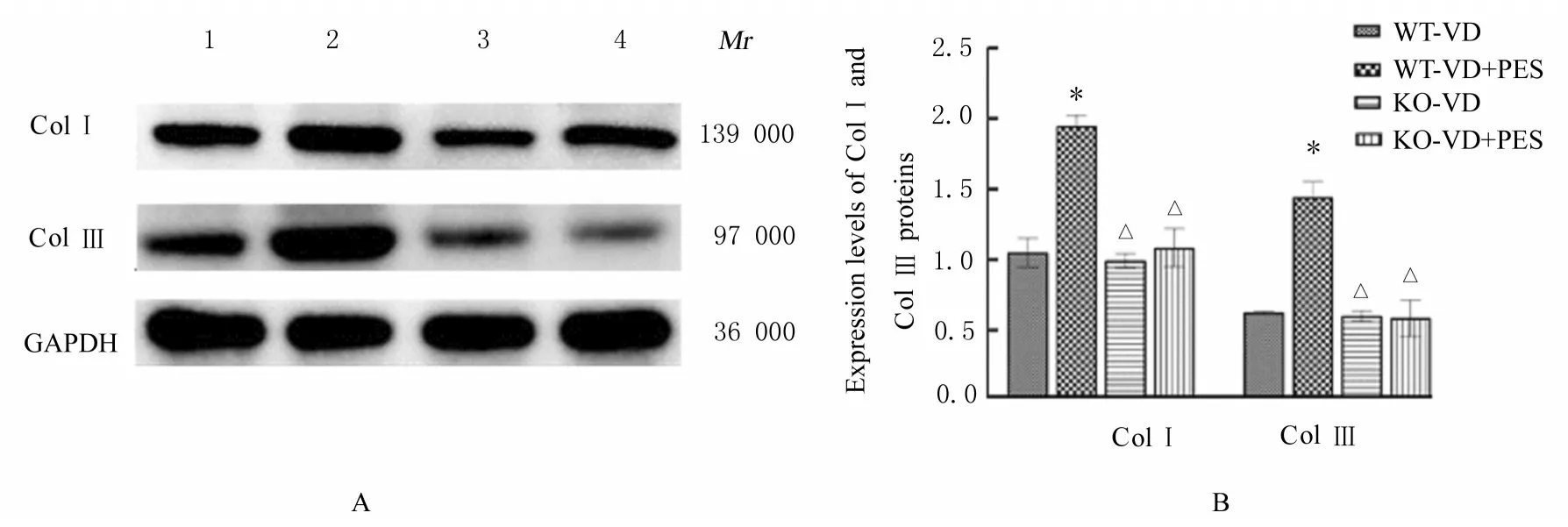
图5 Western blotting 法检测各组小鼠尿道和阴道前壁组织中ColⅠ及Col Ⅲ蛋白表达电泳图(A)和直条图(B)Fig.5 Electrophoregram(A) and histogram(B) of expressions of Col Ⅰ and Col Ⅲ proteins in urethral and anterior vaginal wall tissue of mice in various groups detected by Western blotting method
2.4 各组小鼠尿道和阴道前壁组织中整合素β1 和钙蛋白酶2 蛋白表达水平与WT-VD 组比较,WT-VD+PES 组小鼠尿道和阴道前壁组织中整合素β1 及钙蛋白酶2 蛋白表达水平明显升高(P<0.01)。KO-VD 组和KO-VD+PES 组小鼠尿道及阴道前壁组织中整合素β1 和钙蛋白酶2 蛋白表达水平比较差异均无统计学意义(P>0.05)。见图6 和7。
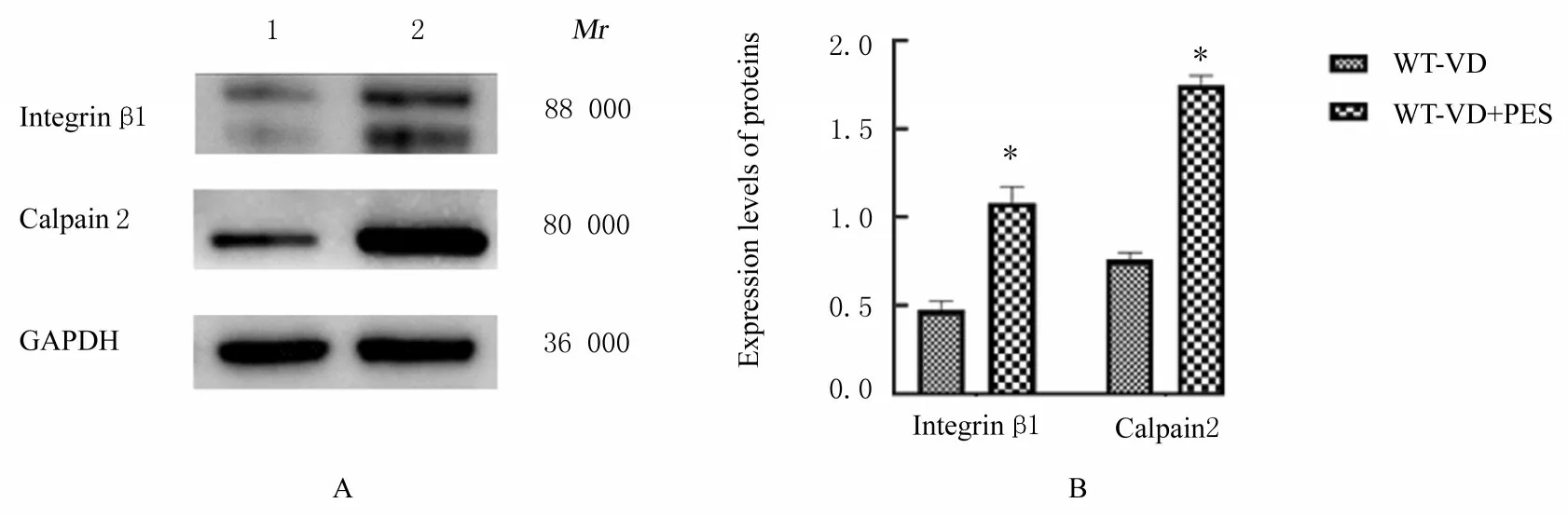
图6 Western blotting 法检测各组小鼠尿道和阴道前壁组织中整合素β 1 及钙蛋白酶2 蛋白表达电泳图(A)和直条图(B)Fig.6 Electrophoregram(A) and histogram(B) of expressions of integrin β 1 and calpain 2 proteins in urethral and anterior vaginal wall tissue of mice in various groups detected by Western blotting method
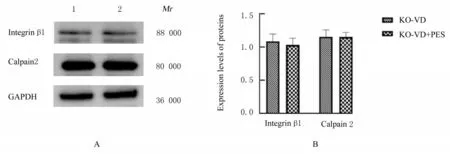
图7 Western blotting 法检测各组小鼠尿道和阴道前壁组织中整合素β 1 及钙蛋白酶2 蛋白表达电泳图(A)和直条图(B)Fig.7 Electrophoregram(A) and histogram(B) of expressions of integrin β 1 and calpain 2 proteins in urethral and anterior vaginal wall tissue of mice in various groups detected by Western blotting method
3 讨 论
随着人口老龄化和人们对生活质量要求的提高,女性SUI 受到广泛关注,衰老、重体力劳动和分娩对SUI 的发生有较大影响,其中阴道分娩是 SUI 最主要的危险因素,在妊娠和阴道分娩过程中盆底神经、肌肉和结缔支持组织等发生不可逆的损伤[13-14]。盆底包括骨盆结构、盆底肌群和神经血管等软组织,各组织在结构和功能上共同构成了复杂的盆底结构,在维持子宫、膀胱和直肠等盆腔器官处于正常位置起支撑作用。分娩过程中阴道和盆底组织肌肉等受到牵拉和挤压从而产生了机械牵拉及组织缺氧缺血等一系列损伤,造成了盆底支持功能减弱,从而形成SUI[15-16]。
本研究结果显示:与对照组比较,VD 组小鼠MBC 和LPP 均降低,表明SUI 模型制备成功,进一步证实阴道模拟分娩造成了盆底组织的损伤和尿动力学功能的影响。经PES 电刺激干预后,小鼠的MBC、LPP 和盆底组织中ColⅠ及ColⅢ胶原纤维和蛋白表达水平均升高,证实PES 治疗在SUI 及盆底损伤中起保护作用。
研究[12]显示:在SUI 发生过程中,盆底支持结构ECM 重构是SUI 的重要发病机制。本课题组前期研究[7-8]发现:Cav 3.2 T 型Ca2+通道在小鼠成纤维细胞的兴奋等电生理过程中起重要作用。本研究结果显示:Cav 3.2 基因敲除后,KO-VD 组和KO-VD+PES 组小鼠尿道和阴道前壁组织中 ColⅠ及ColⅢ胶原纤维和蛋白表达水平比较差异无统计学意义;与WT-VD 组比较,WT-VD+PES 组小鼠尿道和阴道前壁组织中 ColⅠ及ColⅢ胶原纤维和蛋白表达水平明显升高,表明Cav 3.2 基因缺失阻断了PES 的治疗作用,也一定程度提示Cav 3.2在PES 治疗方面的重要作用。
研究[17-18]发现:SUI 患者盆底组织细胞中Ca2+水平降低影响其与钙蛋白酶2 结合,进而抑制其活性,影响胶原合成,造成盆底组织张力下降。钙蛋白酶2 可激活整合素β1,从而增强胶原合成作用[8,19]。本研究结果显示:与WT-VD 组比较,WT-VD+PES 组小鼠尿道和阴道前壁组织中整合素β1 及钙蛋白酶2 蛋白表达水平明显升高,KOVD 组与KO-VD+PES 组小鼠尿道和阴道前壁组织中整合素β1 及钙蛋白酶2 蛋白表达水平比较差异无统计学意义,提示小鼠PES 可能通过 Cav3.2 钙通道蛋白激活钙蛋白酶2 和整合素β1,Cav 3.2 基因的敲除会阻断电刺激激活钙蛋白酶2 及整合素β1,进而影响盆底胶原的生成。
T 型钙通道Cav 3.2 广泛分布于盆底结缔组织中,参与肌肉兴奋-收缩耦合和细胞生长调节,在调节细胞内外Ca2+浓度中起关键作用[20]。而钙蛋白酶2 作为一种钙调蛋白酶,具有Ca2+依赖性。研究[21-22]显示:钙蛋白酶2 能够作用于整合素活化的直接上游蛋白talin 1,在其N 端和C 端均可进行切割,释放的头端有独立于全长talin 1 以外的功能。PES 能够诱导激活钙蛋白酶2,切割完整的talin 1蛋白的头端,进而激活整合素β1。提示整合素β1可能通过转化生长因子β1/Smad 信号通路调节盆底胶原表达。
本研究针对野生型小鼠和基因敲除型小鼠进行VD 造模和PES 干预,在蛋白分子和尿动力学水平证实了PES 的治疗作用及Cav 3.2 基因对PES 的影响;提示PES 可能通过 Cav 3.2 钙通道蛋白激活钙蛋白酶2 和整合素β1,促进盆底胶原的生成,进而达到促进盆底修复的治疗作用。

