右美托咪定诱导心肌细胞代偿性肥大发挥心肌保护作用实验研究
曹雪峰,赵 亮,刘旭东,段凤梅,董天鑫,姬云飞
(1.承德医学院附属医院麻醉科,河北 承德 067000;2.承德医学院药理教研室,河北 承德 067000;3.承德市中心医院麻醉疼痛科,河北 承德 067000)
右美托咪定(Dexmedetomidine,DEX)目前被认为是一种α2肾上腺素受体高选择性激动剂,具有镇静、辅助镇痛和抗焦虑的作用,受到麻醉科,重症监护室,儿科等科室的广泛关注[1-2]。有报道称,DEX可以减轻脓毒症模型引起的全身炎症[3]。另有研究表明,DEX可以抑制细胞凋亡保护组织免受缺血缺氧损伤并改善细胞的适应性缺氧[4-6]。DEX通过减少活性氧(Reactive oxygen species,ROS)和乳酸等有害代谢物的产生提高细胞活力[7-8]。近期研究表明,DEX有心脏保护、肺保护、神经保护和肾保护等作用[9-12]。总的来说,这些数据提示DEX通过不同的分子机制在多种疾病中起围术期器官保护作用。然而,DEX对心肌细胞形态学的影响鲜有报道。
大量研究表明,在围术期,麻醉药物和心脏预处理之间存在重要关联[13-14]。心肌肥大是一种常见的预处理,它对各种药物刺激具有形态学适应性[15]。然而,DEX预处理是否诱发心肌细胞形态发生适应性变化尚不清楚。同时,这种心肌肥大对心肌是保护还是损伤,值得研究。这种类似生理性心肌肥厚的形态变化可能是一种会逆转病理性肥厚和预防有害结果的新治疗方法。这将是研究DEX在围术期发挥心肌保护作用的新的视角,有待为临床治疗心脏疾病提供新的参考依据。
1 材料与方法
1.1 实验材料
1.1.1 主要仪器:Thermo-150i细胞孵箱,Thermo公司主营产品;MA100N倒置显微镜,日本株式会社尼康Nikon公司产品;低温恒速变速离心机,美国赛默飞世尔Thermo公司产品;Odyssey生物安全红外荧光扫描成像仪,中国科协有限公司;FV3000激光扫描共聚焦系统,日本奥巴株式会社。
1.1.2 主要药品与试剂:右美托咪(批号:21080731,纯度 99%) 购自美国Selleck生物科技有限公司;高糖培养基DMEM购于Hyclone(批号:8119045,中国),规格:每瓶500 ml;普诺赛胎牛血清,规格:每瓶500 ml,购于武汉普诺赛生命科技有限公司(批号:SA210518,中国);胰蛋白酶购于索莱宝(批号:20210930,中国),规格:每瓶100 ml;二甲基亚砜购于碧云天(批号:EZ1609C224,中国),规格:每瓶100 ml;ANP一抗购于圣克鲁斯生物技术有限公司(批号:sc-515701,中国),规格:每支100 μl;BNP一抗购于abcom公司(批号:ab-23990,英国),规格:每支100 μl;β-MHC一抗购于圣克鲁斯生物技术有限公司(批号:sc-53089,中国),规格:每支100 μl; alpha-actinin一抗购于CST生物技术有限公司(批号:6487T美国),规格:每支100 μl。
1.2 实验方法
1.2.1 新生大鼠心肌细胞(NRVMs)分离培养:无菌条件下把乳鼠(1~3 d)心室肌剪成0.8 mm×0.8 mm×0.8 mm,用DMEM缓冲液洗1 次。弃去DMEM上清液,加入37 ℃温浴的0.25 %胰蛋白酶进行消化,边消化边摇动,目的是让组织块充分与胰蛋白酶接触。丢掉第一次胰蛋白酶消化液,目的是去除血细胞和其他杂质,将已消化下的心肌细胞悬液用巴氏滴管吸至含有35 ml 完全培养液(含15%胎牛血清)的无菌离心管中,4 ℃,2000 r/min 离心3 min,弃掉离心后上清液,细胞沉淀再次用培养液重悬。经200目不锈钢筛网过滤后,用国际通用的差速贴壁分选法细胞培养箱培养1.5 h后,镜下人工计数、统计细胞密度,以1.8×104/cm2细胞悬液接种于细胞中皿,3 d后取出用于实验。本实验方案已通过河北省承德市承德医学院动物保护及动物使用委员会批准,并完全达到《国家卫生研究院实验动物中心小动物区动物使用》的要求。
1.2.2 原代乳鼠心肌细胞表面积测量:SD乳鼠心肌细胞消化、测密度后按照每孔3×105细胞接种于加有24 mm无菌盖玻片中,不同组别分别加入0.9%氯化钠溶液或右美托咪定(5 μmol/L)孵育细胞24 h,应用医学图像分析系统测量单个细胞的表面积。
1.2.3 免疫荧光化学染色:选取不同组别的心肌细胞用PBS冲洗3遍,冷甲醇固定30 min,加TritonX2100,1%BSA室温孵育1 h,封闭羊血清封闭5 h后,加入一抗37 ℃孵育,荧光二抗37 ℃孵育,运用共聚焦成像系统观察蛋白的定位和表达。
1.2.4 Western blot:取不同组别的心肌细胞(数量约2×106~3×106)吸管吹打或机械研磨后冰里放置30 min,离心(13520 r/min、4 ℃、16 min),小心吸取上清液,严格按照Bradford公司试剂盒测定蛋白质浓度。100 ℃煮5 min,12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离蛋白质,快速转膜30 min,快速封闭液室温封闭20 min。一抗4 ℃过夜,第二天加入Ⅱ抗室温孵育1 h后,化学增强发光剂DAB 显影,凝胶成像仪分析系统扫描,计算目的条带与GAPDH的相对灰度值作为各蛋白表达的相对含量。
1.2.5 CCK8检测细胞活性:细胞生长达到70%~95%时,收集消化下的细胞并人工计数,小心吹打混匀制成细胞悬浮液,将密度均匀的5000个细胞加入96孔板中。将处理板孵育24 h。更换新鲜1%FBS+DMEM低血清培养液,随机分为四组,每组6个复孔,并设置空白对照孔。在96孔细胞板中精准加入12 μl CCK8原液,制成10%的CCK8工作液。细胞孵箱内培育90 min后,酶标仪震荡混匀450 nm检测吸光强度(气泡会影响测定)。
1.2.6 离体原代心肌肥厚模型建立:血管紧张素Ⅱ(Ang Ⅱ)诱导心肌细胞肥大:细胞贴壁3 d后,用含有1% FBS的维持培养液替换正常的细胞培养液,加入浓度为10-7mol/L的Ang Ⅱ,在37 ℃、5% CO2、95%湿度环境进行培养,隔48 h换1次液,培养3 d后,检测心肌细胞表面积、细胞体积、肥大相关基因和蛋白含量。
1.3 统计学方法 采用SPSS 19.0统计学软件进行分析。组间比较应用ANOVA分析。应用Bonferroni校正t检验进行多组比较,应用配对或非配对t检验进行单个比较。双尾概率P<0.05为差异有统计学意义。
2 结 果
2.1 两组大鼠心肌细胞的形态变化 与C组比较,D组细胞面积增大,差异有统计学意义(P<0.01),见图1A、B。
2.2 两组大鼠心肌细胞心房利钠肽(Atrialnatriureticpeptide,ANP)、脑钠肽(Brain natriuretic peptide,BNP)和β-肌球蛋白重链(β-Myosin heavy Chain,β-MHC)蛋白的表达 与C组比较,D组的ANP、BNP、β-MHC蛋白表达增加,差异有统计学意义(均P<0.05),见图2A、B。
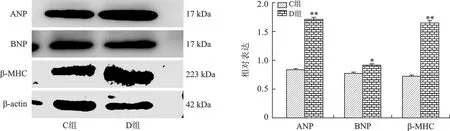
注:左图为Western blot检测C组和D组的心肌细胞ANP、BNP和β-MHC表达结果,以β-actin作为内参对照;右图为Western blot检测心肌细胞ANP、BNP和β-MHC的相对表达,与C组比较,*P<0.05,**P<0.001图2 DEX诱导心肌细胞肥大相关蛋白表达上调
2.3 CCK8检测大鼠心肌细胞活性 与CTL组比较,D组(5 μmol/L)细胞活性明显增加,差异有统计学意义(P<0.01),见图3。
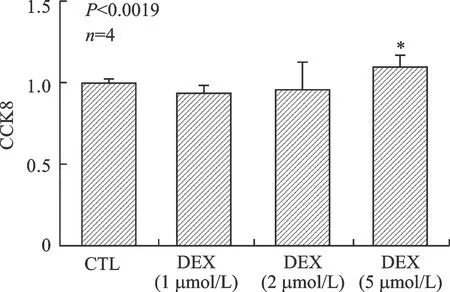
注: CTL、对照组及实验组分别加DEX(1、2、5 μmol/L)处理24 h,与CTL组比较,*P<0.01图3 DEX增加了心肌细胞的活性
2.4 三组大鼠心肌细胞ANP、BNP和β-MHC蛋白的表达 D组停药24 h后ANP、BNP、β-MHC蛋白表达明显恢复,接近C组。而A组停药24 h后ANP、BNP、β-MHC蛋白表达并未恢复正常(图4)。
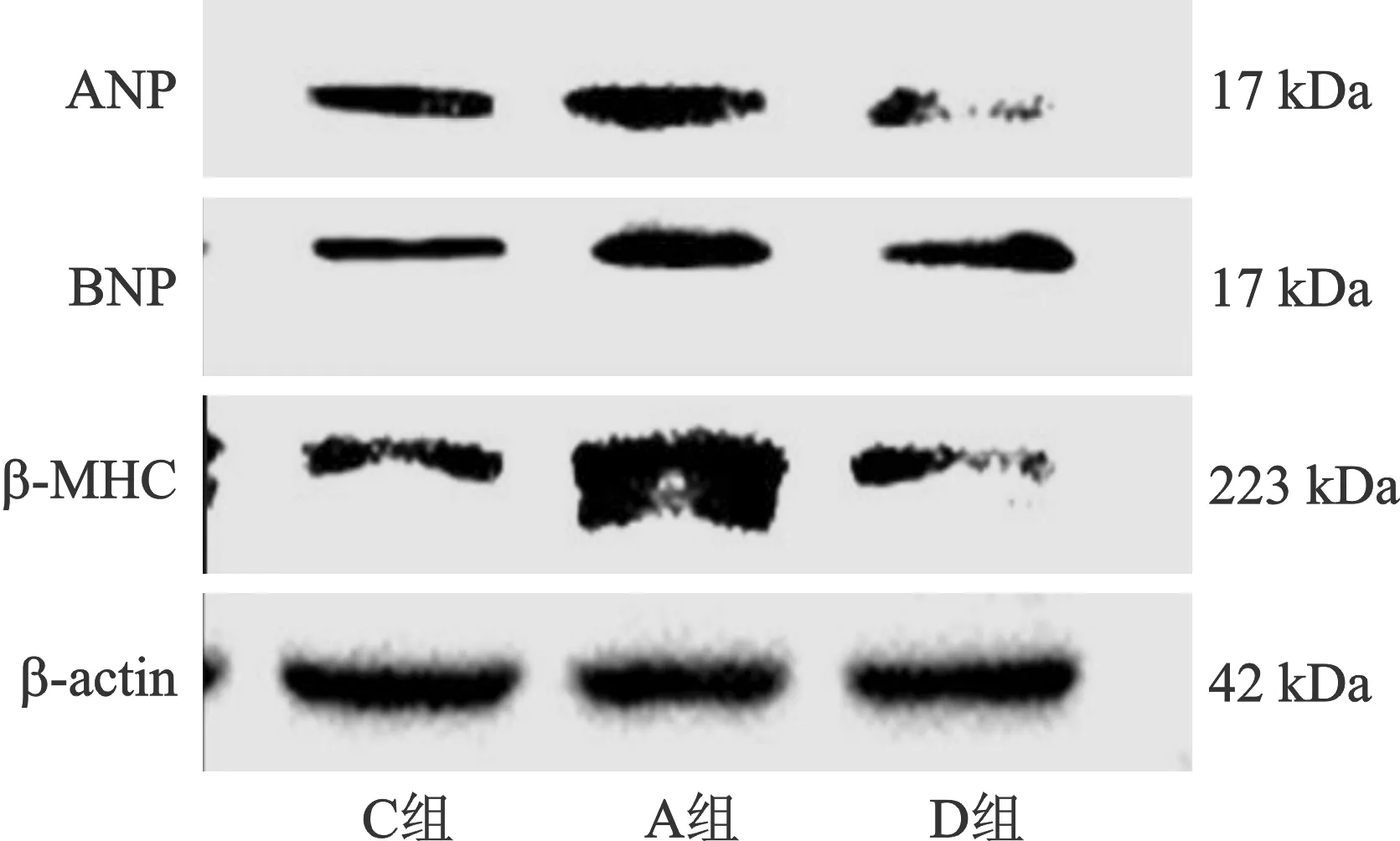
注:C组为无血清培养基处理心肌细胞48 h;A组为Ang Ⅱ(1 μmol/L)处理心肌细胞24 h后,换成无血清培养基继续培养心肌细胞24 h;D组为DEX处理心肌细胞24 h后,换成无血清培养基继续培养心肌细胞24 h。图4 三组大鼠心肌细胞ANP、BNP和β-MHC蛋白的表达
3 讨 论
相关文献报道心血管疾病已成为人类致死的首位元凶[16]。随着经济水平的提高和人们生活方式的改善,心血管疾病的患病率和病死率逐年攀升,并呈现年轻化,其中心肌肥大是引起心血管疾病病死率逐年升高的一个主要因素。心肌肥大是一种适应性和代偿性机制,在有害刺激下保持心输出量。然而,长期的刺激会导致慢性肥厚,并可能导致心力衰竭,进而导致患者死亡。由于心肌细胞属于终末分化细胞,增殖能力有限,心脏通过肥厚性重塑改变其体积和肌肉质量,以增加收缩力和工作负荷。在这种动态反应中,心肌细胞体积增大,形状变形,基因表达改变,细胞骨架和细胞外基质(ECM)均发生重塑。这种性质的心肌肥厚称之为病理性心肌肥厚。病理性心肌肥厚主要由于心肌对持续性不良负荷增加的一种适应性反应,如这种刺激得不到缓解,会导致各种恶性事件的发生。比如临床上常见的恶性心律失常及心力衰竭,同时心肌细胞可能发生多种形式的损伤,如凋亡、坏死、焦亡、铁死亡、纤维化,这种损伤均可以导致心功能进一步下降和心室恶性重构的发生。这种肥厚通常认为是不可逆转的,但也有报道在一定的条件下是可逆的[17],而这一特定条件正是可逆性临床干预的靶点。这种特点的心肌肥厚在发生的初级阶段即代偿阶段,也是一种相对保护心肌的适应性改变。另一种心肌肥厚是生理性心肌肥厚,发生人群比如长期体育锻炼的人员或妊娠妇女等,随着时间的推移可维持心脏功能,这种变化通常是可逆的[18]。长期负荷内运动是一种慢性心脏刺激因素,可以诱导心脏发生生理性心肌肥厚,这是一种良性适应性改变,有助于提高心功能,同时对病理性的心肌损伤具有保护效应。因此,心肌肥大是一个平衡的过程:当心肌肥大得到缓解时,它是适应性和代偿性的,并对心脏收缩产生有益的影响;当它是慢性得不到缓解的时候,它会变得不适应,并为病理疾病打开了道路。
DEX目前被人们广泛认为是一种α2-肾上腺素能受体激动剂,并且具有高度选择性。应用广泛,备受临床医生的青睐,多用于手术麻醉、缓解患者焦虑及镇静。α2受体广泛分布于心血管、中枢、外周神经系统和血小板中,在人体发挥重要的生物学作用。DEX 通过抑制皮质类固醇和皮质醇的分泌,降低体外循环(CPB)后血中cTnI和CK-MB的水平,而这些因子均可以加重心肌细胞的损伤,促进机体炎症反应的发生。DEX减少心肌缺血/再灌注损伤中的促炎细胞因子和氧化产物,还有研究显示,DEX可以上调抗凋亡因子Bcl-2的表达,下调促凋亡因子Bax的表达,从而减轻心肌凋亡的发生,起到心肌保护的作用。DEX通过抑制线粒体活性氧生成减轻阿霉素心脏毒性[19]。上述表明DEX通过不同的作用机制在不同的背景下发挥心脏保护作用。但至今有关DEX发挥心脏保护作用与它诱发细胞的形态学报道却十分少见。本研究从新的视角去探讨DEX对心肌的作用,该研究显示DEX明显诱发大鼠心肌细胞发生肥大。这种证明为DEX预处理在围术期环境中的有益作用提供了新的重要证据。
ANP、BNP和C型利钠肽(CNP)属于胚胎基因,在胚胎期高表达,而生物体出生后该基因表达减少,直至表达停止。而这种心脏胚胎基因在出生成熟心脏中已停止表达,但在某些特定病理条件下,如压力超负荷、去甲肾上腺素能神经长期过度兴奋、心肌重构等,该类基因可再次激活,表达逐步上调。这一过程中,肌球蛋白重链 (MHC) 也会同步表达上调。前期研究显示,心肌肥厚发生发展过程中,转录调节因子GATA4参与调控压力负荷、内皮素等病理因素诱导的 ANP 、BNP 和MHC等心肌肥厚相关基因的表达[20-21]。可见ANP 、BNP 和MHC可通过转录因子调控参与胚胎基因再编程,成为心肌肥厚药物治疗研究的新靶点。本研究显示DEX处理的乳鼠心肌细胞ANP、BNP和β-MHC的蛋白表达水平明显增加,也是DEX诱发心肌细胞发生肥大的又一个有力证据。我们用CCK8检测了两组心肌细胞的活性,结果表明DEX (5 μmol/L)处理的心肌细胞活性明显增加,差异是有统计学意义。这说明DEX诱发的心肌细胞肥大可能是一种暂时的可逆的代偿性的,类似于生理性心肌肥厚的形态变化。为了证明这个猜测,将实验分成三组,我们构建了国际通用的心肌细胞肥大模型A组。C组作为对照,无血清培养基处理心肌细胞48 h;A组Ang Ⅱ(1 μmol/L)处理心肌细胞24 h后,换成无血清培养基继续培养24 h;D组DEX处理心肌细胞24 h后,换成无血清培养基继续培养心肌细胞24 h。观察三组心肌细胞肥大相关指标ANP、BNP和β-MHC的变化。结果显示:D组心肌肥大指标ANP、BNP和β-MHC的表达能随着时间的延长恢复正常,而病理性肥大组(A组)ANP、BNP和β-MHC的表达则不能恢复。这证明了我们的猜测,DEX发挥心肌保护作用是通过诱发心肌细胞肥大,而这种肥大是类似于生理性心肌肥大,是一种可逆的代偿性的形态变化,对心脏是一种有利的保护作用。
近百年来,我们已经在动物实验、细胞水平、亚细胞水平对心肌肥厚进行了广维度、多角度的深入探究,研究包括:circRNA、lncRNA、miRNA、信号转导转录激活因子等多个领域。但心肌肥厚的发生发展机制仍然不够清楚。本研究局限性在于我们采用乳鼠心肌细胞做实验,与人心肌细胞有一定的差异。开展在体实验进一步研究DEX诱发心肌肥厚是我们下一步的研究内容。探明心肌肥厚发生机制是心血管领域研究的重要课题,具有重要的理论和临床实用意义,这将是我们下一步的研究重点。

