人工智能技术在心脏超声常规参数测量及左室舒张性慢性心力衰竭诊断中的应用
于立恒,林锡祥,陈 煦,何昆仑
(1.解放军总医院医学大数据研究中心,北京 100853;2.解放军总医院研究生院,北京 100853)
慢性心力衰竭(Chronic heart failure,CHF)指多种原因所致心脏结构和(或)功能异常,导致心室收缩和(或)舒张功能发生障碍,血液瘀滞于外周组织,从而引起呼吸困难、咳嗽、体力下降、咯血等症状的临床综合征[1]。全球约有6400万CHF患者[2],国内每年约有50万CHF新发病例[3]。CHF预后较差,5年生存率仅50%左右[4],15年病死率甚至可高达81%[5]。临床依据CHF发病基础分为左室收缩性CHF和左室舒张性CHF,其中约1/3表现为左室舒张功能异常[6]。左室舒张性CHF治疗有别于收缩性CHF,故识别左室舒张性CHF具有重要临床意义。心脏超声检查可用于心脏结构和功能筛查,具有无辐射、操作简单且无创等优势,是当前用于CHF筛查诊断的主要工具。以往众多研究证实,心脏超声能通过左室形态和舒张功能筛查,准确判断CHF左室舒张功能异常状态和程度[6-7]。然而,传统的心脏超声参数解读需要专业人才完成,受操作人员专业技能影响,造成心脏疾病筛查结果出现明显差异[8],同时,限制心脏超声在某些缺少专业超声医生的地区和科室使用。在本研究中,我们通过利用大量、多中心的心脏超声标注数据训练神经网络模型,使其在未标注心脏超声数据上具有良好预测能力,再设计基于数学规则的测量算法自动获得心脏超声影像的左室形态和舒张功能参数,有望解决传统心脏超声检查中存在的诸多限制[8-9]。为提高心脏超声诊断技术在CHF识别的应用效率,本研究对人工智能所测心脏超声常规参数与高年资心脏超声医师所测结果进行对比,并分析了各参数对左室舒张性CHF的诊断价值。现报告如下。
1 资料与方法
1.1 一般资料 选择2022年1-2月在本院心脏超声门诊接受心脏超声检查的410例左室舒张性CHF疑似病例者的心脏超声图像,评价人工智能技术生成的心脏常规参数对左室舒张性CHF疑似病例诊断的价值。病例纳入标准:临床资料完整;有多切面心脏超声图像;超声图像清晰、无伪影,可用于诊断评估。排除标准:先天性心脏病、类风湿性心脏病、肺动脉高压或肺心病;已接受过心脏同步治疗或安装有心脏起搏器。患者中男211例,女199例;年龄12~94岁,平均(59.19±15.77)岁。本研究符合医学伦理学标准。
1.2 研究方法
1.2.1 超声心动图检查:采用Philips 7C高端心脏智能彩超仪,超声探头频率设定为2~4 MHz。受检者取仰卧或左侧位,通过调整探头位置和方向,获取二维动态视频心尖四腔心切面(A4c)和心尖二腔心切面(A2c);将采集框置于二尖瓣水平位置,获取多普勒A4c-MV-PW、A4c-IVS-TDI、A4c-LW-TDI切面;将采集框置于心脏主动脉位置,获取切面。由一名高年资心脏超声医师(从业经验大于10年)对410例左室舒张性CHF疑似病例者的心脏超声的不同切面进行测量,获得以下心脏超声参数。基于A2c切面和A4c切面采用Simpson方法测得左室舒张末期容积(Left ventricular end-diastolic volume,LVEDV)和左室收缩末期容积(Left ventricular end-systolic volume,LVESV),进而计算得到左室射血分数(Left ventricular ejection fraction,LVEF)。基于调整探头位置和方向,采集框置于二尖瓣尖端水平,测量二尖瓣舒张早期峰值流速(E峰)、舒张晚期峰值流速(A峰)、二尖瓣环间隔侧壁流速(e’);采集框置于心脏主动脉位置,测量主动脉瓣峰值流速(Aortic valve Peak flow wave,AVPW)。计算E/A和E/e’。
1.2.2 人工智能图像分割模型:收集多中心回顾性心脏超声数据1000例,从中筛选出200个A4c切面、200个A2c切面、100个A4c-MV-PW切面、50个A4c-IVS-TDI切面、60个A4c-LW-TDI切面、50个A5c-AV-PW切面。然后采用低年资医生勾画、高年资医生审核的模式对这些切面进行人工标注。对于二维动态视频切面(A4c和A2c)在每一帧图像上勾画左室内膜、右室内膜、左房内膜、右房内膜等;对于多普勒频谱切面(A4c-MV-PW、A4c-IVS-TDI、A4c-LW-TDI和A5c-AV-PW)勾画频谱轮廓(图1)。
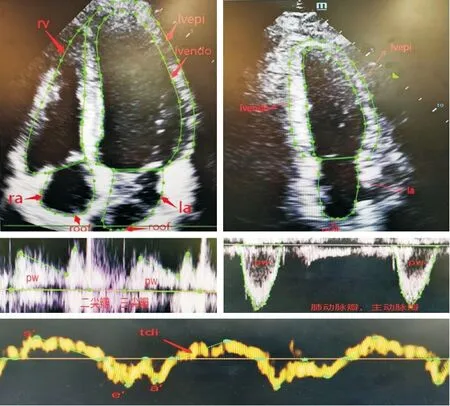
图1 二维视频切面和多普勒频谱切面标注示例
基于以上人工标注数据,本研究训练图像分割卷积神经网络模型2D CBAM-TUNet[10-14]用来分割二维视频切面,训练神经网络模型2D UNet[10]用来分割频谱切面。作为医学影像分割领域的经典模型,如图2所示,UNet的主体架构包括编码器和解码器两部分,编码器和解码器通过跳跃连接进行信息融合。心脏超声二维视频切面(A4c和A2c)是反映心脏结构和运动功能的重要切面。本科室在UNet上做了如下改进:在UNet的每级编码器中加入卷积长短期记忆网络(ConvLSTM)层[11]用来有效融合空间上下文信息和时间上下文信息。ConvLSTM是LSTM层的变体,将原始LSTM层的全连接操作改为了卷积操作[13],使其具有了空间信息的记忆能力;同时,为了提升分割模型的特征动态选择能力,在每级解码器中加入了双重注意力模块Convolutional Block Attention Module(CBAM)[12]:通道注意力和空间注意力。
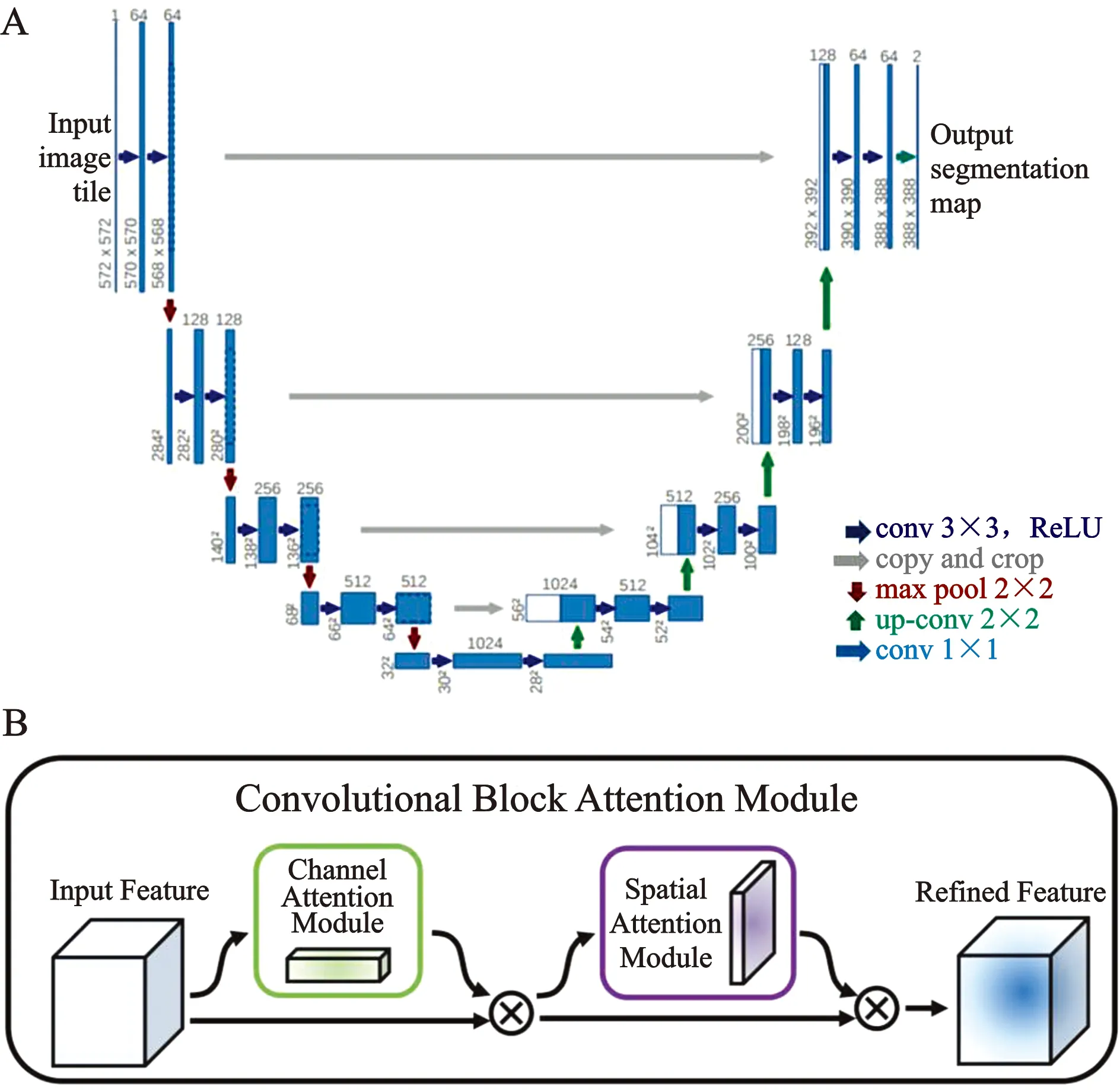
A图:UNet神经网络构架;B图:CBAM神经网络模块图2 UNet的主体架构
1.2.3 心脏超声参数测量:用训练完成的人工智能分割模型预测每例受试者心脏超声图像(共410例),获得左室内外膜、多普勒频谱轮廓等,然后设计专门的心脏结构和功能参数计算算法,计算得到心脏超声常规参数,具体步骤如下所述。基于A2C/A4C的分割结果,选取舒张末期和收缩末期的图像帧,根据辛普森法[15]计算出对应的舒张末期左心室容积(LVEDV)和收缩末期左心室容积(LVESV),通过公式LVEF =(LVEDV-LVESV)/LVEDV×100%进一步求出左室射血分数。基于多普勒频谱分割结果,分别计算出E峰、A峰、e’峰和AVPW的值。
1.3 统计学方法 采用SPSS 22.0统计软件分析所得超声参数。符合正态分布的计量资料一致性分析采用组内相关系数(ICC)法;偏差分析采用Bland-Altman分析;诊断价值用受试者工作特征(ROC)曲线分析;P<0.05为差异具有统计学意义。
2 结 果
2.1 两种方法所测受试者超声参数的一致性 人工智能与医师所测心脏超声参数LVEDV、LVESV、LVEF间一致性一般(0.60≤ICC<0.80),E/A、E/e’、AVPW一致性极好(ICC≥0.80),见表1。
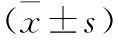
表1 两种方法所测受试者超声参数的一致性分析
2.2 两种方法所测受试者超声参数的偏差 Bland-Altman分析表明,人工智能与医师所测心脏超声参数LVEDV、LVESV、LVEF间偏差较大,平均偏差分别为-16.9%(95%CI:-31.7%~-1.7%)、-7.0%(-18.3%~1.3%)和1.0%(-5.6%~2.9%),E/A、E/e’、AVPW间偏差较低,平均偏差分别为0.0%(-0.09%~0.19%)、-0.4%(-1.6%~2.1%)和-0.0%(-0.09%~0.15%)。见图3。

图3 两种测定方法所测超声参数的Bland-Altman图
2.3 人工智能所测超声参数在左室舒张性CHF诊断中的价值 以临床医师诊断结果为依据,进行ROC曲线分析,结果显示,人工智能所测E/A、E/e’、AVPW均对左心室舒张性CHF具有一定诊断价值(均P<0.05),见表2。
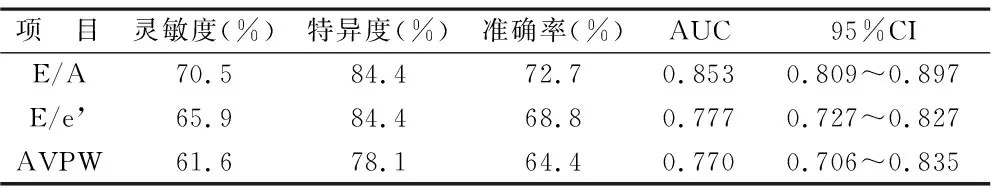
表2 人工智能所测超声参数在左室舒张性CHF诊断中的价值
3 讨 论
传统心脏超声检查图像结果解读主要依靠超声医师,不仅耗时,需要专业型人才,限制了其在非超声专业科室及基层等缺乏专业超声医生等领域的应用,而且超声诊断结果容易受医师主观性影响,导致诊断标准无法统一。鉴于此,本研究利用多中心数据建立了一种基于3D UNet分割网络技术的心脏超声测量模型并对重要参数的测量结果和高年资医生进行了对比,最后分析了部分参数在CHF中的诊断价值。左心室超声图像的准确分割是评价心脏功能的根本保障。神经网络属于常见的人工智能算法,是一种选用多层前馈神经网络系统,通过模拟人类大脑神经元运行方式,从而准确预测临床事件的人工智能技术[16]。
3D Unet是一种基于PyTorch的开源框架,专门用于医疗影像学习领域的技术[17]。基于3D UNet神经网络开发的人工智能心脏超声分析模型,可将预先获取的待分割的3D心脏超声图像进行房室和心肌分割;然后采用2D UNet神经网络对血池进行分割,去除血池分割图像中属于房室部分的图像;最后,依据获得的血管图像对心脏分割图像进行优化,获得心脏掩膜。
LVEDV、LVESV、LVEF、E/A、E/e’、AVPW均是心脏超声常规测量的重要参数。国内相关报道显示,与健康人群相比,LVEF保留型CHF患者LVEDV、LVESV、LVEF水平均未出现明显变化,但E/A水平明显下降,E/e’和AVPW水平明显升高[18-19]。国外有报道显示,即便在LVEF保留型CHF患者体内,LVEDV和LVESV指数亦存在明显变化,且其变化与不良事件发生有关,可作为判断患者预后的指标。本研究采用一致性分析和偏差分析法,对人工智能心脏超声软件模型的性能进行了测试。结果显示,人工智能所测2D超声参数LVEDV、LVESV、LVEF与高年资超声医师所测结果间一致性一般(0.60≤ICC<0.80),我们研究发现,受局部图像质量,特别是心尖不清楚时,LVEDV测量的偏差会明显增大。尽管EDV比ESV的偏差相对较大(-16.9% 与-7.0%)LVEF的整体偏差不会受太大的影响(1.0%)。另外,我们发现模型E/A、E/e’、AVPW与高年资超声医师所测结果间一致性更好(ICC≥0.80),偏差较低,仅为0.0%、-0.4%和-0.0%。总之,基于3D UNet分割网络技术的人工智能心脏超声数据软件模型所测的关键超声参数可达到与高年资超声医师相当水平,有望成为替代超声医师进行超声心脏检查结果的解读。
左室舒张功能异常是CHF发生发展的主要病理基础之一,临床约1/3CHF表现出左室舒张功能下降。相关报道显示,左室舒张性CHF患者E/A相较于健康人群明显下降,而E/e’、AVPW相较于健康人群明显升高。结果显示,人工智能所测E/A、E/e’、AVPW均对左心室舒张性CHF具有一定诊断价值(AUC>0.5)。众所周知,左心室舒张性CHF的诊断需要临床症状、实验室指标及影像学的共同判定,在临床上诊断有一定难度。尽管我们的研究证明了自动化测量的关键参数对于CHF诊断具有一定的价值,但最终诊断应结合临床。
综上所述,人工智能可快速识别并处理心脏超声检查结果,自动计算常规超声参数,且某些常规参数可以与高年资超声医师结果高度一致,有望用于辅助左室舒张性CHF的临床诊断。

