Maresin 1对脓毒症相关急性肾损伤的保护作用及机制实验研究
王 英,胡占升,张晓玉,季丽丽,李 娜,吴会平
(1.锦州医科大学附属第一医院手术室,辽宁 锦州 121001;2.锦州医科大学附属第一医院重症医学科,辽宁 锦州 121001;3.锦州医科大学附属第一医院急诊科,辽宁 锦州 121001;4.盘锦市中心医院重症医学科,辽宁 盘锦 124013)
脓毒症后会引起多种并发症[1-2],最常见的受累器官之一为肾脏,进而引起脓毒症相关急性肾损伤(Sepsis related acute kidney injury,S-AKI)[3]。尽管S-AKI病理生理学机制仍不完全清楚,但有害的炎症级联反应起着关键作用[4]。Maresin 1为促炎症消退介质中的最新家族之一,具有强大的抗炎、促炎症消退活性[5]。Maresin 1在多种炎症性疾病中发挥保护作用[5]。Maresin 1可下调肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、白介素-1β(Interleukin-1β,IL-1β)和白介素-6(Interleukin-6,IL-6)的水平进而抑制小鼠急性肺损伤[6]。细胞凋亡为半胱氨酸蛋白酶-1(Cysteine protease-1,Caspase-1)依赖机制,在调节S-AKI中发挥重要作用。但NOD样受体热蛋白结构域3(NOD like receptor hot protein domain 3,NLRP3)对于Caspase-1的激活是必不可少的。抑制NLRP3炎症体激活有助于减轻AKI的发展[7]。然而,Maresin 1是否通过调控NLRP3/Caspase-1对S-AKI具有保护作用尚不清楚。因此,本研究拟探讨Maresin 1在S-AKI中的作用及其相关机制,为其对S-AKI防治提供参考。
1 材料与方法
1.1 实验材料 SPF级雄性SD大鼠103只,6~8周,购自锦州医科大学[编号:SYXK(辽)2019-0007]。Maresin 1(美国Cayman Chemical公司);尼日利亚菌素(Nigericin)(美国Glpbio公司);NLRP3一抗(兔抗大鼠)、Caspase-1一抗(兔抗大鼠)、IL-1β一抗(小鼠抗大鼠)、白介素-18(Interleukin-18,IL-18)一抗(兔抗大鼠)、β-actin一抗(兔抗大鼠)购自英国Abcam公司;ELISA及HE染色试剂盒购自上海Mlbio公司。石蜡切片机(德国Slee公司);倒置显微镜(日本Olympus公司);水平电泳仪(美国BIO-RAD公司)。
1.2 实验方法
1.2.1 实验动物分组及模型制备:适应性饲养1周,采用盲肠结扎穿孔法(CLP)制备大鼠模型。2%戊巴比妥钠麻醉大鼠,备皮消毒,下腹正中线做长约1.5 cm切口。打开腹腔,分离并牵出盲肠,在盲肠根部用丝线结扎。用直径2.6 mm三棱针穿刺3孔,挤出少量粪便后将盲肠回纳腹腔,逐层缝合关腹。术后皮下注射复方氯化钠 30 ml/kg补液。模型大鼠按随机数字表法分成CLP组(20只)、CLP+Maresin 1组(15只)、CLP+Maresin 1+Nigericin(NLRP3激活剂,18只)组。另取10只正常大鼠作为Sham(仅行开关腹操作)组。CLP+Maresin 1组、CLP+Maresin 1+Nigericin组大鼠于术后1 h单次腹腔注射Maresin 1(4 ng/g,溶于200 μl0.9%氯化钠溶液)[8]。CLP+Maresin 1+Nigericin组在给予Maresin 1基础上联合单次Nigericin(1 mg/kg)给药[9]。Sham组和CLP组给予200 μl0.9%氯化钠溶液。另取40只大鼠按照上述方法分组及治疗,每24 h记录各组大鼠死亡数量,共7 d,进行7 d大鼠存活率统计。实验期间大鼠死亡43只,实验遵循国家《实验动物管理条例》。给药12 h后,处死大鼠用于各项指标检测。
1.2.2 标本采集:12 h后,大鼠用2%戊巴比妥钠麻醉,灌注固定前心脏取血留取血清用于血肌酐(Scr)和血尿素氮(BUN)生化指标和血清中性粒细胞明胶酶相关脂质运载蛋白(NGAL)、肾损伤分子-1(KIM-1)及炎症因子ELISA检测。大鼠采用4%多聚甲醛灌流,取肾脏放至固定液中置于-4 ℃ 48 h,进行常规石蜡包埋用于免疫组化染色和HE染色。同时对大鼠进行麻醉,取新鲜视网膜组织进行Western blot检测。
1.2.3 血清Scr和BUN检测:采用全自动生化分析仪进行上机检测。
1.2.4 ELISA检测血清NGAL、KIM1及炎症因子水平:将收集的上清,于4 ℃、12000 r/min离心20 min。按照ELISA说明书制作标准曲线并加样品,以450 nm波长测OD值。
1.2.5 HE染色:石蜡切片(5 μm)脱蜡后PBS洗3次;加苏木素反应2 min,自来水冲洗;加伊红反应1 min,自来水冲洗;脱水透明后封片,显微镜拍照观察。
1.2.6 免疫组织染色:切片常规脱蜡至水。高压抗原修复后于3% H2O2避光10 min。PBS清洗3次。山羊血清孵育30 min。一抗(NLRP3,1∶400;Caspase-1,1∶200)4 ℃过夜。复温45 min,PBS清洗3次,二抗孵育1 h,PBS洗涤,链霉素亲和素1 h。DAB显色后苏木素复染。脱水透明后封片并拍照观察。
1.2.7 Western blot:BCA试剂盒测定蛋白浓度。电泳,转膜,1% BSA封闭2 h。加入NLRP3(1∶5000)、Caspase-1(1∶5000)、IL-1β(1∶1000)、IL-18(1∶1000)、β-actin(1∶5000)4 ℃孵育过夜。18 h后TBST洗膜,二抗(1∶5000)室温孵育2 h,ECL显影。用Image J软件分析。
1.3 统计学方法 采用SPSS 22.0 统计学软件进行分析。计量资料以均数±标准差表示,多组间计量资料比较采用单因素方差分析,组间计量资料两两比较采用LSD-t法;P<0.05为差异有统计学意义。
2 结 果
2.1 Maresin 1对CLP大鼠肾功能及肾损伤指标的影响 与Sham组相比,CLP组Scr、BUN、NGAL、KIM-1水平明显增加;与CLP组相比,CLP+Maresin 1组Scr、BUN、NGAL、KIM-1水平明显降低;与CLP+Maresin 1组相比,CLP+Maresin 1+Nigericin组Scr、BUN、NGAL、KIM-1水平有所增加(P<0.05或P<0.01)。见图1。
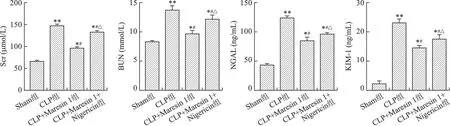
注:与Sham组比较,*P<0.05,**P<0.01;与CLP组比较,#P<0.05;与CLP+Maresin 1组比较,△P<0.05图1 各组Maresin 1对大鼠血清Scr、BUN、NGAL、KIM-1水平的影响
2.2 Maresin 1对CLP大鼠肾组织病理学的影响 Sham组肾组织结构完整、清晰,未见明显损伤性改变;CLP组和CLP+Maresin 1+Nigericin组可见肾小球萎缩,肾小管明显扩张,间质炎性细胞浸润;CLP+Maresin 1组肾组织损伤程度均较CLP组和CLP+Maresin 1+Nigericin组减轻。见图2。
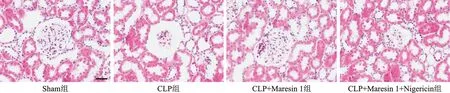
图2 各组Maresin 1对大鼠肾组织病理学的影响(HE染色×400)
2.3 Maresin 1对CLP大鼠肾组织NLRP3和Caspase-1表达的影响 Sham组可见少量NLRP3和Caspase-1阳性表达,CLP组和CLP+Maresin 1+Nigericin组可见大量NLRP3和Caspase-1阳性表达,CLP+Maresin 1组NLRP3和Caspase-1阳性表达较CLP组和CLP+Maresin 1+Nigericin组表达降低,见图3。
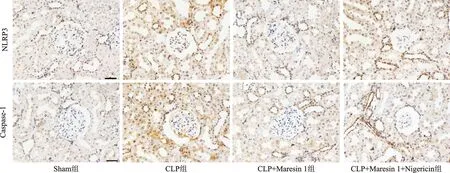
图3 各组Maresin 1对大鼠肾组织NLRP3和Caspase-1表达的影响(免疫组化染色×400)
2.4 Maresin 1对CLP大鼠肾组织NLRP3、Caspase-1、IL-1β及IL-18蛋白相对表达的影响 与Sham组相比,CLP组NLRP3、Caspase-1、IL-1β及IL-18表达明显增加;与CLP组相比,CLP+Maresin 1组NLRP3、Caspase-1、IL-1β及IL-18表达明显降低;与CLP+Maresin 1组相比,CLP+Maresin 1+Nigericin组NLRP3、Caspase-1、IL-1β及IL-18表达有所增加(均P<0.05),见图4。

注:与Sham组比较,*P<0.05,**P<0.01;与CLP组比较,#P<0.05;与CLP+Maresin 1组比较,△P<0.05图4 各组Western blot检测Maresin 1对大鼠肾组织NLRP3、Caspase-1、IL-1β及IL-18蛋白相对表达的影响
2.5 Maresin 1对CLP大鼠血清炎症因子TNF-α、IL-1β、IL-6水平的影响 与Sham组相比,CLP组TNF-α、IL-1β、IL-6水平明显增加;与CLP组相比,CLP+Maresin 1组TNF-α、IL-1β、IL-6水平明显降低;与CLP+Maresin 1组相比,CLP+Maresin 1+Nigericin组TNF-α、IL-1β、IL-6水平有所增加(均P<0.05)。见图5。

注:与Sham组比较,*P<0.05,**P<0.01;与CLP组比较,#P<0.05;与CLP+Maresin 1组比较,△P<0.05图5 各组ELISA检测Maresin 1对大鼠血清TNF-α、IL-6,IL-1β水平的影响
2.6 Maresin 1对CLP大鼠7 d存活率的影响 实验期间Sham组无大鼠死亡,CLP组大鼠死亡8只,存活2只;CLP+Maresin 1组大鼠死亡5只,存活5只;CLP+Maresin 1+Nigericin组大鼠死亡7只,存活3只。见图6。
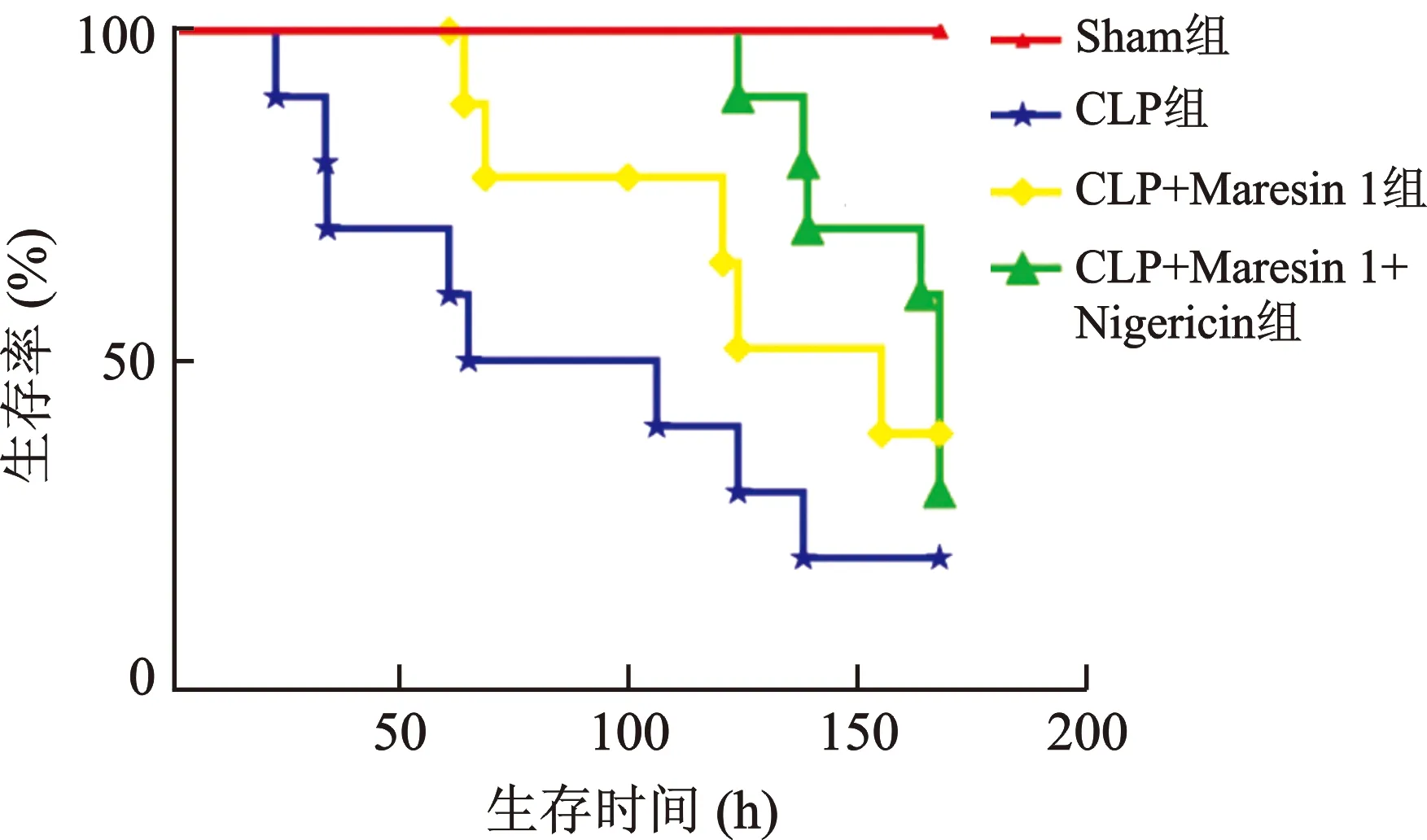
图6 各组Maresin 1对大鼠7 d存活率的影响
3 讨 论
S-AKI为一种可导致肾功能恶化和高病死率的临床综合征。S-AKI的病理生理学相当复杂,涉及多个病理途径,包括中性粒细胞的激活、活性氧和其他炎症介质的分泌[4]。S-AKI病理表现为肾小管坏死和细胞肿胀、肾小管扩张和炎性细胞浸润。我们的研究结果表明,经CLP造模12 h后大鼠血清Scr、BUN、NGAL及KIM-1水平明显升高,肾组织出现明显的病理变化,包括肾小球萎缩,肾小管明显扩张,间质炎性细胞浸润,且血清中炎症因子TNF-α、IL-1β、IL-6明显增加。这提示本研究模型成功,为下一步的研究奠定了基础。
炎症是保护宿主人体免受外部有害抗原和微生物侵害的重要作用。然而,过度的炎症反应有时会超过组织损伤,并可能破坏器官功能[10]。最近的研究已经确定,omega-3脂肪酸衍生物,在各种炎症性疾病中显示出强烈的抗炎作用[5]。Maresin 1是代表性的Omega-3脂肪酸之一,并且在多种炎症性疾病模型中显示出有益的作用[11-12]。研究发现,Maresin 1可通过抑制ROS和 Nrf2/HO-1/GPX4 激活防止铁死亡引起的肝损伤[13]。Maresin 1通过靶向Nrf2和NF-κB预防肝纤维化,减少氧化应激和炎症[14]。我们的研究结果表明,大鼠经CLP术后1 h单次腹腔注射4 ng/g Maresin 1,我们发现,Maresin 1能有效降低大鼠血清Scr、BUN、NGAL及KIM-1水平,有效缓解CLP大鼠肾脏病理变化,同时也大大降低了血清炎症因子TNF-α、IL-1β、IL-6水平,并且降低了CLP大鼠的7 d存活率。以上结果提示,Maresin 1对S-AKI引起的相关肾损伤具有明显的保护作用。此外,Maresin 1通过激活PI3K/AKT途径并抑制跑步机运动的骨关节炎大鼠模型的滑膜母细胞中的NF-κB途径来抑制IL-1β诱导的MMP-13分泌[15]。MaR1通过抑制创伤性出血性休克诱导大鼠TLR4/p38MAPK/NF-κB通路的激活,有效缓解创伤性出血性休克诱导的肺损伤[6]。Maresin 1治疗糖尿病小鼠后能够减少炎症因子TNF-α 和血栓素2的产生,从而促进伤口愈合[16],以上文献均佐证了Maresin 1的抗炎作用。
S-AKI期间,肾小管上皮细胞存在多种程序性死亡途径。近年来,新的证据表明,除了坏死和凋亡外,细胞焦亡在S-AKI的发病机制中也起着重要作用[17]。细胞焦亡由NLRP3 Caspase-1轴介导,该轴诱导细胞膜上形成孔隙,导致大量炎性细胞因子的释放。先前对缺血性中风的研究表明,NLRP3炎症小体介导Caspase-1激活,导致促炎因子分泌,然后出现细胞焦亡[18-19]。NLRP3炎性体激活导致缺血再灌注诱导的肾损伤[20]。在本研究中,我们建立了CLP大鼠模型,以观察肾脏的炎症和细胞焦亡。结果显示,CLP造模12 h后,肾组织NLRP3、Caspase-1蛋白表达明显增加,血清中也存在大量炎症因子。研究发现,Maresin 1对NLRP3炎症体激活具有抑制作用。因此,我们推测Maresin 1对S-AKI诱导的炎症反应是通过抑制NLRP3介导的细胞焦亡实现的。本研究进一步证实了大鼠经CLP术后1 h单次腹腔注射了4 ng/g Maresin 1,12 h后我们发现,Maresin 1能有效降低大鼠肾组织NLRP3、Caspase-1蛋白表达。NLRP3和Caspase-1是与细胞焦亡相关的关键蛋白质。正如我们的观察结果所示,Maresin 1改善了S-AKI诱导的炎症反应,并抑制了NLRP3、Caspase-1、IL-1β和IL-18的表达。本研究在给予Maresin 1的同时又联合给予了NLRP3激活剂Nigericin,有趣的是,Nigericin处理部分逆转Maresin 1的保护作用,这进一步提示,Maresin 1对S-AKI的保护作用可能是通过抑制NLRP3/Caspase-1通路实现的。
总之,本研究证实了Maresin 1通过抑制NLRP3/Caspase-1轴诱导的炎症反应,对S-AKI发挥保护作用。该结果为S-AKI患者发现了一种新的基于Maresin 1的治疗方法,阻断NLRP3/Caspase-1轴可能是S-AKI的一种有希望的治疗方法。然而,Maresin 1对NLRP3/Caspase-1轴的调节机制尚未在本研究中得到彻底研究。今后,我们将从转录调控的角度探讨Maresin 1对NLRP3/Caspase-1的直接调控机制。

