小鼠初级精母细胞GC-2 中TUBB4B 的表达及其对NF-κB 和MAPK信号通路的调控
刘桐佳,王万伦,张 婷,刘 爽,边艳超,张传领,肖 瑞
内蒙古医科大学1内蒙古自治区分子病理学重点实验室,2药学院,内蒙古 呼和浩特 010059
微管蛋白(TUBB4B)是β-tubulin的一种同型异构体,微管蛋白家族成员之一[1]。微管是构成细胞骨架的基础成份,由α-tubulin和β-tubulin构成异二聚体[2]。参与细胞生长发育,分化,迁移,以及细胞凋亡等多个生命过程[3]。在雄性生殖领域已有研究表明,微管作为细胞骨架的重要组成部分,参与了许多关键性的生精过程[4];微管动力学可能参与精子发生过程中精细胞的重塑、物质运输和细胞器的极性分布[5];圆形精子中微管蛋白首先在精子核的周围负极,逐渐增加并与肌动蛋白结合形成manchette结构,以促进分化形成长型精子;随着精子发生的进行,α-tubulin和β-tubulin蛋白从中心体延伸形成精子尾部,并与鞭毛轴突的其他组成成份排列形成独特的9+2结构[6];且在精子获能过程中伴随着微管蛋白(TUBB4B,TUBB1A)的氧化激活[7];在这些精子发生与获能的过程中微管蛋白扮演者重要的角色。
浦肯野细胞变性小鼠,由于Nna1基因突变导致,成年雄性小鼠因精原细胞与精子细胞细胞凋亡而引起精子数量显著减少,同时出现精子头部严重畸形与精子尾部粗细不均的发育异常的精子[8]。Nna1具有ATP/GTP结合位点,所编码的蛋白质C末端具有金属羧肽酶结构域因此也称胞浆羧肽酶CCP-1(CCP1)[9]。在我们前期研究中发现,在小鼠睾丸中TUBB4B与CCP1相互作用,暗示TUBB4B可能在雄性不育和生殖细胞发育过程中存在重要的作用[10]。并有最新研究报道TUBB4B作为关键因子,其表达缺失可造成精原细胞增殖抑制与细胞周期阻滞等现象[11]。
精子发生是一个连续性多阶段的单向性的进程,在此过程中涉及细胞分裂,分化,以及细胞间的相互作用[12]。而对于精子发生的调控作用不仅赖于各基因的有序表达,也依赖于各分子间的相互作用以及相应信号通路的适时开启与关闭。就目前研究进展来看,我们对于TUBB4B在雄性生殖细胞各细胞阶段中所发挥调控机制还不明确。在整个生精过程中,初级精母细胞是开启减数分裂的关键,也是决定后续单倍体精子形成的重要细胞时段,初级精母细胞作为衔接精原细胞与精细胞之间的桥梁,同时也是精原细胞进行定向分化的第一个细胞时段[13]。因此我们选择初级精母细胞(GC-2)作为研究对象,进一步探究TUBB4B对雄性生殖细胞的调控作用机制以及与浆羧肽酶CCP1之间的相互作用,来揭示其在雄性生殖系统中的重要功能。
1 材料和方法
1.1 材料
本实验使用的初级精母细胞(GC-2)购自中国科学院细胞库(www.cellbank.org.cn);DMEM、胎牛血清、青霉素-链霉素双抗、DMSO(Gibco);总RNA提取试剂盒(#DP431,TIANGEN);反转录试剂盒、荧光定量PCR试剂盒(Takara);DAPI(F6057,SIGMA);Phosopho-NFkB p65(93H1),NF-kB p65,MAPK(ErK1/2),Phosopho-MAPK(ErK1/2),MAPK p38(Cell Signaling);Anti-betaⅡTubulin(abcam),Anti-PolyE(AdipoGen),CCP1(proteintech)。TUBB4B,CCP1基因敲减和过表达所用慢病毒由吉凯基因构建及包装,慢病毒介导的siRNA目标片序列为:TUBB4B-RNAi:gcGCATCAACGTG TACTACAA;阴性病毒CON313:gcTTCTCCGAACG TGTCACGT;CCP1-RNAi:gcGAGTTTCTTAGTTGC CAAA;阴性病毒CON077:gcTTCTCCGAACGT GT CACGT。慢病毒介导的过表质粒信息为:LV-TUB B4B,Ubi-MCS-3FLAG-CBh-gcGFP-IRES-puromycin,阴性对照组病毒(CON335);LV-CCP1,原件顺序:Ubi-MCS-3FLAG-CBh-gcGFP-IRES-puromycin,阴性对照组病毒(CON335)。
1.2 细胞培养
GC-2 细胞培养需要用DMEM 高糖培养基(DMEM,Gibco Island,NY,USA)配制成含10%胎牛血清(FBS)和1%青霉素-链霉素双抗(Gibco)的完全培养基,培养条件37 ℃,5%CO2湿度下,每2~3 d传代。
1.3 慢病毒感染
慢病毒感染,使用24 孔板每孔接种6×104GC-2细胞,并加入300 μL 2 mg/mL的感染增强液,辅助慢病毒感染,使用病毒量1.5 μl/孔:TUBB4B敲减阳性组加入病毒:TUBB4B-RNAi,TUBB4B敲减阴性组加入病毒:阴性病毒CON313;TUBB4B过表达阳性组加入病毒:LV-TUBB4B,TUBB4B过表达阴性组加入病毒:阴性对照组病毒(CON335),并补足1 mL完全培养基。12 h 后撤病毒。得到TUBB4B 基因敲减阳性组(TUBB4B-KD),TUBB4B基因敲减阴性组(NC-KD);TUBB4B基因过表达阳性组(TUBB4B-OE),TUBB4B基因过表达阴性组(NC-OE)。并用含嘌呤霉素5 μg/mL的培养基筛选稳定表达的GC-2细胞5~7 d。用荧光显微镜观察感染后的细胞荧光。CCP1基因敲减组(CCP1-KD)与恢复表达组(CCP1-RE)的GC-2细胞为本课题组前期试验制备,以经嘌呤霉素筛选并稳定表达。
1.3 细胞免疫荧光
预冷的4%多聚甲醛溶液1 mL,固定细胞20 min,1 mL PBS 润洗吸干。1 mL 0.5%TritonX-100(10 mL PBS+50 μL TritonX-100)(AMRESCO)透化10 min。1 mL PBS 润洗3 次,吸干。向载玻片中央滴加一抗Phosopho-NF-kB p65(稀释浓1∶200),NF-kB p65(稀释浓度1∶200);37 ℃恒温箱放置1 h;1 mL PBS润洗3次,吸干。滴加荧光二抗(CY3稀释浓度1∶50);室温避光孵育30 min;1 mLPBS润洗3次后吸干。中央滴加DAPI染色液,盖上盖玻片,封片剂封片,荧光显微镜下观察。
1.4 细胞总RNA提取及实时荧光定量PCR
细胞沉淀中加入1 mL/90 mm 培养皿的RZ 裂解液,用移液枪吹打混匀。放在冰盒中静置3 min,使之充分裂解;高速离心4 ℃12 000 r/min 离心5 min;取上清,转移至新的1.5 mL无酶EP管中;依照天根总RNA提取试剂盒(TIANGEN)说明书提取组织总RNA。使用NanoDrop 2000检测RNA浓度。以每2000 ng总RNA按反转录试剂盒(Takara)说明书进行反转录。将反转录cDNA为模板依照TaKaRa定量PCR试剂盒(Takara)说明书,配反应体系后,将配置好的体系混匀,短暂离心后放入PCR仪中。反应条件:95 ℃30 s;95℃5 s;60℃34 s,共40 个循环。根据NCBI的GenBank数据库存储的TUBB4B(NM_146116),CCP1(NM_001048008),基因保守区域使用primer5软件设计本实验所用定量PCR引物(表1)。

表1 引物序列表Tab.1 Primer sequences used in this study
1.5 Western blot检测
按照100 μL/90 mm培养皿的比例向细胞沉淀中加入RIPA细胞裂解液,同时加入蛋白酶抑制剂PMSF(按比RIPA∶PMSF=100∶5)提取总蛋白。蛋白定量后,取60 μg的蛋白用8%的分离胶70 V电泳,蛋白样达到浓缩胶和分离胶交界时,电压调为110 V电泳,电泳约1 h,终止电泳。将蛋白胶样转到NC膜、5%脱脂牛奶封闭室温2 h,后孵育一抗:Phosopho-NF-kB p65;p38 MAPK Antibody;NF-kB p65(Cell Signaling),浓度按1∶1000,摇床4 ℃过夜;用1×TBST在摇床上摇洗10 min 3次;孵育相应种属的荧光二抗(荧光二抗;抗体稀释液=1∶1000),室温1 h;1×TBST 在摇床上摇洗10 min 3次;避光条件下置于Odessry CLX红外激光成像系统(Licor)扫描并观察结果。
1.6 CCK-8检测细胞增殖速率
按1×104/孔在96孔板接种,用培养基补足至100 μL,96孔板四周加入PBS,放置细胞培养箱中6 h使细胞贴壁。分别在细胞接种后的6、12、24、48、72 h向相应孔位中加入10 μL CCK Solution溶液,放入细胞培养箱中继续培养2 h。取出,开盖放置在酶标仪上测定吸光度A450nm,导出数据并统计分析。
1.7 流式细胞术检测细胞增殖周期
90 mm培养皿的细胞生长密度为80%时(约8×106个细胞)去除旧培养基,1 mL PBS清洗细胞后,500 μL胰酶消化细胞离壁。后离心将细胞沉淀使用PBS清洗两次后,弃废液。用4 ℃预冷70%乙醇(无水乙醇7 mL+PBS 3 mL)缓慢加入细胞沉淀中,4 ℃过夜。将固定好的细胞1500 r/min离心5 min,弃上清。用1 mL的1×PBS清洗细胞3次,1500 r/min离心5 min,弃上清。加入50 μg/mL PI溶液、200 μg/mL RNase Staining Buffer溶液各500 μL重悬细胞,37 ℃恒温箱中避光孵育30 min。使用200 目的细胞筛网,将待测样本筛入流式管中,上机检测。
1.8 统计学处理
数据以均数±标准差表示,采用SPSS 22.0统计软件进行分析,两组样本均数比较使用独立样本t检验,qPCR结果通过2-△△Ct[ΔCt=目的基因Ct-内参基因Ct,ΔΔCt=ΔCt(实验组)-ΔCt(对照组),相对表达=2-ΔΔCt]方法统计分析。P<0.05时被认为差异具有统计学意义,并用GraphPad Prism 5进行制图。
2 结果
2.1 GC-2细胞中TUBB4B与CCP1互相调控表达
慢病毒感染后GC-2细胞带绿色荧光,慢病毒成功感染GC-2细胞(图1A)。TUBB4B-KD与NC-KD相比mRNA与蛋白质表达水平均明显降低(mRNA表达量降低近58 倍,P<0.0001,图1B、D);TUBB4B-OE 与NCOE相比mRNA与蛋白质表达水平均升高(mRNA表达量升高2倍,P<0.05,图1C、E)。进一步通过RT-qPCR及Western blot发现TUBB4B沉默后CPP1表达量降低(TUBB4B:P<0.0001,CCP-1:P<0.05,图1F、I);TUBB4B过表达后与CCP1表达升高(TUBB4B:P<0.05,CCP-1:P<0.0001,图1G、J);CCP1沉默(P<0.0001)和恢复过表达(0.05>P>0.0001),TUBB4B表达也随之降低(P<0.05)与升高(P<0.05,图1H、K);CCP1沉默后在TUBB4B表达降低的同时聚谷氨酰化PolyE表达水平升高,且当CCP1表达量升高后在TUBB4B表达升高的同时聚谷氨酰化PolyE表达水平降低(图1K)。
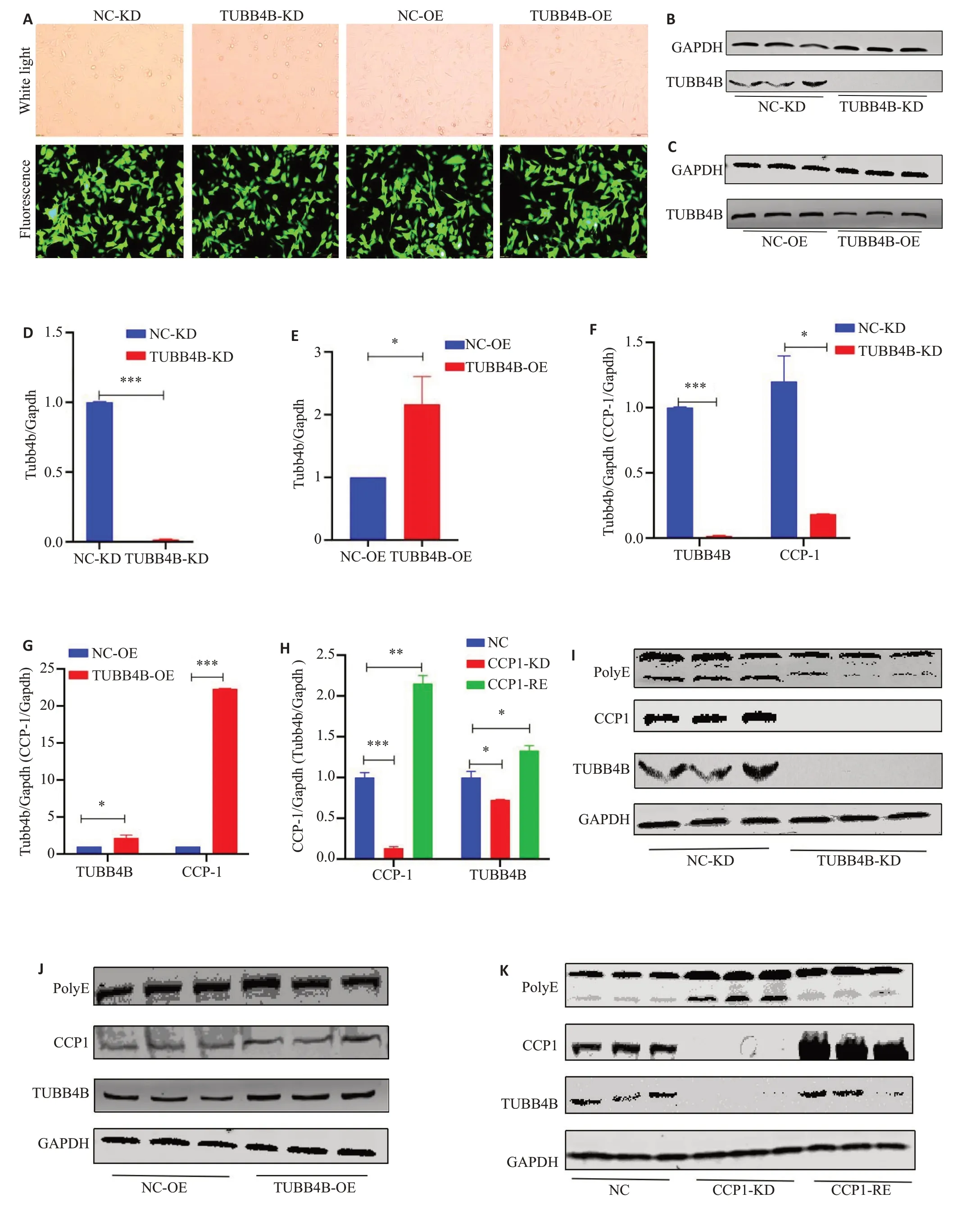
图1 检验构建的稳定细胞系并验证TUBB4B与CCP1之间的表达调控关系及相互作用Fig.1 Examination of the constructed stable cell lines and verification of the regulatory relationship and interaction between TUBB4B and CCP1.A: Fluorescence microscopy of GC2 cells infected with lentivirus (Original magnification: ×40).B,C:Western blotting results after TUBB4B silencing and overexpression.D,E: RT-qPCR results of TUBB4B mRNA expression after TUBB4B silencing and overexpression.F-K: Mutual regulatory relationship between TUBB4B and CCP1.I-K:CCP1-mediated polyglutamylated PolyE modification on TUBB4B.*P<0.05,**P<0.01,***P <0.0001,n=3.
2.2 TUBB4B敲减和过表达对初级精母细胞周期没有明显的影响
记录不同时段TUBB4B沉默与过表达阳性试验组与其阴性对照组的细胞CCK8荧光值即细胞数目,绘制相应的细胞生长曲线发现TUBB4B沉默和过表达后细胞的累计增长量无明显差别(图2A、B);通过流式细胞术检测发现TUBB4B沉默与过表达后与其阴性对照做相比各细胞周期未出现明显的改变(图2 C~H)。
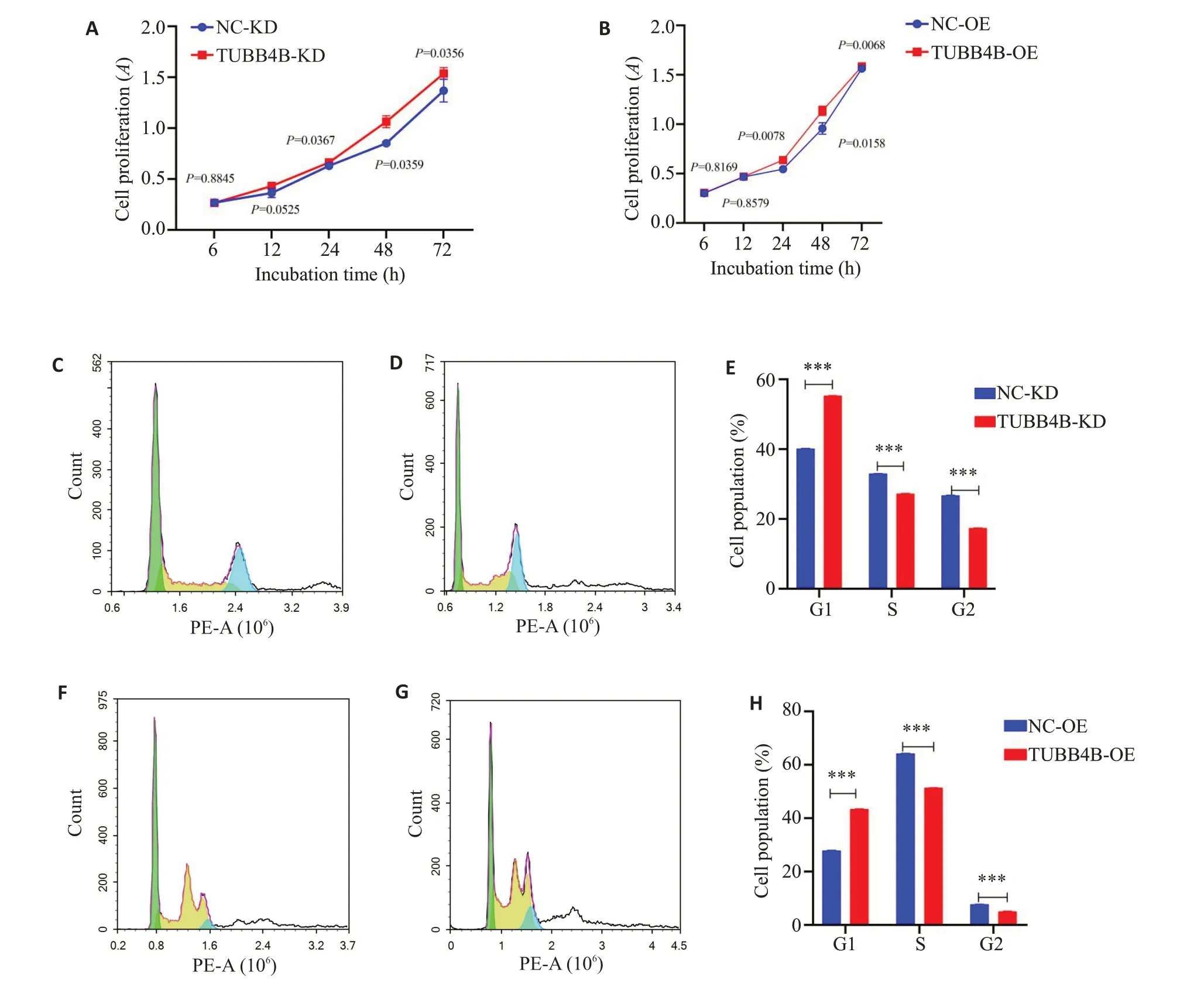
图2 探究TUBB4B沉默和过表达后其增殖与周期的改变Fig.2 Changes in proliferation and cell cycle of GC2 cells with TUBB4B silencing and overexpression.A,B:Cell proliferation rate did not change significantly after TUBB4B silencing or overexpression.C,D:Flow cytometry for analyzing cell cycle in GC2 cells with TUBB4B silencing.E: Cell cycle analysis of the cells with TUBB4B silencing.F,G:Flow cytometry for analyzing cell cycle ofGC2 cells with TUBB4B overexpression.H:Cell cycle analysis of GC2 cells with TUBB4B overexpression.***P<0.0001,n=3.
2.3 在初级精母细胞中TUBB4B调控MAPK信号通路与NF-κB信号通路
Western blot检测TUBB4B沉默后NF-κB信号通路相关因子p-p65 表达无明显改变,p65 表达明显降(图3A);MAPK信号通路相关因子ErK1/2,p38表达无明显变化,而p-ErK1/2表达明显升高;当TUBB4B表达量升高后p65,p-p65 明显升高,p-ErK1/2 明显降低,ErK1/2 与p38 表达无明显改变(图3B);细胞免疫荧光检测TUBB4B表达量改变后发生变化的相应通路因子在细胞水平定位,发现在核内与胞质均有表达(图3D~F);CCP1沉默和恢复表达后仅ErK1/2发生表达量相应的升高与降低(图3C)。
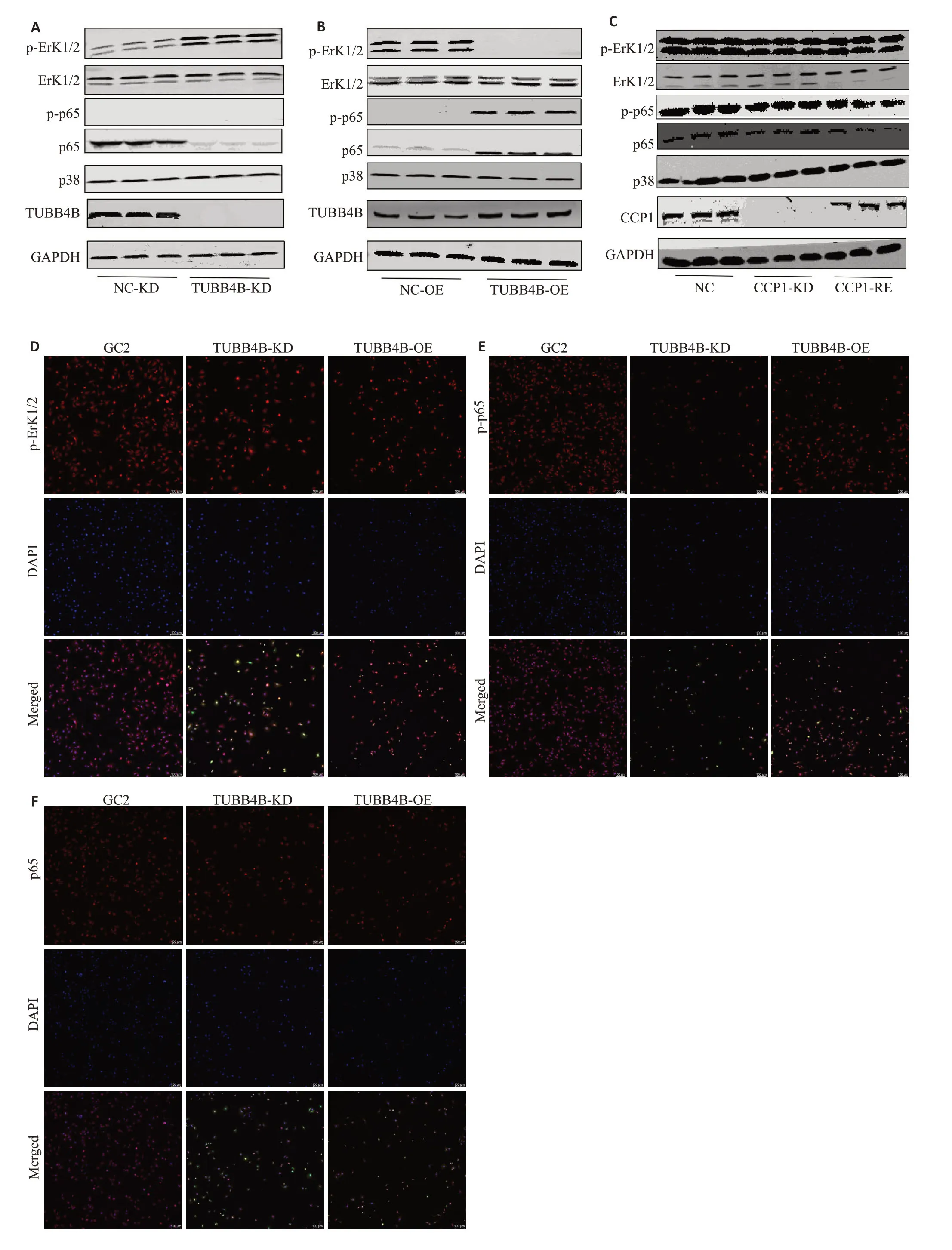
图3 TUBB4B调控MAPK信号通路与NF-κB信号通路Fig.3 TUBB4B regulates MAPK and NF-κB signaling pathways.A:TUBB4B knockdown decreases p65 expression and increases p-ErK1/2 expression.B: TUBB4B overexpression increases p65 and p-p65 expressions and decreases p-ErK1/2 expression.C:The expression of ErK1/2 was significantly increased after CCP1 silencing,and ErK1/2 was restored with CCP1 expression D,E,F: All the pathway factors were expressed in the nucleus and cytoplasm(×40).
3 讨论
微管作为细胞结构的基本骨架之一,在细胞分裂、细胞器定位、细胞内运输和细胞迁移等基本细胞过程中起着关键作用[14]。形成微管的主要蛋白为α,β-微管蛋白,大多数真核生物具有多种微管蛋白亚型,但它们在细胞骨架中的作用机制尚不清楚,需要进一步深入研究[15]。已有研究报道微管蛋白的表达与化学结构的改变与多种疾病的病理生理状态密切相关[1,16-18];在精子发生中,微管蛋白与精子运动,获能、精子与卵子结合等方面具有重要作用[4-7];正常条件下,精子特征的8 字形尾鞭结构和渐进式的运动方式,会阻止精子与上皮细胞的结合,而精子获能的过程中通常伴随着精子过度激活的运动模式的改变:肌动蛋白聚合(CAPZB)和微管蛋白过度活化(TUBB4B,TUB1A),这种改变为精子与卵
子的结合提供了重要的条件[19]。微管蛋白的表达以及其在不同类型细胞或者细胞发育阶段中发挥的作用可能不同。有最新研究发现,在精原细胞中TUBB4B的缺失会引起细胞增殖速率的减慢,细胞G1期明显阻滞,G1/0期细胞群体增加,S期细胞群体显着减少[11]。精子发生是一个连续性多阶段的单向性的进程,精原细胞经历多次有丝分裂后一部分细胞进行定向分化成为初级精母细胞,生精过程中,初级精母细胞是开启减数分裂的关键,也是决定后续单倍体精子形成的重要细胞时段[13,14]。TUBB4B在初级精母细胞中的关键作用还未有相关研究报道。在我们前期实验中发现TUBB4B在小鼠睾丸中广泛表达[11],而本次研究结果显示TUBB4B在初级精母细胞GC-2中表达且该基因缺失后对细胞存活,形态及细胞增殖周期无明显影响。该结果与在精原细胞中的的研究结果有所不同[22]。提示TUBB4B在雄性生殖细胞不同发育进程中所发挥的功能不同。
CCP1作为生精过程中的重要因子,在生精细胞的多时期普遍表达,参与整个生精活动。CCP1缺失的浦肯野细胞变性小鼠精子数量减少且形态发育异常[8]。研究发现该基因缺失会引起生精细胞发育阻滞在初级精母细胞的粗线期。TUBB4B作为潜在的CCP1作用底物[20,21],提示二者在生精过程中具有重要作用。根据我们的研究发现,两者在初级精母细胞GC2中存在正向的相互表达调控关系,且CCP1对TUBB4B具有去谷氨酰化修饰作用。已有研究发现,在精子细胞中微管蛋白各亚型的谷氨酰化的翻译后修饰,与微管结构的稳定性相关;在黑腹果蝇大脑和睾丸中谷氨酰化的α和β微管蛋白大量表达,且在精子鞭毛中也存在大量的这种翻译后修饰现象[22];TTLL介导的α-微管蛋白聚谷氨酰化途径是精子成熟和运动所必需的,并且与男性生育能力密切相关[23];以上结果说明了谷氨酰化对维持微管蛋白结构稳定具有重要作用[24]。但在此次研究中CCP1 对TUBB4B的表达和修饰虽然具有调控作用,但其表达和修饰的变化并未引起初级精母细胞增殖异常,因此其具体分子机制需要进一步探索。
已知NF-κB和MAPK信号通路对于精子发生具有重要调控作用[25-29],且有研究发现CCP1会影NF-κB信号通路关键蛋白的表达以及微管蛋白的谷氨酰胺化修饰从而引起浦肯野细胞发育异常[8,21,30]。TUBB4B的缺失在精原细胞中会引起增殖的抑制以及细胞周期的阻滞现象。但在本研究中TUBB4B的敲减并未引起初级精母细胞GC2增殖与周期的改变。为了探究这一现象发生的分子机制,我们对NF-κB和MAPK信号通路的关键因子进行检验,结果发现在GC2细胞中,TUBB4B的敲减会引起p65表达量的明显降低,抑制NF-κB信号通路;反之P-ErK1/2表达明显升高,MAPK信号通路被激活。NF-κB信号通路与MAPK信号通路的相互代偿作用可能是TUBB4B敲减后初级精母细胞增殖分裂未受影响的关键。
综上所述,在初级精母细胞GC-2细胞中TUBB4B与CCP1表达相互调控,且CCP1对TUBB4B具有去谷氨酰化修饰作用,TUBB4B调控NF-κB和MAPK信号通路,在生精过程中尤其是初级精母细胞阶段具有重要作用。
- 南方医科大学学报的其它文章
- 东革阿里抗炎的物质基础及其作用机制:基于UPLC-Q-TOFMS/MS和网络药理学方法
- 《南方医科大学学报》荣获2021年“百种中国杰出学术期刊”称号
- Cordycepin,a metabolite of Cordyceps militaris,inhibits xenograft tumor growth of tongue squamous cell carcinoma in nude mice
- Notch 信号通路抑制剂DAPT 改善酒精诱导的斑马鱼神经元分化障碍
- 低HMGB1含量的肿瘤细胞裂解物增强树突状细胞的抗肺癌作用
- 6 条目孤独感量表(ULS-6)是测量中国成年人群孤独感的有效工具

