Notch 信号通路抑制剂DAPT 改善酒精诱导的斑马鱼神经元分化障碍
殷 果,李 荣,刘岳飞,王晓睛,吴炳义
1南方医科大学南方医院医学实验中心,广东 广州 510515;2广州医科大学附属肿瘤医院放疗科,广东 广州 510095;3聊城市人民医院神经内科,山东 聊城 252000
胎儿酒精谱系障碍是指怀孕期间双方父母饮酒尤其是孕妇饮酒造成的胎儿生长发育迟缓、智力低下、颅面畸形和中枢神经系统功能等发育障碍[1,2]。酒精对中枢神经系统系统的损伤是不可逆转的,不仅可以减小大脑白质和灰质的体积,还可破坏其结构的完整性[3-5],使患儿出现永久的智力和精神障碍[1,2]。
胚胎神经元数量减少是造成FASD的重要原因[1]。现已发现酒精所致神经元丢失与多种途径有关,如神经营养因子、氧化应激、DNA损伤、内质网应激、神经炎症、自噬等[1,6]。现有研究主要集中于酒精所致神经元损伤的原因探索,然而针对酒精对神经元发育信号影响的研究相对较少。
在胚胎神经系统发育过程中,神经干/前体细胞不断地增殖并分化为神经元的过程受到多种发育信号的密切调控,其中,高度保守的Notch信号通路对胚胎期神经元发育过程非常重要[7,8]。Notch信号通路的转导是由配体Delta/Serrate与Notch受体相互作用而激活,引起γ分泌酶介导的Notch细胞内结构域(NICD)的释放,NICD 移位至细胞核,最终引起靶基因的转录[9]。Notch信号通路激活的重要生物效应之一是抑制神经元前体细胞分化为神经元[10]。然而,Notch信号通路在FASD发病过程中的作用尚缺乏研究。
斑马鱼作为一种新兴模式生物,在基因功能和器官发育与人类有着显著的相似性,研究表明斑马鱼可以最大程度模仿人类由于酒精暴露引起的神经发育方面的缺陷[10,11],酒精处理斑马鱼胚胎后出现的中枢神经系统异常表型,包括小头畸形、无前脑畸形、神经嵴缺陷、颅面缺陷等与FASD患儿很相似[12]。既往研究者利用斑马鱼FASD模型研究发现,神经嵴细胞凋亡及迁移障碍导致大脑及颅面部畸形[13,14]。本课题组既往利用斑马鱼模型研究发现酒精可显著抑制胚胎神经元的分化过程,导致神经元数量减少[11]。本研究继续以斑马鱼为FASD的疾病动物模型,旨在探讨酒精对斑马鱼神经元分化的抑制作用是否与Notch信号有关,以及Notch信号抑制剂DAPT是否具有神经保护作用。
1 材料和方法
1.1 实验动物、试剂及仪器
斑马鱼来自南方医科大学南方医院医学实验中心斑马鱼养殖实验室;斑马鱼养殖系统(美国Aquatic Habitats);鱼饲料(上海海圣公司);自动化斑马鱼行为分析系统(法国ViewPoint);所有的引物序列及测序(中国华大基因公司);DIG RNA Labeling试剂盒(SP6/T7)(瑞士Roche);限制性内切酶XbaI、BamH I、Hind III等(美国New England Biolab);质粒提取试剂盒、切胶回收试剂盒、PCR产物纯化试剂盒RNase-Free DNase set(德国Qiagen);Trizol、qRT-PCR试剂盒、T4DNA连接酶、DNA ladder、Taq DNA聚合酶均购自(Takara);其他试剂均为国产分析纯试剂;体式荧光显微镜(德国Zeiss);凝胶成像系统(美国Kodak);紫外/可见光分光光度计(美国Backman);PCR仪(Roche);离心机(德国Eppendorf);正置荧光显微镜(Olympus);琼脂糖凝胶电泳槽(Mupid);生化培养箱(中国上海智城分析仪器制造公司)。
1.2 斑马鱼饲养及其胚胎获取
斑马鱼养殖水体的溶氧不低于6.0 mg/L,电导率500~800 μs/cm,pH值7.0~8.0,温度28.5 ℃,水中含氧饱和度60%~90%,14 h光照/10 h黑暗循环,过滤棉(1次/d),活性炭和滤芯(1次/月)定期更换。按照雌雄斑马鱼1∶1或者2∶1的比例进行交配,用隔板将雌雄分开,次日早上拔掉隔板,给予15 min光照刺激,雌鱼开始产卵,1次可以产200颗卵左右[15,16]。收集的鱼卵挑出死卵后放置于10 cm培养皿中,加入含有美兰的培育水中,28.5 ℃孵箱中培育。斑马鱼的繁殖周期大约1周,1周可以进行交配产卵1次,1年内可以连续繁殖多次。养殖受精后24 h(24 hpf)斑马鱼的水中加入0.003%苯硫脲,抑制黑色素的生成,以便于染色观察。指定时间点的胚胎收集后,4%多聚甲醛(PFA)4 ℃固定过夜,备用。
1.3 实验方法
1.3.1 探针制备 按照Trizol试剂盒(Takara)提取斑马鱼胚胎的RNA;以提取的RNA 为模板,使用PrimeScriptRT reagent kit 逆转录试剂盒(Takara)进行逆转录,条件:95 ℃30 min;85 ℃5 s;设计探针的引物序列如表1所示。以cDNA为模板,合成所需探针的基因序列;利用PCR产物纯化试剂盒纯化扩增后的片段;1%琼脂糖凝胶(0.5 μg/mL核酸染色液),6 μL体系上样,100 V,15~20 min,根据核酸标志物确认扩增片段的特异性以及大小是否正确;XbaI和BamH I限制性内切酶酶切纯化后的PCR产物和pBluescript®II SK(+)质粒,并用T4连接酶将两者连接起来,转化至大肠杆菌感受态细胞中,挑选单克隆,摇菌,扩大培养,提质粒,送公司测序。使用T7 RNA聚合酶体外合成反义RNA探针。

表1 探针引物序列Tab.1 Primer sequences for probes
1.3.2 原位杂交技术 收集斑马鱼胚胎于1.5 mL离心管中,链霉蛋白酶或者手工去除卵膜;4%PFA室温固定2 h 或者4 ℃固定过夜;PBST[磷酸盐缓冲液(PBS)+0.1%吐温-20(Tween-20)]漂洗胚胎5 min,3次;50%和100%甲醇溶液梯度脱水,5 min,各1次,4 ℃,过夜;甲醇:PBST(3∶1、1∶1、1∶3)漂洗胚胎,5 min,各1次;PBST漂洗胚胎,5 min,2次;蛋白酶K(10 μg/mL)处理胚胎,小于24 hpf 无需蛋白酶K 消化,3 dpf 胚胎消化15 min;PBST轻柔漂洗胚胎,5 min;4%PFA室温固定20 min;PBST 漂洗胚胎,10 min,2 次;60 ℃杂交缓冲液(中国海利克思公司),预杂交1 h;加入预热好的探针,60 ℃,过夜,50%甲酰胺/2×杂交缓冲溶液漂洗胚胎,60 ℃,20 min,2次;使用新鲜配制的2%羊血清(中国博士德公司)进行封闭,室温1 h;加入含有碱性磷酸酶的抗地高辛抗体(Roche),1∶4000,4 ℃,摇床过夜;染色缓冲液漂洗胚胎,加入氯化硝基四氮唑兰/5-溴-4-氯-3-吲哚基-磷酸盐(Roche)染液,显微镜下观察信号表达情况,PBST终止反应;4%PFA室温下再次固定胚胎,1 h;胚胎储存于70%甘油中,4 ℃保存,备拍照。
1.3.3 qRT-PCR检测斑马鱼胚胎的mRNA 使用Trizol(Takara)提取斑马鱼胚胎的RNA,利用超微量分光光度计(Thermo)检测总RNA的纯度和浓度,根据A260/A280的比值确定RNA纯度,正常范围是1.8~2.2之间。使用PrimeScriptRT reagent kit(Takara)逆转录试剂盒,条件:95 ℃30 min;85 ℃5 s。以cDNA 为模板,进行qRTPCR反应。扩增条件如下:95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火30 s,循环40次;循环完成后,温度升至95 ℃,持续15 s,再升至60 ℃,持续1 min,最后加热至95 ℃,以获得PCR反应产物的溶解曲线。以gapdh作为内参,采用2-ΔΔct方法对数据进行相对定量分析,比较各组目的基因表达的差异,内参与目的基因的引物序列如表2所示。

表2 荧光定量PCR引物序列Tab.2 Primer sequences for qRT-PCR
1.3.4 DAPT处理 因斑马鱼神经系统发育始于囊胚期后期(约5 hpf),所以参照以往文献在此时期的斑马鱼胚胎培育水中加入50 μmol/L DAPT[17,18],斑马鱼培育至指定的时间点(8、11、24 hpf)进行4%PFA固定或者直接放入Trizol提取试剂中,备用。
1.3.5 酒精处理 在囊胚期斑马鱼胚胎的培育水中加入1.5%(体积/体积)酒精[11],斑马鱼继续培育至指定的时间点(8、11、24 hpf)进行4%PFA 固定或者直接放入Trizol试剂中,备用。
1.3.6 酒精合并DAPT处理 在囊胚期斑马鱼胚胎的培育水中加入1.5%(体积/体积)的酒精和指定浓度(0、20、30、50 μmol/L)的DAPT,斑马鱼发育至指定的时间点(8、11、24 hpf)进行4%PFA固定或者直接放入Trizol试剂中,备用。
1.3.7 斑马鱼死亡率、孵化率、畸形率的计算 胚胎死亡标志为无心脏搏动及主动活动;孵化标志为胚胎突破、完全脱离卵膜;畸形判定主要标志包括头颅躯干形态大小异常、心包肿大等。死亡率=死亡胚胎数量/产卵总数×100%;孵化率=成功孵化(脱离卵膜)鱼卵数量/产卵总数×100%;畸形率=畸形胚胎数量/产卵总数×100%。
1.3.8 斑马鱼体长检测 在5 hpf斑马鱼胚胎的培育水中加入终浓度50 μmol/L DAPT,处理至24 hpf,换成无DAPT的培育水,培育至15 dpf,4%PFA固定1 h;PBS清洗胚胎,5 min,2次;使用1 mL注射器针头在体式显微镜下轻柔去除凸起的卵黄囊;将其放置在载玻片上,加入50 μL PBS于标本周围;正置显微镜拍照,添加标尺,使用Olympus分析软件进行体长的测量。
1.3.9 斑马鱼行为学检测 斑马鱼发育至5 dpf,收集于96孔板中,每孔放1条鱼,静止30 min,待斑马鱼对新环境适应后,在不加任何刺激模块、强光刺激模块(参数设置为80%刺激强度10 s,0%刺激强度20 s,按此循环,总时间1 min)或者震动刺激模块下(80%刺激强度10 s,0%刺激强度20 s,按此循环,总时间1 min)分别使用ViewPoint ZebraBox板块记录规定时间内每条鱼每个时间段内的运动数据。导出数据于Excel表格,分析斑马鱼在刺激以及未刺激情况下的运动距离和运动速度,并对其运动能力和对刺激的反应能力进行评估。
1.3.10 统计学分析 实验数据采用GraphPad Prism 8.0软件进行处理,每组的样本量在图注中已有注明,实验重复3次,所得结果均以均数±标准差表示。两组均数比较采用t检验,多样本比较采用单因素方差分析,P<0.05时认为差异具有统计学意义。
2 结果
2.1 抑制Notch信号通路对斑马鱼胚胎死亡率、孵化率以及畸形率的影响
雌雄斑马鱼成鱼受精后,体外产卵,受精卵分裂增殖,逐渐发育成斑马鱼(图1A)。与DMSO对照组相较,50 μmol/L Notch信号通路抑制剂DAPT处理组,处理方式如图1B,1 dpf死亡率显著增加(P<0.01),2 dpf孵化率显著降低(P<0.05),3 dpf畸形率显著升高(P<0.001,图1C)。此外,与对照组相比,斑马鱼胚胎DAPT处理组中斑马鱼身体长度显著变短(P<0.05,图2A、B)。

图1 DAPT处理对斑马鱼胚胎死亡率、孵化率和畸形率的影响Fig.1 Effects of DAPT treatment on mortality rate,hatching rate and malformation rate of zebrafish embryos.A:Zebrafish embryo development over time (Original magnification: ×40).B,C: Schematic of DAPT treatment and its effects on mortality rate,hatching rate and malformation rate of zebrafish embryos (n=30-50).*P<0.05,**P<0.01,***P<0.001 vs DMSO group.
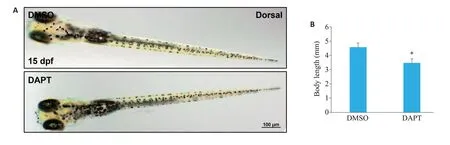
图2 DAPT对斑马鱼身体长度的影响Fig.2 Effect of DAPT on body length of zebrafish. n=20.A: The body length of zebrafish under stereoscopic fluorescence microscope;B:Quantitative analysis of the body length.*P<0.05 vs DMSO group.
2.2 抑制Notch信号通路对斑马鱼胚胎神经元分化的影响
原位杂交和qRT-PCR检测神经干/前体细胞标志物(sox2)、神经前体细胞分化因子(neurogenin1)、神经元标志物(huc)的mRNA表达水平,结果显示,与对照组相较,8 hpf、11 hpf斑马鱼胚胎DAPT处理组sox2mRNA表达均明显降低(P<0.01,图3A~D);11 hpf斑马鱼胚胎DAPT 处理组neurogenin1mRNA 表达水平显著增加(P<0.01,图4A、B);24 hpf 斑马鱼胚胎DAPT 处理组hucmRNA表达水平显著增加(P<0.01,图4A、C)。

图4 DAPT处理斑马鱼胚胎后neurogenin1和huc的表达Fig.4 Expression of neurogenin1 and huc after DAPT treatment of zebrafish embryos.A: Expression of neurogenin1 and huc mRNA at 11 hpf and 24 hpf detected by in situ hybridization.B:Quantitative analysis of MOD of neurogenin1 and huc mRNA.C:Expression levels of neurogenin1 and huc mRNAdetected by RTqPCR.Red arrows indicate positive expressions of neurogenin1 or huc.*P<0.05,**P<0.01 vs DMSO group(n=10-20).
2.3 抑制Notch信号通路对斑马鱼胚胎感觉-运动能力的影响
斑马鱼行为学分析系统采集两组斑马鱼胚胎行为学数据显示,与对照组相比,在无任何刺激情况下,DAPT暴露组幼鱼1 min的运动距离明显缩短(P<0.001),运动速度较慢(P<0.05,图5A、B);给予强光刺激,检测两组幼鱼的反应能力,结果显示,DAPT暴露组幼鱼在强光刺激开启情况下的运动距离仍明显缩短,运动速度仍较慢(P<0.001,图5C、D);给予震动刺激后,DAPT暴露组幼鱼的反应无明显改善,运动距离明显缩短,运动速度较慢(P<0.001,图5E、F)。

图5 DAPT对斑马鱼感觉-运动能力的影响Fig.5 Effect of DAPT on moving distance and speed of zebrafish in the absence of stimulation(A,B)and in response to light stimulation(C,D)and vibration stimulation(E,F).n=24-72.*P<0.05,**P<0.01,***P<0.001 vs DMSO group.
2.4 酒精对斑马鱼胚胎中Notch信号通路的影响
原位杂交和qRT-PCR检测Notch信号受体notch1a,胞内活性片段NICD以及与神经发育密切相关的靶基因her8a的表达水平,结果显示,与对照组相比,24 hpf斑马鱼胚胎1.5%酒精处理组中notch1a(P<0.01)、NICD(P<0.01)、her8amRNA(P<0.05)表达水平均明显增高(图6)。

图6 酒精对斑马鱼胚胎notch1a、NICD及her8a mRNA水平的影响Fig.6 Effect of ethanol on notch1a,NICD and her8a mRNA levels in zebrafish embryos.A:Expression levels detected by in situ hybridization.B:Quantitative analysis of the MOD.C:Expression levels detected by RT-qPCR.Red arrows indicate positive expressions of notch1a,NICD or her8a.*P<0.05,**P<0.01 vs DMSO group(n=10-20).
2.5 DAPT可部分阻断酒精对斑马鱼胚胎神经元分化的抑制效应
原位杂交与qRT-PCR结果显示,与1.5%酒精联合DMSO处理组相比,随着DAPT浓度的增加,斑马鱼胚胎神经元标志物huc的表达水平呈浓度依赖性,其中50 μmol/L DAPT联合1.5%酒精处理组中huc的表达水平显著上调,可显著改善酒精抑制神经元的分化效应(P<0.01,图7)。此外,1.5%酒精和50 μmol/L DAPT联合处理斑马鱼胚胎后,与对照组相比,8 hpf斑马鱼胚胎处理组中神经干细胞标志物sox2表达显著下调(P<0.01),11 hpf斑马鱼胚胎处理组中促进神经元分化的因子neurogenin1及24 hpf斑马鱼胚胎处理组中神经元标志物huc的表达显著上调(P<0.01,图8)。

图7 酒精联合DAPT处理对斑马鱼胚胎神经元分化的影响Fig.7 Effect of combined treatment with ethanol and DAPT on neuronal differentiation in zebrafish embryos.A:Expression levels of huc detected by in situ hybridization.B: Quantitative analysis of the MOD.C: Expression level detected by RT-qPCR.Red arrows indicate positive expression of huc.**P<0.01 vs DMSO group(n=10-20).

图8 酒精联合DAPT处理对斑马鱼胚胎sox2、neurogenin1、huc表达水平的影响Fig.8 Effect of ethanol combined with DAPT on sox2, neurogenin1,and huc mRNA levels in zebrafish embryos.A:Expression levels detected by in situ hybridization;B:Quantitative analysis of the MOD.C:Expression levels detected by RT-qPCR.Red arrow indicate positive expressions of sox2,neurogenin1 or huc.**P<0.01 vs DMSO group(n=10-20).
2.6 DAPT可改善强光刺激下酒精对斑马鱼胚胎感觉-运动能力的影响
斑马鱼行为学系统检测两组斑马鱼胚胎行为学数据显示,与DMSO联合1.5%酒精处理组相比,在无任何刺激和震动刺激情况下,50 μmol/L DAPT合并1.5%酒精暴露组幼鱼运动距离和速度无明显差异(P>0.05,图9A、B、E、F),而在强光刺激情况下,其运动距离变长(P<0.05),运动速度变快(P<0.05,图9C、D)。

图9 酒精联合DAPT处理对斑马鱼行为学的影响Fig.9 Effect of ethanol combined with DAPT treatment on moving distance and speed of zebrafish in the absence of stimulation(A,B)and in response to light stimulation(C,D)and vibration stimulation(E,F).*P<0.05 vs DMSO group(n=24-34).
3 讨论
FASD主要表现为中枢神经系统的障碍。在神经系统发育早期,神经干、前体细胞对酒精非常的敏感,其中短暂的酒精接触即可引起其自我更新和增殖的能力显著下降,导致神经元数量的显著减少[19,20],造成永久的认知功能损伤[21,22]。有研究表明,新生期小鼠受到单次酒精注射即可引起其大脑海马区域神经干细胞,小脑浦肯野细胞和伯格曼胶质细胞损伤,以及神经细胞永久丢失[23]。因此,研究酒精抑制神经元分化的机制对FASD的治疗具有重要的临床意义。
酒精对神经元谱系发育的影响是多环节的,包括神经干细胞、神经元前体细胞、新生神经元等[24],与以往文献报道一致,本课题组前期在斑马鱼酒精暴露模型中也发现酒精能减少神经前体细胞的数量并抑制其向神经元和神经胶质细胞的分化[11]。有研究表明果蝇对酒精的上瘾行为与Notch信号激活密切相关[25];慢性酒精暴露所致运动功能缺陷与小脑Notch信号抑制有关[26];然而,关于Notch信号通路在酒精抑制神经元分化过程中的作用研究较少,我们的数据显示,使用酒精Notch信号抑制剂DAPT 可显著上调促神经分化因子neurogenin1和神经元标志物huc表达,并抑制维持神经干细胞干性的sox2表达,这表明Notch信号通路在生理情况下抑制神经元分化,与以往报道一致[27];进一步研究发现酒精可上调斑马鱼胚胎notch1a、NICD及her8amRNA水平,既可作用于Notch配体产生细胞,也可作用于Notch 效应细胞,表明酒精对Notch 信号通路的多环节均有影响;并且本研究在酒精处理组中加入Notch信号抑制剂DAPT发现可显著改善酒精抑制神经元分化的程度,因此我们推测Notch信号通路参与了酒精抑制神经元分化的过程;同时证实酒精损伤对中枢系统的广泛性[22]。因此Notch 信号的激活可能是酒精导致神经系统结构功能异常的重要途径,值得进一步探索。
斑马鱼具有趋光、恐惧、探索等趋利避害行为,利用早期发育阶段的斑马鱼幼鱼进行行为学实验已广泛用于评估酒精、重金属、杀虫剂等多种物质的神经毒性[28]。本研究利用运动检测行为学实验清晰显示了酒精对斑马鱼幼鱼的神经毒性,并且可引起斑马鱼胚胎出现感觉-运动功能障碍,这与之前报道的关于孕妇在怀孕期间饮酒,其子女在童年时期发生运动障碍情况相符[29]。文献报道称酒精抑制新生动物的运动能力与抑制γ-氨基丁酸的传递以及N-甲基-D-天门冬氨酸受体有关[30,31],因此,我们推测在酒精组中加入DAPT只可改善斑马鱼胚胎在光刺激下的感觉-运动能力,而对不加刺激和振动刺激条件下的感觉-运动能力改善效果不佳的情况可能与在酒精中加入Notch信号抑制剂对神经递质和兴奋性受体的改善作用较小有关。另外,酒精是小分子化合物,进入体内后,弥散性很强,作用的靶点也较多,影响较广泛[32],因此,单纯的加入一种药物改善神经的功能有限。此外,本研究中发现酒精中加入DAPT可显著增加神经元的数量,而改善神经元的功能效果不佳,这与以往报道的酒精可导致FASD患儿行为学上永久性伤害的结论几乎一致[33]。
目前已发现,肿瘤、心血管疾病等多种疾病均与Notch信号异常有关,开发靶向Notch信号的药物非常有前景[9]。值得注意的是,我们DAPT增加斑马鱼胚胎死亡率、降低孵化速度、显著增加畸形率、抑制体长发育。这表明Notch信号可能是斑马鱼胚胎早期发育的关键信号。另外,持续DAPT浸泡处理可限制斑马鱼体长发育,这可能与Notch信号通路影响多种细胞类型的增殖、分化过程有关,尤其是肌肉、骨骼、脊髓等[34]。因此,长期、高剂量、非特异性抑制Notch信号的预期副作用较大,在未来开发细胞特异性的Notch信号抑制剂或药物递释系统中,还需选择合适的药物应用时机、剂量及疗程。
综上所述,Notch信号通路的激活与酒精抑制斑马鱼FASD的神经元分化密切相关。Notch信号通路在生理情况下抑制斑马鱼胚胎神经元分化,而胚胎神经元受到促进分化和抑制分化信号的精密调控,Notch信号发挥抑制分化效应可能是通过调控神经元分化相关的多种关键转录因子来实现。未来可进一步明确酒精损伤下Notch信号调控神经元分化的关键转录因子。另外,本研究可对FASD干预手段提供理论和实验依据。研发靶向Notch 信号通路相关抑制剂可能有助于治疗FASD。
- 南方医科大学学报的其它文章
- 东革阿里抗炎的物质基础及其作用机制:基于UPLC-Q-TOFMS/MS和网络药理学方法
- 《南方医科大学学报》荣获2021年“百种中国杰出学术期刊”称号
- Cordycepin,a metabolite of Cordyceps militaris,inhibits xenograft tumor growth of tongue squamous cell carcinoma in nude mice
- 低HMGB1含量的肿瘤细胞裂解物增强树突状细胞的抗肺癌作用
- 6 条目孤独感量表(ULS-6)是测量中国成年人群孤独感的有效工具
- 乙酰紫堇灵促进大鼠脊髓损伤后的功能恢复:基于调控EGFR/MAPK信号通路抑制小胶质细胞活化

