东革阿里抗炎的物质基础及其作用机制:基于UPLC-Q-TOFMS/MS和网络药理学方法
刘 芳,张远芳,刘 鹏,刘佳敏,刘思妤,王俊杰
湘南学院药学院,湖南 郴州 423000
天然产物一直是传统医学和现代医学中使用的生物活性化合物的主要来源。在过去的30年中,直接从具有生物活性的天然化合物中开发了1130种药物[1],总的来说,植物对于药理学研究和新药开发具有重要意义。东革阿里(Eurycoma longifoliaJack)产自马来西亚,在马来西亚可以获得许多相关药物制剂。东革阿里富含苦木素类、三萜类、角鲨烯衍生物、联苯新木脂素、角蛋白-6-酮和β-咔波啉生物碱等。化学成分基本骨架的多样性体现了这种药用植物中次生代谢物的丰富性,这些成分大部分存在于根部。植物的苦味主要由苦木素类成分贡献的。宽缨酮和宽缨醇是东革阿里中代表性的苦木素类成分。现代药理学研究表明,东革阿里提取物具有抗癌[2]、抗痛风[3]等活性。
炎症与许多疾病有关,慢性炎症或长时间持续的炎症会造成伤害并导致疾病[4]。癌症的发生和发展通常与炎症有关,东革阿里可能是通过预防病理性炎症的发展发挥抗癌活性[4]。同时,东革阿里治疗痛风的潜在能力可能与其减少氧化应激和关节炎的能力有关[5]。通过文献调研和前期研究基础表明,东革阿里提取物具有良好的抗炎活性,但其抗炎活性的物质基础尚不清楚。中药与西药不同,不同时期采集的次生代谢产物的含量和类型有显著差异。当成分的组成不清楚时,活性的评估便不具有代表性,甚至不可重复。基于此,本研究通过两种不同的动物炎症模型评估了市场上两种常见溶剂提取物:ELW(东革阿里水提取物)和ELE(东革阿里75%乙醇提取物)的抗炎活性,并通过UPLC-Q-TOFMS/MS明确了活性提取物的化学组成,运用网络药理学结合细胞实验在分子水平上解释东革阿里抗炎的作用机制。
1 材料和方法
1.1 材料
1.1.1 仪器 Waters H-Class超高效液相色谱仪(沃特世科技有限公司);AB Sciex Triple TOF®4600 高分辨质谱(SCIEX);BT25S型十万分之一分析天平(赛多利斯科学仪器(北京)有限公司);Centrifuge 5810R 离心机(Eppendorf)等。
1.1.2 药材与试剂 东革阿里药材购买自马来西亚雪兰莪市,经刘鹏老师鉴定为苦木科植物东革阿里的根茎,药材编号为NO.DGAL1607,存储于湘南学院生物医药微生物组学实验室。
脂多糖(LPS,Sigma);小鼠TNF-α 酶联免疫试剂盒(武汉伊莱瑞特生物科技股份有限公司);小鼠PGE2酶联免疫试剂盒ELISA Kit(武汉伊莱瑞特生物科技股份有限公司);JAK2/STAT3/MAPK1 一抗(BM4165,BM3951,BM4052,武汉博士德生物);乙腈、甲酸为色谱纯(默克),其他试剂均为分析纯。
1.1.3 动物 昆明种小鼠,SPF级,雄性,体质量18~22 g,6周龄,80只,购自湖南斯莱克景达实验动物有限公司,许可证号SCXK(湘)2019-0004。本研究严格按照湘南学院实验动物学部的相关动物实验伦理规范进行实验(2019DWLL015)。
1.2 方法
1.2.1 东革阿里不同溶剂提取物的抗炎活性研究
1.2.1.1 提取物制备 称取东革阿里药材600 g,粉碎,置5 L圆底烧瓶中,加入2.5 L的纯水,浸泡0.5 h,加热回流提取1.5 h,重复1次,合并两次提取液,减压浓缩,羧甲基纤维素钠悬浮,最终体积为200 mL,溶液中含0.03%的羧甲基纤维素钠,得东革阿里水提物(ELW),4 ℃冰箱备用。将提取溶剂替换为75%乙醇溶液,其他操作同上,得东革阿里75%乙醇提物(ELE)。LC-MS分析和细胞实验用的ELW和ELE提取物溶剂中只含水不加羧甲基纤维素钠,制备方法同上。
1.2.1.2 不同提取物体内抗炎活性研究
1.2.1.2.1 二甲苯致耳肿胀模型 选取健康6周龄,18~22 g昆明系雄性小鼠,随机分成4组,对照组、阳性药物组(阿司匹林,200 mg·kg-1)、ELW组(50 mg·kg-1)和ELE组(50 mg·kg-1),每组10只,适应性喂养5 d后,开始灌胃给药,1次/d,空白组和模型组给予0.03%羧甲基纤维素钠溶液,连续给药14 d,最后1次给药24 h后造模,30 μL二甲苯均匀涂布于右耳廓两侧致炎,左耳不涂作为对照。致炎30 min后脱颈椎处死小鼠,沿耳廓剪下两边的耳朵,用直径8 mm打孔器取耳片(于两耳同一部位),精密称取耳片质量,计算耳廓肿胀度和耳廓肿胀率。
耳片肿胀质量(mg)=右耳质量-左耳质量
1.2.1.2.2 小鼠急性肺损伤模型 实验设4组,空白组、模型组、ELW组(50 mg·kg-1)和ELE组(50 mg·kg-1),其它同1.2.1.2.1。最后一次给药后,小鼠禁食24 h,期间自由饮水。采用戊巴比妥钠麻醉后造模,模型组和药物组以滴鼻方式给予10 μL(2 mg·kg-1)脂多糖,空白组给予生理盐水作为对照。30 min后,摘眼球取血后,处死小鼠,取左肺组织冻存管置-80 ℃冰箱保存,取出右肺组织采用4%多聚甲醛固定。肺组织中TNF-α和PGE2含量的测定,按试剂盒说明书进行检测。
1.2.2 LC-MS 分析东革阿里活性提取物的化学成分
1.2.2.1 色谱条件 色谱柱:Agilent ZORBAX RRHD Eclipse XDB-C18(2.1×100 mm,1.8µm));柱温:30 ℃;流速:0.3 mL·min-1;进样量:2µL;检测波长:254 nm,190~400 nm;流动相比例:A相乙腈,B相0.1%甲酸水溶液,采用梯度洗脱(0~3 min,5%A;3~15 min,5%~15% A;15~30 min,15%~30% A;30~40 min,30%~50%A;40~60 min,50%~90%A;60~65 min,90%A)。
1.2.2.2 质谱条件 AB Sciex Triple TOF®4600 质谱系统采用ESI正、负离子模式,电压分别为-4500/5000,离子源温度为500°C,DP为100 V,CE为40±20 V。一级质谱母离子扫描范围为m/z 50-1700,二级质谱母离子扫描范围为m/z 50-1250。
1.2.3 网络药理学分析
1.2.3.1 筛选指标性成分 采用SwissADME数据库分析预测东革阿里活性部位化学成分的生物利用度,评价的指标主要包括胃肠吸收情况(GI)和药物相似性分析(DL)。通常,在DL分析中具有3个以上“Yes”且0 个“violation”,同时具有高GI吸收率的化合物被视为指标性成分。
1.2.3.2 炎症靶点和指标性成分靶点 以“inflammation”为关键词,在Genecards数据库中检索获得相应疾病靶点,借助对靶点进行基因名称注释;在Swiss Target Prediction数据库中输入指标性成分的SDF文件,提交工作获得指标性化合物的作用靶点,去除重复值,得成分靶点。将获得的疾病靶点和所有成分靶点数据输入Veen数据库中,获得炎症和化合物的共同靶点,即为东革阿里抗炎的潜在作用靶点。
1.2.3.3 网络构建
1.2.3.3.1 东革阿里指标性成分-靶点网络的构建 利用Cytoscape 3.9.1 软件,将东革阿里活性成分、疾病及靶点输入,构建东革阿里指标性成分-靶点网络。通过NetworkAnalysis插件对,网络拓扑特征进行分析,根据degree大小筛选东革阿里抗炎的关键成分。
1.2.3.3.2 PPI蛋白互作网络构建 将1.2.3.2项筛选出的交集靶点输入String 数据库,物种选择为“homo sapiens”,置信度>0.4,去除游离靶点,进行PPI分析,获得的文件导入Cytoscape 3.9.1中,利用CytoNCA插件筛选出抗炎核心靶点。
1.2.3.4 GO 功能与KEGG 通路富集分析 将1.2.3.2项筛选出的交集靶点输入Metascape 数据库中,以P<0.05作为条件,进行GO功能与KEGG通路富集分析。
1.2.4 分子对接 通过PubChem下载潜在活性成分的SDF 结构文件,通过PDB数据库下载核心靶点的PDB结构文件。使用PyMOL 软件对蛋白结构去除水分子及配体,利用AutoDockTool 1.5.7软件对靶蛋白与化合物进行分子对接,将最优对接结果保存为PDBQT格式。利用PyMOL软件对潜在活性成分与核心靶点进行对接并分析其结果。
1.2.5 细胞实验验证
1.2.5.1 细胞活度实验 RAW264.7细胞培养于10%胎牛血清的高糖培养基(DMEM培养基)中。实验设置为空白对照组,药物组(ELE,20、10、5、2、1µg·mL-1)。调整细胞密度为5×104/mL,每孔100µL的细胞悬液接种于96孔细胞培养板中,培养12 h,空白组换正常培养基,药物组给予含相应浓度ELE的培养基进行共培养24 h,5个复孔。CCK8试剂测定细胞活度。
实验设置为空白对照组,脂多糖组,药物组(ELE,20、10、5、2、1µg·mL-1)。细胞种板同上。除空白对照组外,其它组加入1µg·mL-1的脂多糖共孵育6 h,然后,空白对照和脂多糖组换正常培养基,药物组给予相应浓度的ELE进行共培养24 h,5个复孔。CCK8试剂测定细胞活度。
1.2.5.2 ELE 对NO 释放的影响 调整细胞密度为5×104/mL,每孔250µL的细胞悬液接种于48孔细胞培养板中,置于细胞培养箱中培养12 h,除空白对照组外,其它组加入1µg·mL-1的脂多糖共孵育6 h,空白对照和脂多糖组换正常培养基,药物组给予相应浓度的ELE(10、2、0.4µg·mL-1)进行共培养14 h,5个复孔。Griess试剂法测定并计算NO释放的抑制率。
1.2.5.3 ELE对MAPK1、JAK2及STAT3蛋白表达的影响 调整细胞密度为5×104/mL,每孔2 mL的细胞悬液接种于6孔细胞培养板中,待细胞生长于融合度70%时,除空白对照组外,其它组加入1µg·mL-1的脂多糖共孵育6 h,空白对照和脂多糖组换正常培养基培养,药物组给予相应浓度的ELE(10、2、0.4µg·mL-1)进行共培养14 h,5个复孔。Western blot检测蛋白表达情况。
1.2.6 统计学处理 用SPSS 25软件计算IC50值,进行显著性分析;用Excel 进行数据处理及计算;用Origin 2021软件进行数据绘图。计量资料以均数±标准差表示,两组间比较采用t检验,P<0.05差异有统计学意义。
2 结果
2.1 东革阿里不同溶剂提取物的抗炎活性研究结果
2.1.1 二甲苯致耳肿胀结果 东革阿里的ELW和ELE两种提取物均能减轻二甲苯致小鼠耳肿胀的程度,与模型组比较差异具有统计学意义(P<0.05,图1)。
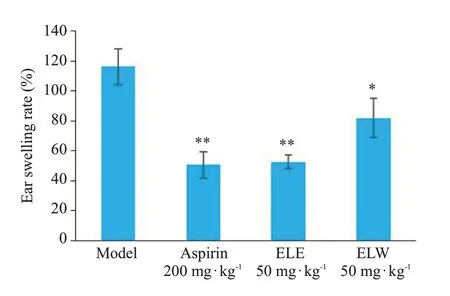
图1 东革阿里提取物的抑制小鼠耳肿胀实验Fig.1 Effects of aqueous and ethanol extracts of Eurycoma longifolia on xylene-induced ear edema in mice(Mean±SD,n=10).*P<0.05,**P<0.01 vs Model.
2.1.2 东革阿里提取对脂多糖致小鼠肺部炎症的影响空白组小鼠肺泡组织完整,无明显炎性细胞浸润,肺泡间隔没有增厚;模型组小鼠脂多糖可导致模型组小鼠肺泡结构严重破坏,而东革阿里提取物ELE和ELW可以缓解脂多糖诱导的肺损伤,ELE组小鼠肺泡结构的恢复效果明显优于ELW组(图2A)。ELE对脂多糖致肺组织中TNF-α和PEG2的升高有更强的抑制作用(图2B、C)。

图2 东革阿里提取物对肺组织作用结果Fig.2 Effect of Eurycoma longifolia extract on LPS-induced mouse lung tissue.A:Mouse lung tissue section(HE staining,×200).B:Effect of Eurycoma longifolia extract on TNF-α(pg·mL-1)in mouse lung tissue(Mean±SD,n=6).C:Effect of Eurycoma longifolia extract on PGE2(pg·mL-1)in mouse lung tissue(Mean±SD,n=6);*P<0.05,**P<0.01 vs Model group;##P<0.01 vs control group.
2.2 LC-MS分析东革阿里活性提取物(ELE)的化学组成
根据样品多级质谱信息,结合天然产物高分辨质谱数据库及相关文献,从ELE样品中共鉴定出37个化合物,其中苦木素类成分16个,生物碱类成分3个(表1,图3、4)。

表1 ELE样品主要成分鉴定结果Tab.1 Identification results of main components in ELE
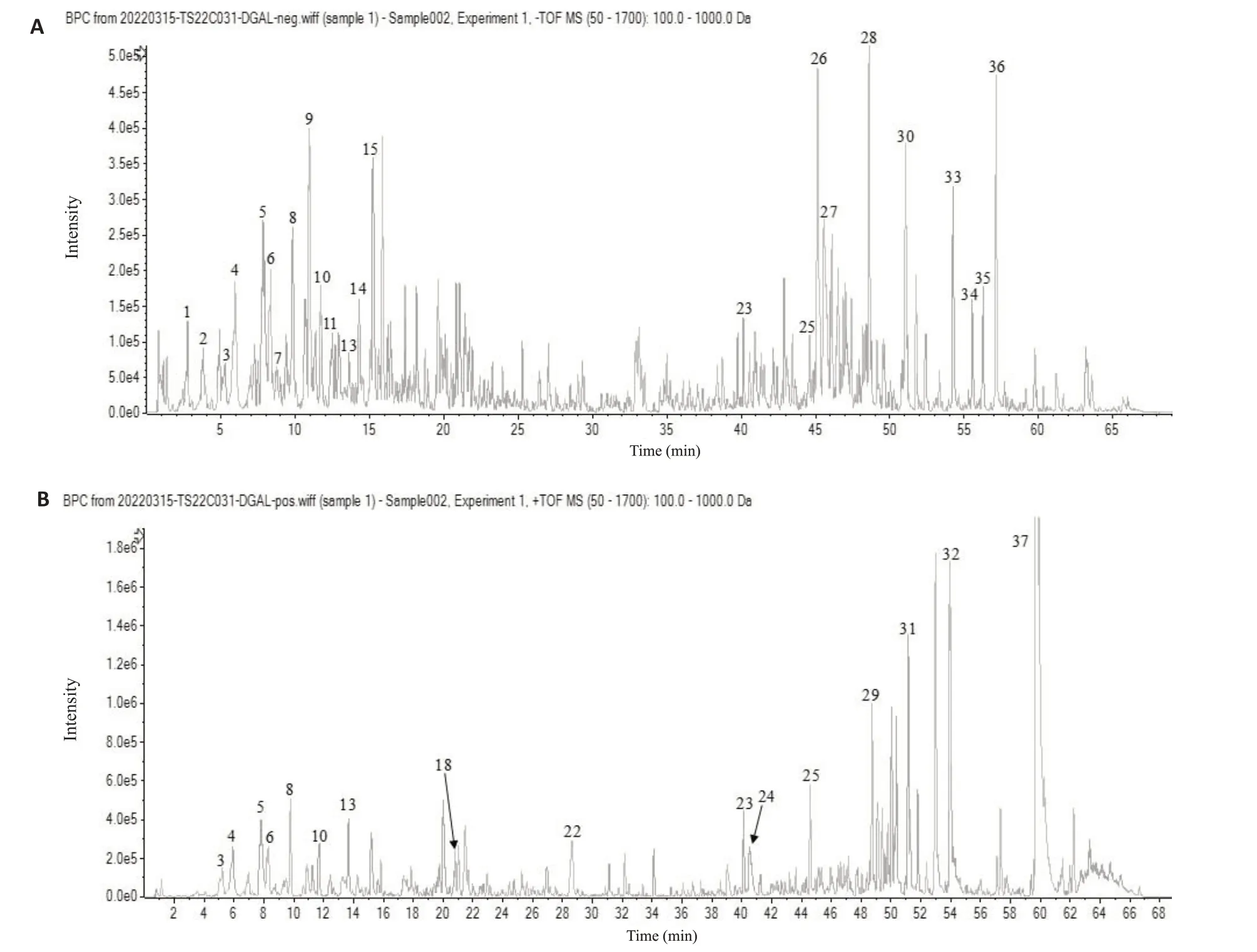
图3 ELE样品UPLC-HRMS基峰离子流图(BPC)Fig.3 Base peak ion current diagram of UPLC-HRMS of ethanol extract of Eurycoma longifolia(ELE).A:Negative ion mode.B:Positive ion mode.

图4 ELE样品UPLC紫外色谱图(254 nm)Fig.4 UPLC ultraviolet chromatogram of ELE(254 nm).
对得到的37个单体化合物的SDF文件依次输入SwissADME(http://www.swissadme.ch/)数据中,分析得到每个化合物的ADME数据,按2.3.1的筛选标准共获得10个单体化合物,另外,前期研究基础及文献检索发现化合物5(Eurycomanone)和6(Eurycomanol)为东革阿里中较大量的代表性成分,也一并归入活性化合物的行列,共得到12个代表性活性化合物(图5)。

图5 12个代表性成分的结构式Fig.5 Structural formula of the 12 active ingredients.
根据swiss ADME 及文献调研获得的12个代表性成分结构的sdf格式文件输入SwissTargetPrediction数据库中,获得每个化合物的靶点。以inflammation为关键词,从Genecard 数据库中共获得疾病靶点11 296个。将获得12个化合物靶点和疾病靶点做reen图,化合物和疾病的共有靶点共541个(图6A)。
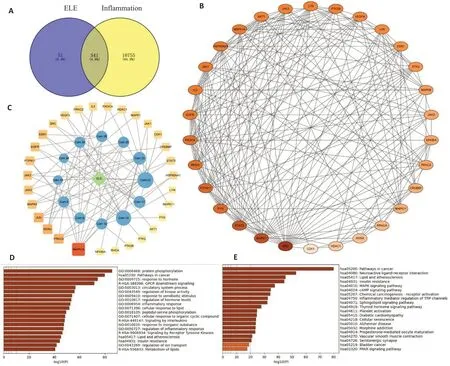
图6 网络药理学结果Fig.6 Network pharmacological analysis results.A: Venn diagrams of compound targets and disease targets.B: Target network diagram of the top 30 common targets(the darker the color,the greater the degree value).C:ELE-Representative components-core target network diagram.D:GO pathway analysis of 541 common target.E:KEGG pathway analysis of 541 common targets.
将化合物和炎症共有靶点输入String数据库,最小交互值设为最高0.900,共得到541个节点,1899条边,导出tsv文件,得共有靶点的string-interactions-short.tsv文件,将此文件导入cytoscape 3.9.1软件中,根据dgree排序,取前30的靶点,再次输入string数据库,同样设置获得排序30靶点的交互文件,导入cytoscape作图得疾病和活性成分共有靶点图6B。东革阿里醇提取物、活性成分与核心靶点数据做相互交互文件,输入cytoscape作图的提取物-活性成分-核心靶点交互图6C,颜色越深、形状越大交互作用越多。
将得到的541个靶点输入metascape数据库中,进行GO功能和KEGG通路分析。GO分析中生物过程涉及蛋白激酶B信号的正向调节和凋亡过程的负调控等,细胞组分涉及细胞质、线粒体和细胞核等,分子功能涉及蛋白质丝氨酸/苏氨酸/酪氨酸激酶活性、蛋白酪氨酸激酶活性和跨膜受体蛋白酪氨酸激酶活性等。KEGG分析中主要涉及癌症、MAPK、cAMP和PPAR等通路。在KEGG富集分析中,共得到8条主要通路。富集到的通路主要涉及神经活性配体-受体相互作用、环腺苷酸信号通路、磷脂酰肌醇3-激酶-蛋白激酶通路等,表明12个核心靶点可能是主要通过调节这些通路来起到治疗或干预疾病的作用(图6D、E)。
2.6 分子对接
12 种活性成分与JAK2(PDB: 7Q7K)、MAPK1(PDB: 6G54)2 个核心靶点的分子对接能力值热图(图7),结合能均小于-0.77 kJ·mol-1,且成分和靶点之间均有氢键形成,说明分子对接结果良好,其中除了化合物23、26、30、35以外,其他化合物均与JAK2、MAPK1具有良好的结合能力。12种成分与JAK2、MAPK1结合的具体残基位点以及相关的氢键作用力如图8所示。

图7 分子对接热图(kJ·mol-1)Fig.7 Molecular butt heat map(kJ·mol-1).

图8 分子对接结果Fig.8 Molecular docking results.Purple is a small molecule drug,reddish-brown is the binding residue,and yellow is the hydrogen bond.
2.7 细胞实验验证结果
利用CCK8检测试剂盒来评估ELE对细胞活性的影响,结果显示ELE浓度在10µg·mL-1以下对细胞的正常生长没有影响(图9)。一氧化氮检测试剂盒的结果显示,正常RAW264.7细胞中NO的释放量较低,加入脂多糖刺激后,细胞培养上清液中NO含量显著增加,说明细胞炎症模型建模成功;ELE的低、中、高剂量组均能够显著降低NO的释放量。通过Western blotting 实验结果可知,与空白对照组相比,脂多糖作用后MAPK1、JKA2和STAT3的表达量均有明显增加;与脂多糖组相比,ELE药物组的JAK2和STAT3的表达量有明显降低,尤其是浓度为2µg·mL-1的ELE药物组最为明显;浓度为0.4和10µg·mL-1的ELE药物组中MAPK1的表达量较脂多糖组有下降。
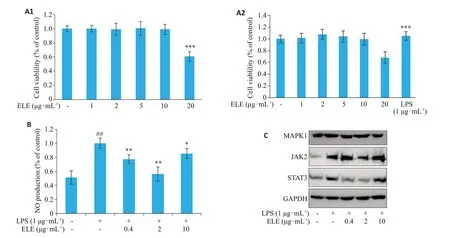
图9 细胞验证实验结果Fig.9 Results of cell validation experiment.A1:Cytotoxicity of ELE in RAW264.7 cells.A2:Cytotoxicity of ELE+LPS and LPS in RAW264.7 cells.B:Effect of ELE on nitrite level and NO release in LPS-stimulated RAW264.7 cells.C:Effect of ELE on MAPK1,JAK2 and STAT3 protein expressions in LPS-stimulated RAW264.7 cells;*P<0.05,**P<0.01,***P<0.001 vs Model;##P<0.01 vs Control.
3 讨论
网络药理学预测结果表明,宽缨酮、宽缨醇等东革阿里样品ELE中12种代表性活性成分通过541个靶点,作用于7 个与炎症、细胞凋亡相关的信号通路上(MAPK信号通路,cAMP信号通路,炎症介质调节TRP通道鞘脂信号通路及PPAR信号通路等)。ELE中代表性成分的靶点与MAPK通路相关的靶点最多,相关度也最高。MAPK通路是真核细胞介导细胞外信号到细胞内反应的重要信号转导系统,MAPK(丝裂原活化蛋白激酶)是一种丝氨酸-苏氨酸蛋白激酶,参与调节细胞的生长、分化及炎症反应等多种生理病理过程,其与炎性介质的调节关系密切。同时,MAPK可以激活下游NF-κB,NF-κB是一种诱导型转录因子,可以诱导激活多种免疫调节蛋白、炎性细胞因子(如TNF-α),导致炎症的发生。Janus激酶/信号转导和转录激活因子(JAK/STAT)通路中的相关蛋白在ELE样品中也占有重要地位,是炎症中重要的信号通路之一,参与多种重要炎症因子的信号转导及调控。其中TNF-α作为一种重要的早期炎症介质,间接激活JAK/STAT途径,STATs活化后直接进入核内参与脂多糖诱导的基因表达,诱导促炎细胞因子的表达,同时促炎细胞因子可激活NF-κB信号通路并通过调控MCP-1和COX-2蛋白的表达募集趋化更多炎症细胞,引发炎症损伤。同时,分子对接结果显示化合物5、12、17、22、25、34等与关键靶点MAPK1、JAK2均具有较好的结合能力,提示ELE有可能通过作用MAPK通路和JAK/STAT通路产生抗炎作用。文献报道发现,ELE代表性成分中有多个成分对MAPK通路和JAK/STAT通路中的相关蛋白活性有抑制作用。如宽缨酮或宽缨醇可以抑制TNF-α对NF-κB及MAPK的诱导[35]。化合物12(β-Carboline-1-propioinic acid)为卡波林生物碱类化合物,此类化合物具有较好的抗氧化、抗炎等活性[36]。化合物22(9-Methoxycanthin-6-one)具有较好抑制脂多糖刺激raw264.7细胞产生NO的作用[37]。化合物23(Aurantiamide acetate)可以改善脂多糖诱导的小鼠肺炎[38]。
活性部位(ELE)共鉴定出37个化合物,其中苦木素类成分16个,生物碱类3个,ADME分析显示生物碱类成分较苦木素类成分有更好的生物利用度,同时分子对接结果显示3个生物碱类成分(化合物12、17、22)与MAPK1、JAK2有更好的结合能力,提示东革阿里制剂经胃肠道给药的情况下,其生物碱类成分可能发挥了更好的生物活性。
细胞水平的实验验证结果显示,ELE具有良好的抑制细胞炎症的作用,对降低脂多糖诱导的蛋白JAK2和STAT3的表达有较好的作用,结合网络药理学的结果提示,东革阿里良好的抗炎作用可能是通过调控JAK/STAT3信号通路来实现的。
综上所述,本文基于UPLC-Q-TOF-MS/MS 获得的东革阿里活性部位ELE的主要成分,并通过网络药理学和细胞实验探究ELE抗炎的作用机制。结果显示,ELE通过作用于JAK2和STAT3,调控JAK/STAT通路,发挥提高免疫力、抑制炎症和氧化应激的作用。
- 南方医科大学学报的其它文章
- 《南方医科大学学报》荣获2021年“百种中国杰出学术期刊”称号
- Cordycepin,a metabolite of Cordyceps militaris,inhibits xenograft tumor growth of tongue squamous cell carcinoma in nude mice
- Notch 信号通路抑制剂DAPT 改善酒精诱导的斑马鱼神经元分化障碍
- 低HMGB1含量的肿瘤细胞裂解物增强树突状细胞的抗肺癌作用
- 6 条目孤独感量表(ULS-6)是测量中国成年人群孤独感的有效工具
- 乙酰紫堇灵促进大鼠脊髓损伤后的功能恢复:基于调控EGFR/MAPK信号通路抑制小胶质细胞活化

