低HMGB1含量的肿瘤细胞裂解物增强树突状细胞的抗肺癌作用
潘中武,李思琪,王耀辉,刘海军,桂 琳,董博翰
皖南医学院1医学微生物学与免疫学教研室,2生物化学教研室,3药学院,安徽 芜湖 241002
恶性肿瘤一直以来威胁着人类的健康,其发病率近年来呈现明显的上升趋势[1]。放、化疗等肿瘤常规疗法,虽然取得了一定的疗效,但这些方法毒副作用比较明显[2]。所以,探寻对机体损伤小且效果好的治疗手段,成为肿瘤治疗的新思路、新策略。随着肿瘤学、分子生物学及免疫学等学科的逐步发展,肿瘤疫苗治疗肿瘤成为当前的热点研究领域[3,4]。
肿瘤疫苗疗法是通过将肿瘤特异性抗原引入患者体内来刺激主动的抗肿瘤特异性免疫反应,从而破坏肿瘤细胞并产生与抗肿瘤相关的免疫记忆[5]。目前,核酸疫苗、细胞型疫苗、抗体阻断治疗和树突状细胞(DC)过继免疫细胞疗法得到了广泛的研究,其中基于DC的过继免疫细胞疗法表现出了广阔的应用前景[6]。
在实施DC过继免疫治疗过程中,最常用肿瘤细胞裂解物(TCL)致敏DC[7-9]。TCL可通过反复冻融、超声、蛋白分解酶或机械匀浆等方法将肿瘤细胞裂解制备而得[10]。TCL中抗原成分复杂,这些物质中既含有可以促进树突状细胞活化的抗原成分,也含有促进肿瘤细胞增殖以及对树突状细胞产生抑制作用的蛋白质或化学物质,正是由于后者的存在,不利于TCL充分发挥对树突状细胞的活化和抗肿瘤免疫作用[11]。本研究尝试从TCL中去除某些重要的免疫抑制因子,以此增强TCL的DC细胞激活功能,这种对TCL免疫活性进行提升的方式,目前未见报道。
高迁移率族蛋白B1(HMGB1)是存在于真核细胞核内一种含量丰富的非组蛋白染色体结合蛋白,参与多种生命活动如调节炎症、细胞迁徙和基因转录等[12-14]。研究表明,HMGB1在多种恶性肿瘤如肝癌、胃癌、结直肠癌、胰腺癌、肺癌中高表达[15,16]。肿瘤细胞表达的HMGB1作为配体,与DC表面的TIM-3受体结合,可以产生免疫抑制作用,降低了肿瘤相关DC对化疗的免疫应答活性,从而帮助肿瘤细胞逃避免疫细胞的攻击[17]。甘草酸(GA)是甘草中最主要的活性成分,大量的文献证明GA可以抑制HMGB1的表达进而影响相应的免疫应答反应[18-20]。
本研究用Lewis肺癌细胞制备TCL,采用甘草酸(GA)抑制Lewis肺癌细胞,将TCL中的HMGB1蛋白去除,然后和DC细胞共同培养,用流式细胞术检测DC细胞凋亡、活化情况,用CCK8比色法测定DC激活的淋巴细胞对Lewis肺癌细胞的体内、体外杀伤作用。以此探究HMGB1是否能诱导DC的凋亡、抑制其免疫活性,并在此基础上对TCL 进行改良,检测低HMGB1 的TCL(LH-TCL)负载DC,是否可以增强DC诱导的抗肿瘤免疫作用?解决这些问题将为DC过继免疫细胞疗法的实施和肿瘤环境中DC功能受到抑制的机制提供新的见解,有望增强DC过继免疫细胞疗法的抗肿瘤效果,为基于TCL的抗肿瘤免疫治疗提供新的思路。
1 材料和方法
1.1 主要材料与试剂
来源于C57/BL6小鼠的Lewis肺癌细胞(武汉博士德公司)。4~6周龄的雄性C57/BL6小鼠(常州卡文斯实验动物有限公司,许可证号:SCXK(苏)2021-0013)于中国芜湖皖南医学院微生物学与免疫学教研室动物房饲养,按照皖南医学院动物研究伦理委员会的指导方针对小鼠进行护理和饲养(2020 伦审国研第87 号)。APC标记的CD86单抗(BioLegend),PE标记的CD69单抗(Thermo),HMGB1、GAPDH抗体(ABclonal),辣根过氧化物酶偶联的二抗、化学发光溶液(碧云天),化学发光仪器(Clinx),CCK8 试剂盒(biosharp),mrGMCSF细胞因子(Sino Biological),RPMI 1640、DMEM培养液(Gibco),细胞凋亡检测试剂盒(中国凯基公司)。
1.2 肿瘤细胞的培养
从冰箱中(-80 ℃)取出Lewis 肺癌细胞冻存管,37 ℃水浴箱内快速融化,然后将细胞悬液接种于培养皿(含10%FBS的DMEM)中,于37 ℃含5%CO2培养箱中培养。根据培养基颜色变化及倒置相差显微镜观察细胞生长密度,每2~3 d进行1次换液,待细胞融合度达85%~90%左右进行传代,取处于对数生长期、状态良好的的细胞进行后续实验。
1.3 DC与脾细胞的体外培养
DC的体外培养:断颈处死小鼠,无菌取双侧胫骨和股骨,浸泡在盛有RPMI 1640的平皿中。剪去骨两端,用1640培养液反复冲洗骨髓腔至骨变白,收集经200目滤网过滤后的细胞悬液,400 g,5 min,弃上清;滴入3 mL红细胞裂解液,室温放置5 min,滴加10 mL PBS终止反应,1500 g,5 min,弃上清。用含5%FBS的1640培养液将细胞浓度调为2×109/L,6孔板中培养,每孔2 mL,加入细胞因子mrGM-CSF,20 μg/mL,隔天半量换液。7 d后,观察DC成熟情况并收集,以抗CD11b、CD11c抗体对DC进行染色,流式细胞仪检测DC表面分子CD11b、CD11c的表达情况。
小鼠脾细胞的体外培养:断颈处死小鼠,无菌取出小鼠脾脏,置于200目滤网上,滤网下放一无菌平皿(已加入10%FBS的RPMI 1640 培养液),将脾脏于培养液中剪碎并轻轻研磨。滴加红细胞裂解液,混匀,裂解3 min,离心弃上清液,并用PBS洗涤2遍。加入含10%FBS的RPMI 1640培养液吹悬。
1.4 制备TCL和LH-TCL
采用反复冻融的方法制备TCL。将对数生长期的Lewis肺癌细胞用0.25%的胰酶消化,然后用PBS洗涤细胞2~3 次,1000 r/min 离心3 min,弃去上清后再用PBS重悬细胞,调整细胞浓度为1×107/mL,接着于-80 ℃条件下,冻存15 min,37 ℃温育5min,震荡1min,反复操作5次,离心将上清转移至1.5 mL EP管中,然后用台盼蓝染色法检测细胞冻融破裂情况,得到Lewis肺癌细胞裂解物(NH-TCL)。用甘草酸(GA)处理48 h的Lewis肺癌细胞经上述方法制备的即为LH-TCL。
1.5 Western blot检测Lewis肺癌细胞TCL中HMGB1蛋白的表达情况
提取TCL总蛋白,收集Lewis肺癌细胞,并用适量的裂解缓冲液裂解它们。通过BCA方法确定浓度后,在12% SDS-PAGE 上分离裂解物的蛋白质,转移到PVDF膜上,5%脱脂奶粉封闭1 h,并在4 ℃的冰箱中孵育一抗过夜。然后用TBST洗涤膜,并在室温下将膜与辣根过氧化物酶偶联的二抗孵育1.5 h。之后,在黑暗条件下将适量的化学发光溶液均匀涂在PVDF膜上。最后在化学发光仪器上检测荧光的强度。以GAPDH作为内参,通过ImageJ software(version 1.52;National Institutes of Health),分析目标蛋白质相对于GAPDH蛋白质的灰度值。
1.6 流式细胞术检测
1.6.1 细胞凋亡检测 以5×105接种d7的DC于12孔板中,待DC 稳定后加入不同剂量的NH-TCL 和LHTCL。分组如下:不同剂量(DC细胞数:制备裂解物的Lewis肺癌细胞数分别为1∶0.25、1∶0.5、1∶1、1∶5)NHTCL负载DC组(DC:NH-TCL组)、不同剂量(DC细胞数:制备裂解物的Lewis肺癌细胞数为1∶0.25、1∶0.5、1∶1、1∶5)LH-TCL负载DC组(DC:LH-TCL组)及PBS对照组。孵育48 h后收集细胞用于检测不同剂量的NH-TCL和LH-TCL对DC凋亡的影响。
1.6.2 细胞活化检测 以5×105/孔接种d7的DC于12孔板中,待DC稳定后加入不同剂量的NH-TCL(DC细胞数:制备裂解物的Lewis肺癌细胞数分别为1∶0.25,1∶0.5)和LH-TCL(DC细胞数:制备裂解物的Lewis肺癌细胞数分别为1∶0.25,1∶0.5)。实验分组同1.6.1。孵育48 h后收集细胞,用PBS洗涤2次,再将其重新悬浮在100µL染色缓冲液中,用APC标记的CD86染料1 μL对细胞进行避光染色30 min,流式细胞仪检测DC表面CD86的表达情况。
在其他实验中,将负载NH-TCL 的DC(DC/NHTCL组,DC细胞数:制备裂解物的Lewis肺癌细胞数为1∶0.5)或负载LH-TCL的DC(DC/LH-TCL组,DC细胞数:制备裂解物的Lewis肺癌细胞数为1∶0.5),按照DC细胞数:脾细胞(Sp)数分别为1∶0.5、1∶1、1∶5、1∶10,刺激脾细胞,同时设立PBS对照组,使用流式细胞术检测脾细胞表面CD69表达,以判断脾细胞的活化情况。
1.7 ELISA检测细胞因子表达
收集上述分组处理后的DC、脾细胞培养上清液,采用ELISA(武汉博美)检测IL-12、TNF-β等细胞因子。具体操作过程参照说明书进行,每组设3复孔。
1.8 CCK8检测脾淋巴细胞的杀伤肿瘤活性
取NH-TCL负载DC、LH-TCL负载DC,按照DC:脾细胞为1∶0.5共培养24 h,收集脾细胞并计数,配成含量为5×106/mL单细胞悬液,将NH-TCL负载DC激活的脾细胞(DC:NH-TCL组,DC细胞数:脾细胞(Sp)数分别为1∶0.5)或LH-TCL负载DC激活的脾细胞(DC:LHTCL组,DC细胞数:脾细胞(Sp)数分别为1∶0.5)作为效应细胞,分别同Lewis肺癌细胞(靶细胞)共孵育,此2组为实验组;另外单独加入未激活DC刺激的脾细胞和Lewis肺癌细胞共孵育,此为对照组。每组设3复孔,并建立5∶1、10∶1、20∶1三个效靶比。放置37 ℃、5%CO2孵箱中继续培养48 h,Lewis肺癌细胞为贴壁细胞,脾细胞和DC为悬浮细胞,故混合测定时,脾细胞和DC都悬浮于培养液中,弃去培养液。仅测定皿底的贴壁细胞即Lewis 肺癌细胞的细胞毒性。离心弃上清,每孔加CCK-8 试液10 μL,放置37 ℃、5%CO2孵箱中培养4 h。用酶标仪570 nm 测A值,记录实验结果,实验重复3次。计算脾淋巴细胞的杀伤活性,计算公式为:
1.9 肿瘤模型的建立及抗肿瘤实验
5~6 周龄雄性C57/BL6小鼠40只,随机分为4组,每组10只,分组如下:未活化DC组(DC组)、NH-TCL活化的DC组(NH-TCL组,DC细胞数:制备裂解物的Lewis肺癌细胞数为1∶0.5)、LH-TCL活化的DC组(LHTCL组,DC细胞数:制备裂解物的Lewis肺癌细胞数为1∶0.5)及PBS对照组。由于腋下血管及淋巴结丰富,使得DC易于进入小鼠全身血液循环及淋巴系统,激活免疫细胞清除肿瘤细胞。故采取每只小鼠左侧腋部皮下注射100 μL细胞悬液(含8×105个Lewis肺癌细胞)。
在肿瘤接种后的第3、7、13 天于小鼠右腋皮下进行免疫,每次100 μL(含4×105个DC细胞)。观察肿瘤生长情况,记录出瘤时间,以左腋下触及结节状组织为准。出瘤后隔日测量1次体积,用游标卡尺量出各瘤体的最长径a(cm)和最短径b(cm),计算体积V=1/2(a×b2)。于最后1次免疫7 d后断颈处死小鼠,取出肿瘤组织,并记录体积大小。
1.10 统计学处理
应用SPSS26.0软件对数据进行分析。计量资料使用均数±标准差表示,多组之间的两两比较可采用LSD法,多组之间的比较可运用单因素方差进行分析;计数资料采用%(n)表示,采用χ2检验进行组间比较。P<0.05为差异有统计学意义。
2 结果
2.1 DC体外诱导
冲洗骨髓腔获取的DC,经mrGM-CSF处理7 d后,显微镜下观察:细胞形态具有多形性,附壁时伸出“树突样”突起(图1B)。收集该类细胞,用流式细胞仪检测DC细胞表面分子,结果显示,第7天DC表面CD11b、CD11c 的表达明显上调,其表达率为66.1%(图1A)。
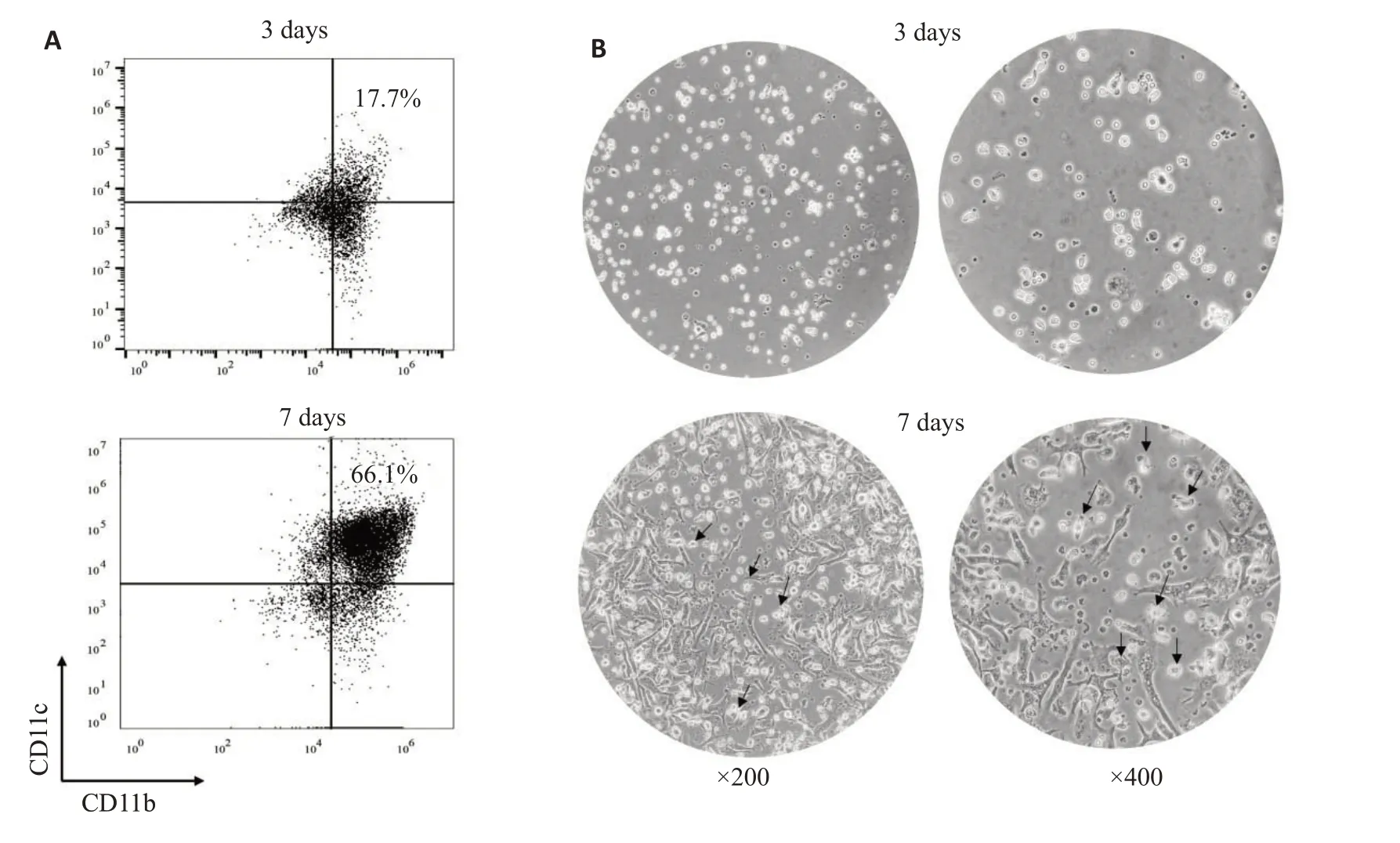
图1 DC的体外诱导Fig.1 In vitro induction of mouse dendritic cells(DCs).A:Detection of surface molecules (CD11b and CD11c)on DCs.B:Morphology of DCs on days 3 and 7 of culture.The DCs grow dendritic protrusions on day 7.
2.2 抑制肺癌细胞中HMGB1的表达
使用Western blot方法检测细胞中HMGB1表达情况。结果显示,Lewis肺癌细胞中HMGB1有较高水平的表达(图2A)。不同浓度HMGB1 抑制剂甘草酸(GA)作用于Lewis肺癌细胞48 h后,HMGB1的表达随GA浓度的增高逐渐下降,呈明显的剂量依赖(图2B)(P<0.05)。在后续实验中,我们选择30 nmol/L 这一剂量抑制Lewis 肺癌细胞中HMGB1的表达,然后使用这种低表达HMGB1的肺癌细胞制备TCL,此为低含量HMGB1的Lewis肺癌TCL。
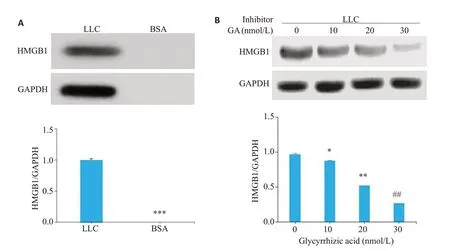
图2 抑制肺癌细胞中HMGB1的表达Fig.2 Inhibition of HMGB1 expression in Lewis lung cancer (LLC) cells.A: Detection of HMGB1 expression in LLC cells by Western blotting.B:With the increase of GA concentration,HMGB1 expression in LLC cells decreases at 48 h after treatment.***P<0.001 vs BSA;*P<0.05,**P<0.0,##P<0.001 vs 0 nmol/L.
2.3 TCL中HMGB1对DC凋亡的影响
流式细胞术检测TCL作用后DC凋亡情况。和对照组相比,NH-TCL直接作用的DC,在DC:NH-TCL为1∶0.25和1∶0.5时,DC的凋亡出现显著增加(P<0.05)。而用LH-TCL作用DC后,DC的凋亡明显下降,在DC:LHTCL为1∶0.25和1∶0.5时差异有统计学意义(P<0.001,图3)。
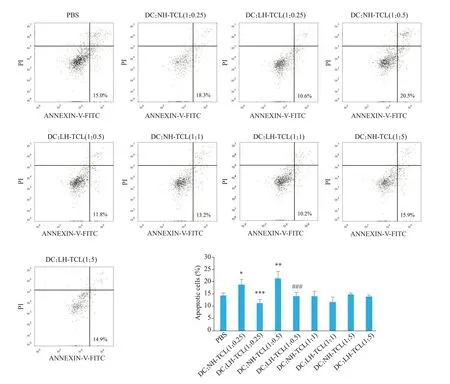
图3 TCL中HMGB1对DC凋亡的影响Fig.3 Effect of HMGB1 inhibition in TCL on DC apoptosis detected by flow cytometry.*P<0.05,**P<0.01 vs PBS;***P<0.001 vs DC:NH-TCL(1:0.25);###P<0.001 vs DC:NH-TCL(1:0.5).
2.4 LH-TCL对DC的活化
LH-TCL 作用DC 后,DC 表面分子CD86 的表达都上调,以DC∶LH-TCL为1∶0.5时差异最为显著(P<0.01)。此外,ELISA检测显示,LH-TCL作用DC后,细胞因子IL-12的分泌水平显著增加(P<0.01,图4)。
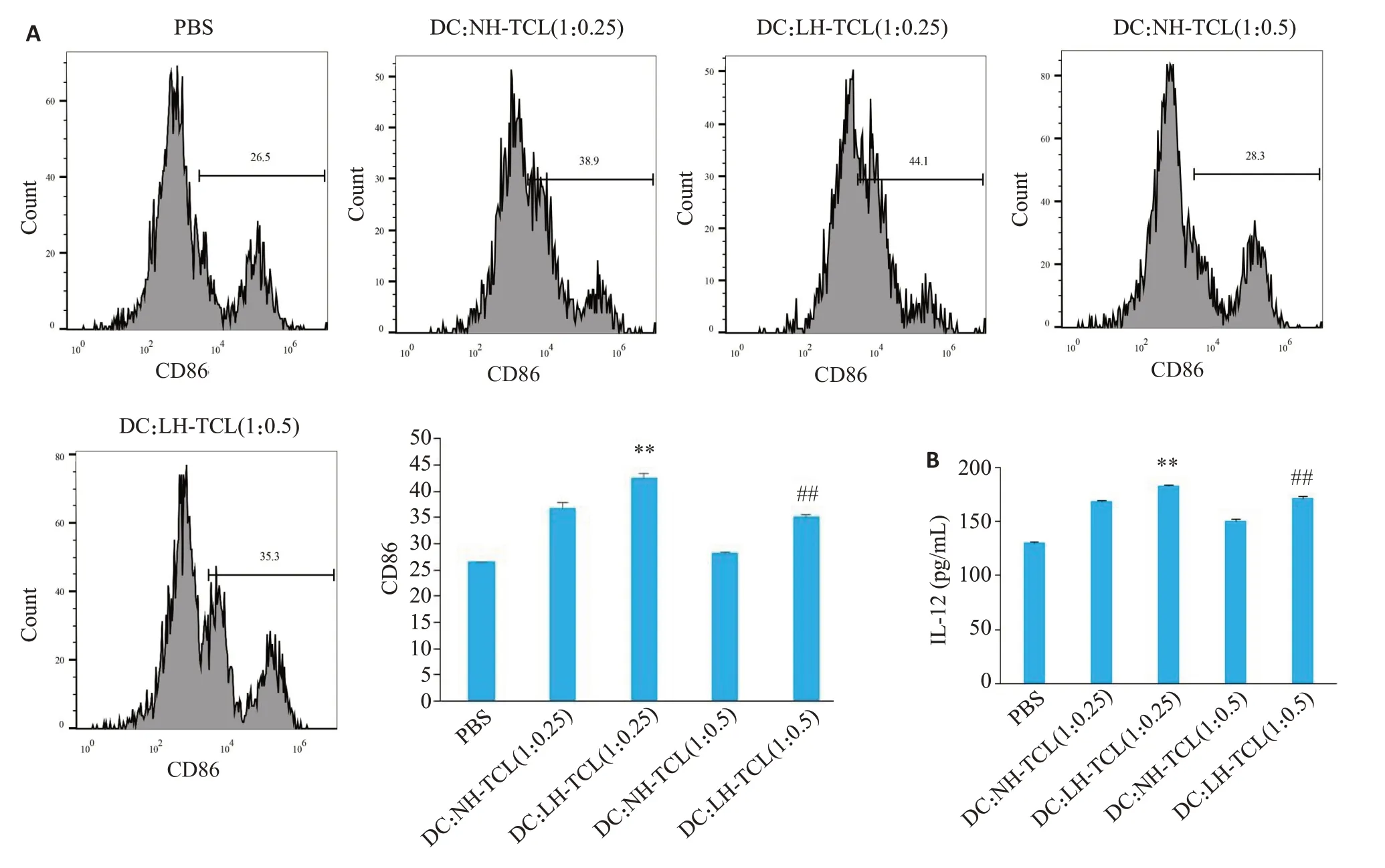
图4 LH-TCL对DC的活化Fig.4 Activation of the DCs by LH-TCL.A:Expression of CD86 on DCs detected by flow cytometry.**P<0.01 vs DC:NH-TCL(1:0.25);##P<0.01 vs DC:NH-TCL(1:0.5).B:IL-12 secretion by the DCs detected using ELISA.**P<0.01 vs DC:NH-TCL(1:0.25);##P<0.01 vs DC:NH-TCL(1:0.5).
2.5 LH-TCL 对淋巴细胞的活化
DC经NH-TCL处理后,不能有效刺激脾淋巴细胞活化,脾淋巴细胞的活性甚至有所降低,而经LH-TCL作用后的DC,其激活脾淋巴细胞的能力会得到显著增强。在DC:脾细胞为1∶0.5 时,脾淋巴细胞TNF-β平均分泌量为32.52 pg/mL,在DC∶脾细胞为1∶5时,脾淋巴细胞TNF-β平均分泌量为29.98 pg/mL,显著高于NH-TCL负载DC所激活的脾淋巴细胞TNF-β分泌量(P<0.05,图5)。
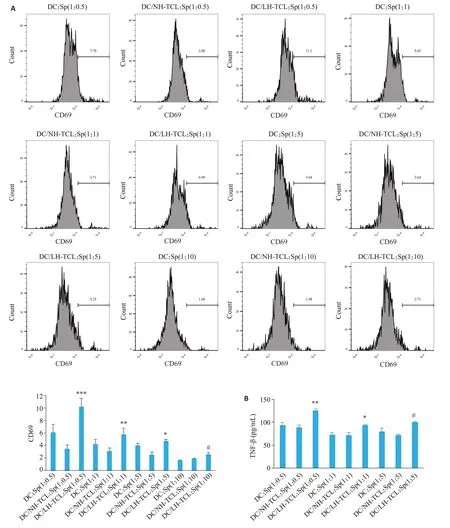
图5 LH-TCL对脾淋巴细胞的活化Fig.5 Spleen lymphocytes activation by LH-TCL.A:Flow cytometry for detecting CD69 expression on T cells.The DCs stimulated with LH-TCL more effectively induced lymphocyte activation than NH-TCL-stimulated DCs (***P<0.001,**P<0.01,*P<0.05,#P<0.05 vs DC:Sp).B: Results of ELISA showing significantly increased TNF-β production by the lymphocytes activated by LH-TCL-stimulated DCs(**P<0.01,*P<0.05,#P<0.05 vs DC:Sp).
2.6 LH-TCL诱导DC激活脾细胞杀伤Lewis肺癌细胞
LH-TCL负载DC所激活的脾细胞对Lewis肺癌细胞的杀伤活性显著提高。在效靶比为5∶1、10∶1、20∶1时,杀伤率均显著高于NH-TCL负载DC所激活的脾细胞杀伤率(P<0.01,图6)。
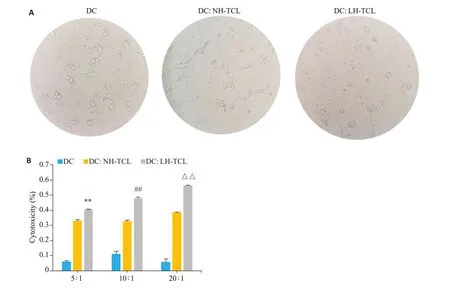
图6 负载LH-TCL的DC激活脾细胞杀伤Lewis肺癌细胞Fig.6 DCs stimulated with LH-TCL activates mouse splenocytes to kill LLC cells in vitro.A:Morphology of LLC cells incubated with the activated splenocytes (×200).B:Comparison of the killing rate of LLC cells by the spleen lymphocytes activated by DCs stimulated with LH-TCL and NH-TCL.**P<0.01 vs DC:NH-TCL(5:1);##P<0.01 vs DC:NH-TCL(10:1);△△P<0.01 vs DC:NH-TCL(20:1).
2.7 DC负载LH-TCL能更为有效的激活抗肿瘤免疫作用抑制小鼠体内Lewis肺癌细胞移植瘤的生长
移植瘤的体积测量结果见图7,各组移植瘤体积逐渐增加,但负载LH-TCL的DC 免疫组,肿瘤体积显著小于PBS组、DC组、NH-TCL组(P<0.05)。在第20天时,LH-TCL 负载DC 免疫组肿瘤组织体积平均为997.27 mm3,显著小于其它组肿瘤组织体积(P<0.05)。

图7 LH-TCL抑制Lewis肺癌细胞移植瘤的生长Fig.7 Injection of LH-TCL-stimulated DCs suppresses growth of transplanted LLC xenografts in mice.A:Growth curves of the mean tumor volume in different groups.B:Tumor tissues dissected from of the mice in different groups at the end of the experiment.*P<0.05 vs DC;#P<0.05 vs NH-TCL.
3 讨论
本研究用Lewis肺癌细胞制备TCL,将TCL中的HMGB1蛋白下调,探讨LH-TCL对树突状细胞抗肺癌作用的影响。我们发现LH-TCL诱导DC凋亡的能力减弱,促进其活化的能力增强。负载LH-TCL的DC能更好的活化小鼠脾细胞,并由此产生更强的抗肺癌细胞免疫作用。
本研究中所用的Lewis肺癌细胞中,HMGB1有较高水平的表达。HMGB1表达于真核细胞核内,调控某些与肿瘤发生相关的基因转录时起作用,如胰岛素受体、TNF-α等[21,22]释放到细胞外的HMGB1可促进肿瘤细胞的生长、侵袭和转移[23]。HMGB1在多种肿瘤细胞中过量表达,特别在肝癌、结肠直肠癌、胰腺癌、肺癌等[15]肿瘤中较为常见。研究发现HMGB1可通过诱导免疫细胞凋亡而抑制对肿瘤细胞的清除作用[24]。本研究中出现了类似的情况,Lewis肺癌细胞制备的TCL在适当的比例下可诱导DC细胞凋亡。DC是免疫系统中抗原提呈能力最强的细胞,尤其是抗肿瘤免疫的启动,需要DC对肿瘤抗原进行有效提呈[25]。而DC细胞的凋亡会使得抗原提呈不足,由抗原刺激产生的适应性免疫应答减弱,能被TCL中肿瘤抗原激活的免疫细胞数量大大减少,生成的具有抗肿瘤作用的细胞数量也会下降,这些都不利于机体抗肿瘤作用的产生[26]。因此,降低TCL中的HMGB1含量,显得非常重要。目前,临床上采用的DC过继免疫细胞疗法,其肿瘤治疗效果需要进一步提高[27]。该治疗方法在实施时,常用TCL负载DC,如能通过减少HMGB1,进而降低TCL对DC的凋亡诱导作用,将有利于DC过继免疫细胞疗法产生更强的抗肿瘤效果。
为了提高TCL对DC的免疫刺激活性,本研究将HMGB1抑制剂甘草酸(GA)作用于Lewis肺癌细胞,使用Western blot方法检测,结果发现,Lewis肺癌细胞中HMGB1有较高水平的表达。不同浓度HMGB1抑制剂甘草酸(GA)作用于Lewis肺癌细胞后,HMGB1的表达随GA浓度的增高逐渐下降,呈明显的剂量依赖。
用LH-TCL作用于DC,结果显示,和对照组相比DC的凋亡出现明显下降,同时我们也检测了DC活化的表面标志分子CD86,其含量在受刺激后表达上调,接下来用ELISA方法检测了细胞因子IL-12的分泌量,其分泌水平显著增加,这些结果都说明,LH-TCL可促进DC的活化,其抗原提呈功能显著增强,进而影响淋巴细胞介导的特异性细胞免疫应答发生。此外,TCL 中HMGB1 的减少可以使DC 的凋亡出现下降,这说明HMGB1能诱导DC发生凋亡。由于TCL可以模拟肿瘤细胞破裂释放的细胞内物质,因此,上述现象也可以说明:在肿瘤微环境中肿瘤细胞产生的HMGB1可以诱导DC凋亡,这使得DC难以作为抗原提呈细胞有效激活抗肿瘤免疫应答,从而会促进肿瘤的发生发展。目前,HMGB1同肿瘤相关性研究,多集中在HMGB1对肿瘤细胞本身的影响[28,29]。而我们的发现拓展了HMGB1的生物学功能,证明了HMGB1对免疫细胞也存在抑制作用。
为了进一步研究TCL活化后的DC对淋巴细胞的活化作用,我们用流式细胞术检测小鼠脾细胞表面CD69的表达及TNF-β的分泌。结果显示,DC经NHTCL处理后,不能有效刺激脾淋巴细胞活化,甚至会使脾淋巴细胞的活性降低,而LH-TCL负载的DC,其激活脾淋巴细胞的能力会得到显著增强。脾细胞中存在T淋巴细胞,这部分被有效活化的T细胞将发挥杀伤肿瘤细胞的作用[30]。
我们通过体内、体外实验验证了用LH-TCL负载DC能通过活化脾淋巴细胞,在体外更好的杀伤Lewis肺癌细胞,并在小鼠体内抑制Lewis肺癌细胞移植瘤的生长。这说明从TCL中去除HMGB1后再负载DC,可以有效增强DC的抗肺癌功能,结合前面的CD69表达和TNF-β分泌上调的结果,我们认为,去除HMGB1的TCL作为DC激活剂能诱导更强的抗肿瘤免疫作用。当前,DC过继免疫治疗在实际应用中,往往会出现TCL负载的DC活性不足、抗肿瘤效果有待增强的问题,而我们的发现将有助于这一问题的解决[31,32]。
综上,本研究发现TCL中的HMGB1会诱导DC凋亡和功能的抑制,下调HMGB1的TCL具有更强的激活DC能力,DC诱导抗肺癌免疫应答的功能由此增强。这一发现证明了减少TCL中的免疫抑制成分,有助于提高TCL本身的免疫活性,藉此可以改善DC过继免疫细胞治疗的抗肿瘤效果。
- 南方医科大学学报的其它文章
- 东革阿里抗炎的物质基础及其作用机制:基于UPLC-Q-TOFMS/MS和网络药理学方法
- 《南方医科大学学报》荣获2021年“百种中国杰出学术期刊”称号
- Cordycepin,a metabolite of Cordyceps militaris,inhibits xenograft tumor growth of tongue squamous cell carcinoma in nude mice
- Notch 信号通路抑制剂DAPT 改善酒精诱导的斑马鱼神经元分化障碍
- 6 条目孤独感量表(ULS-6)是测量中国成年人群孤独感的有效工具
- 乙酰紫堇灵促进大鼠脊髓损伤后的功能恢复:基于调控EGFR/MAPK信号通路抑制小胶质细胞活化

