神经内镜和显微镜下微创血肿清除术治疗基底核区脑出血患者的临床价值
许耀伟,李永明,左敏现,刘琴
1.洛阳市中医院神经外科,河南 洛阳 471000;
2.河南省人民医院神经外科,河南 郑州 450000;
3.商丘市第一人民医院门诊科,河南 商丘 476000
脑出血是临床常见急重症,占脑卒中患者的10%~20%,发病率随着社会发展呈增长趋势且趋于年轻化[1]。50%的脑出血位于基底核区,致残率、致死率较高。相关研究表明,脑出血短期死亡率为20%~60%,10年生存率为24%,已成为临床医学关注的公共健康问题[2]。手术是常用且有效的治疗方案,开放性外科手术虽然能有效清除颅内的血肿,但组织分离严重,术中出血多,术后并发症不易控制[3]。随着医疗技术、医疗器械发展,微创手术以创伤轻微、术后恢复迅速等优势取代开放手术成为主要治疗方案。目前微创手术呈现多元化,神经内镜下血肿清除术和显微镜下血肿清除术是常见微创术式,不同术式治疗结局存在差异,何种术式为脑出血患者最佳治疗方案目前尚无定论[4-5]。本研究旨在通过比较神经内镜和显微镜下血肿清除术在基底核区脑出血治疗中的临床效果,以期为基底核区脑出血患者的手术方式选择提供理论依据。
1 资料与方法
1.1 一般资料 本研究经我院医学伦理委员会批准,选择洛阳市中医院2020年1月至2022年1月收治的78 例基底核区脑出血患者作为研究对象。(1)纳入标准:符合脑出血的相关诊断标准[6],且经影像CT检查出血位置为基底核区;明确高血压病史;均为初发、初治患者;发病24 h内入院;发病至入院后病情未出现急性恶化;具有手术指征;血肿体积30~60 mL;患者家属同意实施手术治疗,面签同意书。(2)排除标准:发生脑死亡者;颅内多发出血者;合并脑动脉瘤、血管畸形、脑疝、颅外伤引起的脑出血者;心、肝、肾功能障碍者;高血压控制欠佳者;合并凝血功能、免疫功能障碍者;出血形态不规则者。按随机数表法将患者分为神经神经内镜组和显微镜组,每组39例。两组患者的基线资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。
表1 两组患者的基线资料比较[,例(%)]Table 1 Comparison of baseline data between the neuroendoscope group and microscope group[,n(%)]
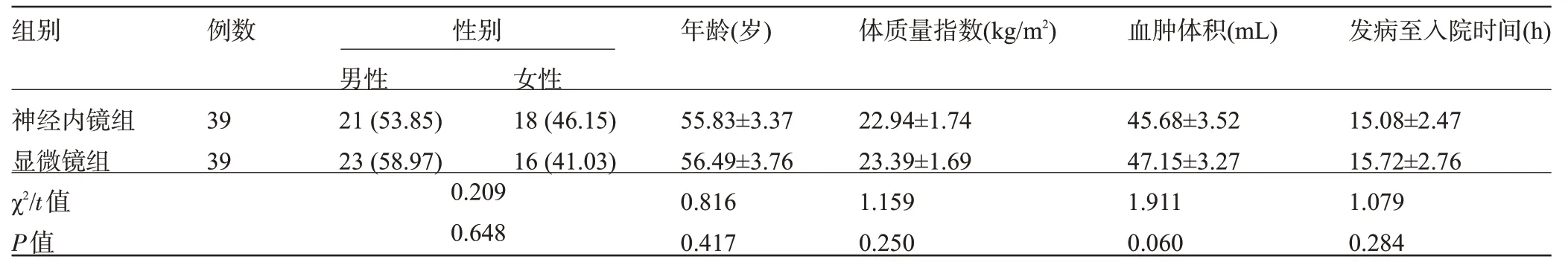
表1 两组患者的基线资料比较[,例(%)]Table 1 Comparison of baseline data between the neuroendoscope group and microscope group[,n(%)]
?
1.2 手术方法
1.2.1 术前准备 (1)检查:术前完善心电监护、血常规、血型等常规检查;采用X 线机进行颅扫描确定血肿位置并于体表标记。(2)干预措施:吸氧、颅内降压、控制血压等。(3)操作仪器:神经外科内窥镜(公司:Aesculap-AG,规格:PE184A)、手术显微镜(公司:Carl Zeiss Meditec AG,规格:OPMI Lumerai)、脑用咬骨钳(公司:上海医疗器械有限公司,规格:单关节、双关节)、电动吸引器Medical Suction Unit (公司:OSCAR BOSCAROL S.R.L.,规格:OB 2012 LINER)、X射线计算机体层摄影装置(公司:沈阳东软医疗系统有限公司,规格:NeuViz Dual)、颅内压测量装置及引流导管(公司:大正公司,规格:ICP-2)。两组患者均由同一组高年资手术团队于无菌环境实施手术。
1.2.2 神经内镜组 该组患者实施神经内镜下微创血肿清除术。具体操作:手术全麻,平卧位;术前,采用神经导航系统进行手术入路规划,采取额部Kocher 点入路行4~5 cm 直切口,分离皮下组织;向两侧牵拉组织,充分暴露颅骨;在血肿所在侧额部钻孔,采用铣刀游离骨瓣,创建直径约2 cm 骨窗;甘露醇降低颅内压,骨窗周边剪开,悬吊硬脑膜,释放部分脑脊液;将骨窗中心作为穿刺孔,透明导管鞘穿刺至血肿位置,退出鞘芯;神经内镜下清除视野内血肿,分离血肿块与黏连脑组织;如发生渗血或活动性出血,则采用双极电凝止血,止血纱布覆盖创面;调整鞘筒角度,边退鞘筒边清除剩余血肿;内镜下确认血肿完全清除后,生理盐水冲洗血肿腔;明胶海绵覆盖残壁腔;置入引流管,常规关闭切口。
1.2.3 显微镜组 该组患者实施显微镜下微创血肿清除术。具体操作:患者麻醉、术区处理同神经内镜组;依据标记点横跨侧裂行4~5 cm弧形切口;以铣刀建立2.5~3 cm骨窗;同神经内镜组一样采用甘露醇控制颅内压;弧形切口将硬脑膜剪开,悬吊四周;在显微镜下将外侧裂池进行分离,释放脑脊液;剥离侧裂沟,剪开岛叶进入血肿腔;显微镜下采用电动吸引器清除血肿;电凝止血,确认无活动出血,清理血肿腔,止血纱布覆盖创面,引流管置入后将切口关闭,手术完成。
1.2.4 术后干预 术后所有患者转至神经外科重症监护室,监测生命体征。降血压、降颅内压、补水、补充营养、抗感染等对症干预治疗。术后复查CT,术后3~5 d拔除引流管。
1.3 观察指标与评价(检测)方法 (1)手术指标:手术时长、术中总出血量、手术切开长度、总住院天数、血肿清除率。血肿清除率(%)=(术前血肿的体积-术后血肿的体积)/术前血肿的体积×100%。(2)术后并发症:颅内感染、再出血、脑脊液漏、脑梗死。(3)氧化应激指标:术前、术后3 d、7 d,采集患者静脉血5 mL,3 500 r/min 离心10 cm,取上层血清,-80℃储存待检。采用比色法测定血清谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)、超氧化物歧化酶(SOD)水平。(4)神经缺损程度、昏迷情况:术前和术后6 个月,采用美国的国立卫生院卒中评分量表(NIHSS)评价患者神经缺损的程度,评分范围:0~42分,得分与神经缺损程度呈正相关;格拉斯哥昏迷评分量表(GCS)评估患者的昏迷状况,评分范围:3~15 分,昏迷:≤8 分,中度意识障碍:9~11分,轻度意识障碍:12~14分。(5)预后优良率:术后6个月,格拉斯哥预后评分量表(GOS)评价预后的优良率,评分范围:1~5 分。优:5分,患者恢复正常生活;良:4分,轻度残疾,可独立生活,且在保护下工作;差:≤3分,中度残疾、植物人状态或死亡。
1.4 统计学方法 应用SPSS22.0 统计软件分析数据。计数资料比较行χ2检验;计量资料符合正态分布且方差齐,以均数±标准差()表示,两组间比较采用独立样本t检验,组内手术前后比较采用配对样本t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 两组患者的手术指标比较 两组患者手术过程、住院期间、随访期间均未发生死亡。神经内镜组患者的手术时间、手术切开长度、总住院天数明显短于显微镜组,术中总出血量明显少于显微镜组,血肿清除率明显高于显微镜组,差异均具有统计学意义(P<0.05),见表2。
表2 两组患者的手术指标比较()Table 2 Comparison of surgical indicators between the two groups()
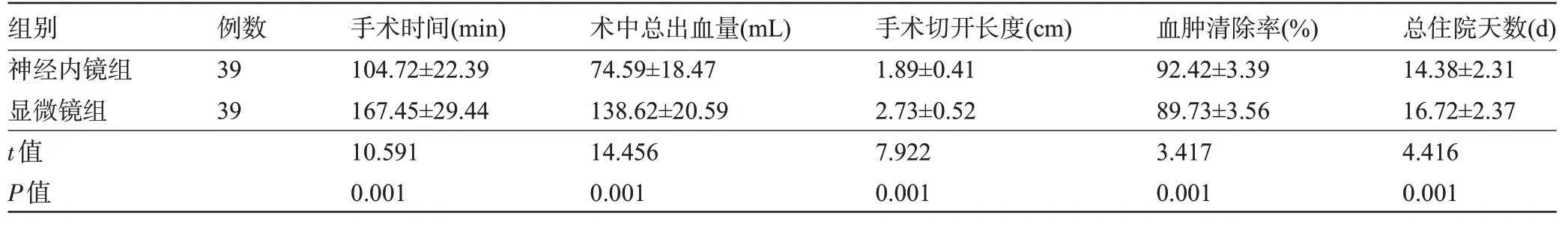
表2 两组患者的手术指标比较()Table 2 Comparison of surgical indicators between the two groups()
?
2.2 两组患者的术后并发症比较 神经内镜组患者的术后并发症发生率为10.26%,略低于显微镜组的17.95%,但差异无统计学意义(χ2=0.953,P=0.329>0.05),见表3。

表3 两组患者的术后并发症比较(例)Table 3 Comparison of post-operation complications between the two groups(n)
2.3 两组患者手术前后的氧化应激指标比较 术后3 d、7 d,两组患者的SOD、GSH-Px 水平先升高后降低,MDA 水平先降低后升高,且神经内镜组SOD、GSH-Px 水平高于显微镜组,MDA 水平低于显微镜组,差异均具统计学意义(P<0.05),见表4。
表4 两组患者手术前后的氧化应激指标比较()Table 4 Comparison of oxidative stress indicators between the two groups before and after surgery()
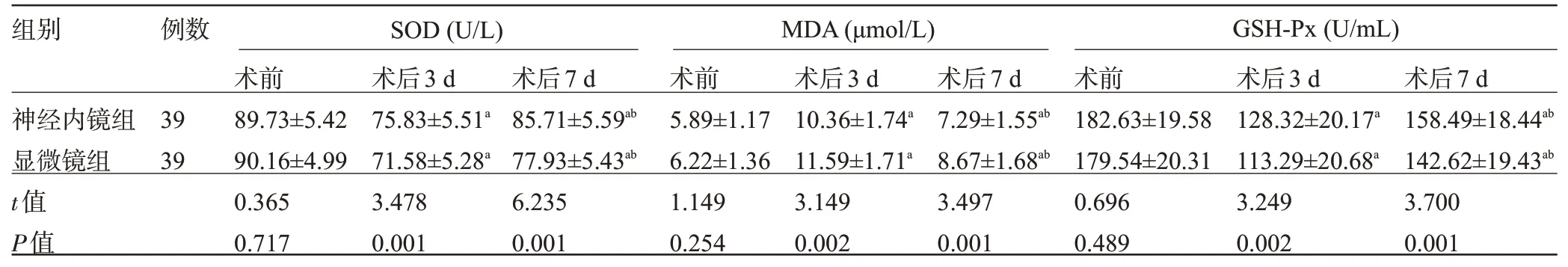
表4 两组患者手术前后的氧化应激指标比较()Table 4 Comparison of oxidative stress indicators between the two groups before and after surgery()
注:与同组术前比较,aP<0.05;与同组术后3 d比较,bP<0.05。Note:Compared with that in the same group before surgery,aP<<0.05;Compared with that in the same group 3 days after surgery,bP<0.05.
?
2.4 两组患者手术前后的神经缺损程度、昏迷情况比较 术前,两组患者的NIHSS 评分、GCS 评分比较差异均无统计学意义(P>0.05);术后6 个月,两组患者的NIHSS 评分低于术前,GCS 评分高于术前,且神经内镜组患者的NIHSS 评分明显低于显微镜组,GCS 评分明显高于显微镜组,差异均具有统计学意义(P<0.05),见表5。
表5 两组患者手术前后的NIHSS、GCS评分比较(,分)Table 5 Comparison of NIHSS and GCS scores between the two groups before and after surgery(,points)

表5 两组患者手术前后的NIHSS、GCS评分比较(,分)Table 5 Comparison of NIHSS and GCS scores between the two groups before and after surgery(,points)
注:与同组术前比较,aP<0.05。Note:Compared with that in the same group before surgery,aP<0.05.
?
2.5 两组患者术后6个月的预后优良率比较 术后6个月,神经内镜组患者的优良率为92.31%,略高于显微镜组的76.92%,但差异无统计学意义(χ2=3.545,P=0.060>0.05),见表6。
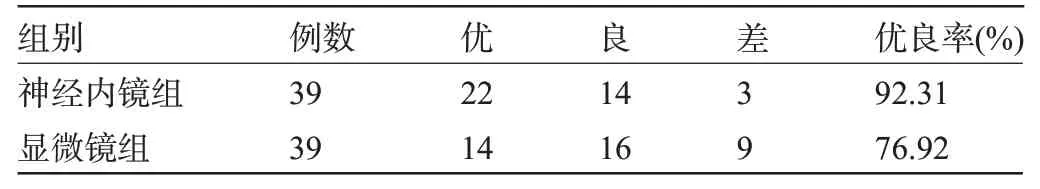
表6 两组患者术后6个月的预后优良率比较(例)Table 6 Comparison of excellent prognosis rates between the two groups 6 months after surgery(n)
3 讨论
基底核区发生出血会损伤神经功能,导致感觉、认知、语言等功能性障碍,重者可致患者死亡[7-8]。外科手术是主要治疗方案,可尽快清除血肿,有效降低/控制颅内压,减轻对脑部组织的损伤,改善患者的生存质量。但开放手术创伤较大、并发症风险高,不利于术后恢复。随着医疗技术发展,脑出血外科治疗步入微创时代。目前,脑出血微创手术方案较多,如神经内镜下MIHR 术、显微镜下MIHR 术等。但目前上述两种手术的效果尚存在较大争议。
本研究结果显示,两组患者的术后并发症发生率和术后6 个月预后优良率比较差异无统计学意义(P>0.05),但神经内镜组患者的手术时长、手术切开长度、总住院天数明显短于显微镜组,术中总出血量明显少于显微镜组,血肿清除率明显高于显微镜组,差异有统计学意义(P<0.05),与廖云等[9]、朱鹏飞[10]研究结果基本一致,表明神经内镜下和显微镜下进行MIHR 术均具有较好的预后效果,并发症发生率均较低,均具有较高的安全性。但行神经内镜下MIHR术的患者手术用时更短,术中出血量更少,血肿清除率也更高,创伤更轻、术后恢复更快。可能是因为显微镜下MIHR术虽能清除血肿,改善患者预后,但手术时极易形成视野盲区,术区照明条件较差,导致手术耗时更长,出血量更大,血肿清除不够彻底[11]。而神经内镜下MIHR术在术前可采用神经导航系统进行手术入路规划,操作灵活,深部照明效果好,术野更清晰,可显著提高颅内血肿清除率,且能对血肿腔彻底止血,减少术中总出血量,缩短手术用时,还能有效避免继发性病理损伤[12]。
相关研究表明,氧化应激一方面可反映脑部组织的损伤程度,另一方面还与患者预后恢复质量密切相关[13-14]。MDA是脂质过氧化产物,可评估机体活性氧浓度,与机体氧化应激反应程度密切相关。GSH-Px、SOD 为抗氧化酶,可清除氧自由基,是机体抗氧化应激反应损伤主要防御力量[15-16]。本研究结果显示,术后3 d、7 d,神经内镜组患者的SOD、GSH-Px水平明显高于显微镜组,MDA水平明显低于显微镜组,差异有统计学意义(P<0.05),提示神经内镜下MIHR 术可一定程度上减轻机体的氧化应激反应,减轻对脑组织的损伤,有助于术后快速恢复。可能原因为,神经内镜下MIHR术可通过神经导航系统引导规划更合适的手术路径,手术精细程度更高,且术野更好,手术照明更清晰,可减少因过度分离组织引发损伤,减少术中总出血量,缩短手术用时,提升脑部血肿的清除率,手术创伤更轻。
本研究结果还显示,术后6个月,神经内镜组患者的NIHSS评分明显低于显微镜组,GCS评分明显高于显微镜组,差异均有统计学意义(P<0.05),提示神经内镜下MIHR术能显著减轻患者脑部神经功能的损伤,降低患者昏迷风险。分析原因认为:神经内镜下MIHR术可提前通过神经导航系统规划手术路径,可减轻脑组织机械性损伤,同时提高血肿清除率,减轻血肿对周围脑组织压迫,避免缺血缺氧引起的继发性神经功能损伤,更有助于术后神经功能恢复,降低昏迷的发生风险。
综上所述,与显微镜下MIHR术比较,神经内镜下MIHR术治疗基底核区脑出血患者是安全可靠的治疗方式,更能优化手术路径,减轻组织分离,提高血肿清除效果,抑制氧化应激反应,有助于术后恢复,减轻神经损伤程度,降低昏迷风险。但本研究样本量较小,且样本来源单一,远期疗效尚未明确,期待下一步开展多中心、大样本、远期疗效的研究,为临床基底核区脑出血患者手术选择提供更科学、合理的数据支持。

