盐溶液蒸干的实验改进
郭科 胡源龙 曾艳 汪灵娇
摘要:针对常规盐溶液蒸发实验存在加热时间过长的问题,结合相关教学需求,设计以具支试管作为加热蒸发主体部分的一套装置。该装置在具支试管底部放置一大药匙的白色硅藻土以吸附盐溶液,在试管的支管口放置pH试纸以检验是否有易挥发酸的产生。改进后的实验装置在1分钟内即可观察到相关的实验现象,药品用量少,污染也少,具有较好的教学适用性。
关键词:盐类水解;盐溶液蒸干;实验改进;实验探究
文章编号:10056629(2023)06006004中图分类号:G633.8文献标识码:B
1 问题的提出
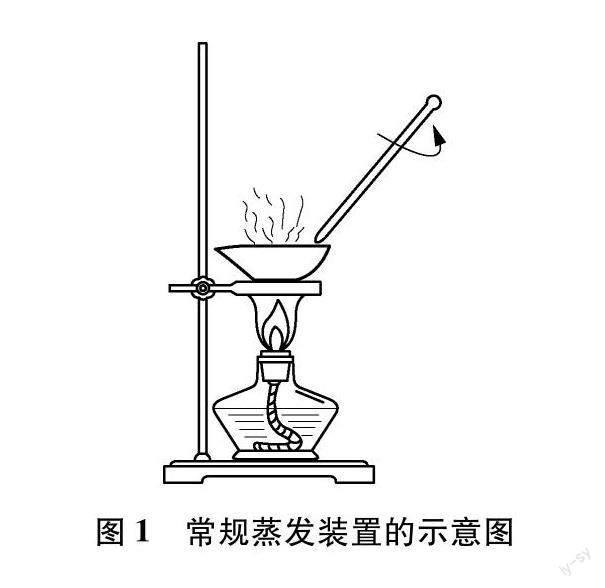
盐类水解原理在盐类物质的实际工业生产中具有重要价值,而“盐溶液蒸干产物的判断”实验便是其在中学教学中的重要衔接点。针对该部分内容,普通高中化学课程标准提示我们:需要关注水溶液体系的特点,结合实验现象、数据等证据素材,引导学生形成认识水溶液中离子反应与平衡的基本思路[1]。在实际教学过程中,我们常常引导学生进行理论推导和分析,却很少进行该实验。究其原因,可能是因为:(1)教材上未给出该实验相应的具体操作;(2)采用常规的蒸发装置(见图1)进行实验存在操作繁琐、耗时过长等缺点。
基于反应原理的微观视角进行分析推理,固然能够帮助学生认识物质及其变化,但化学学科思维并不局限于微观视角,“宏观微观符号”三者之间应形成闭环;此外,教师一味地说教,无实验证据支撑,学生理解起来也比较困难。因此,本研究在梳理已有研究的基础上,针对传统盐溶液蒸干装置的不足之处进行改进,并设计相应的实验教学活动,以期能给实际的教学工作提供相应的参考。
2 文献综述
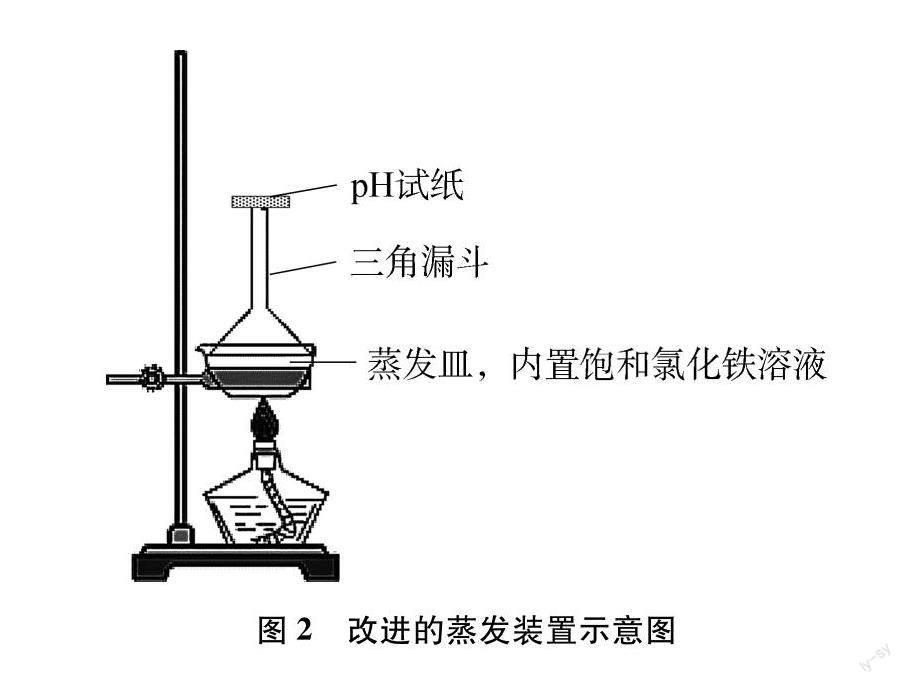
针对该实验所存在的操作繁琐、耗时过长且生成大量HCl污染教室的问题,薛贵凤老师[2]将浸泡过氯化铁溶液的粉笔置于酒精灯上灼烧,在1分钟内便观察到粉笔的颜色从黄色变为红褐色再变为铁锈色。但也发现由于酒精会热还原氧化铁,使粉笔变成黑色而干扰实验。由此,高海军老师[3]利用电炉灼烧浸有盐溶液粉笔的方法研究氯化铁及碳酸钠溶液蒸干后的产物,现象明显且操作简单。陆海燕老师[4]在传统蒸发装置的基础上添加了一个倒扣漏斗,并于漏斗口放置pH试纸,以帮助学生认识氯化铁溶液水解会生成氢氧化铁及氯化氢,如图2所示。但实验过程只观察到红棕色固体的生成,并未能如期观察到pH试纸逐渐变红的现象。
综上所述,已有研究均只探讨了氯化铁溶液的蒸干方法,且主要侧重于如何在实验过程中快速地观察到红褐色氢氧化铁的生成。有的老师还设计了对产物氯化氢的检验,但未得到预期的实验现象。因此,该系列实验仍需要就产物的显性化问题作进一步改进。
3 实验研究
实验活动的设计和学生对知识的理解是相辅相成的。学生在应用盐类水解的影响因素分析解决盐溶液蒸干问题时,反应物的性质(如盐是否会水解、水解是否会生成易挥发性物质、是否易被氧化、是否易分解等)和反应条件(如温度、浓度等)是两个非常重要的视角。所以,这理应是相关实验研究和教学设计的着力点。
铁盐和亚铁盐溶液的蒸干是建构盐溶液蒸干产物判断模型的典型事实材料。如聚焦对比氯化铁和氯化钠,可以让学生认识到盐溶液蒸干产物的判断需要考虑盐类是否会水解;聚焦对比氯化铁和硫酸铁,可以让学生认识到盐溶液蒸干产物的判断需要考虑水解产物是否受热易挥发;而聚焦对比硫酸铁和硫酸亚铁,则可以让学生进一步认识到盐溶液蒸干产物判断还需考虑物质本身是否易被氧化等。
综上,结合相关研究现状,开展了如下问题研究。
3.1 问题1:如何观察到氯化铁溶液蒸干后的产物
在加热蒸干氯化铁溶液的实验中,如何让学生觀察到红褐色氢氧化铁以及氯化氢气体的产生是学生理解反应原理的两个重要宏观现象。
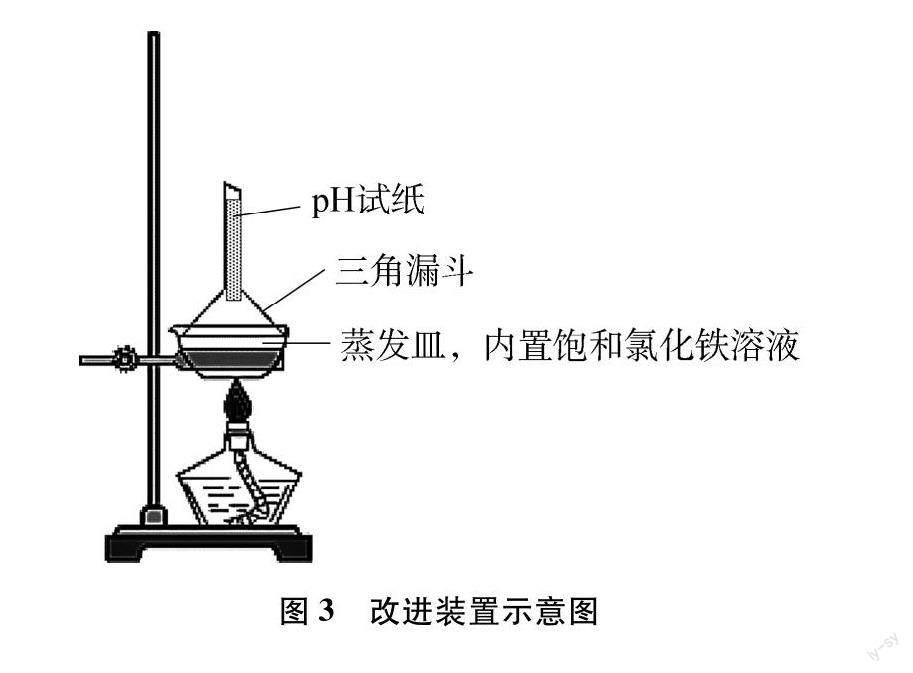
借助传统的蒸发装置对饱和氯化铁溶液进行加热蒸干,我们不难看到蒸发皿中的物质从黄棕色溶液缓慢地变成红褐色固体。由于蒸发皿是一个敞口容器,且水解产生的氯化氢气体量较少,故而借鉴图2装置,用倒扣在蒸发皿上的三角漏斗收集并检验氯化氢气体的生成。同时将pH试纸由“放置在漏斗口”改为“塞进漏斗中”,使之离蒸发皿的距离变近(如图3所示)。这样除了能观察到红褐色氢氧化铁的生成外,还能观察到在蒸干过程中pH试纸先出现小红点,然后红色范围扩大,接着红色加深的现象,从而帮助学生认识氯化氢气体的产生及其受热易挥发的性质。
3.2 问题2:如何快速地得到预期的实验现象
在加热蒸发皿进行盐溶液蒸干实验时,出现预期的实验现象所需要的时间较长,其原因可能是蒸发皿为敞口容器散热快,且加入的盐溶液体积也较大。因此,提高温度、减少盐溶液的用量、采取密闭措施等都是缩短加热时间的合理方法。
3.2.1 改进实验装置
为此最终设计了如下的实验装置,见图4。
整套装置将具支试管作为加热蒸发的主体部分,在具支试管底部放置一大药匙的白色硅藻土,在试管的支管口放置pH试纸。
3.2.2 具体实验操作
取一大药匙白色硅藻土置于具支试管底部,然后用胶头滴管向硅藻土滴加1~2mL饱和盐溶液。接着,按照图4所示装置组装好相应的实验仪器,然后加热硅藻土直至蒸干其中的盐溶液,观察实验现象。
3.2.3 相关注意事项及说明
(1) 采用白色硅藻土(即纯度较高的硅藻土),以避免底物颜色对产物颜色的观察产生干扰。
(2) 采用硅藻土而不采用湿棉花的原因:实验过程中,需要将浸有盐溶液的棉花塞到试管底部,这不可避免地会使得棉花被压成一团。研究发现,后续加热过程中,产生的热气流会推动棉花从试管底部向试管中间滑动,不易控制加热点。而硅藻土则能很好地避免这一问题,但同样需要注意的是,硅藻土也不宜取得过多,一大药匙的用量便能够取得较好的实验效果。
(3) 实验开始前需要用橡胶塞堵住具支试管口。一方面是为了让后续产生的氯化氢气流集中通过支管口,另一方面则是为了便于收集处理冷凝后的液体。
(4) 在研究过程中,使用的都是饱和盐溶液,以增加其水解程度。
3.2.4 相关实验现象及解释
结合图4装置,按3.2.2所述操作步骤展开实验,以检验该装置在教学过程中的适用性。相关实验现象记录及解释见图5。
4 实验教学活动设计
实验教学活动设计如图6所示。
5 总结与反思
改进后的实验装置具有加热时间短(一般1分钟不到即可观察到实验现象)、实验现象明显的优点,且药品用量少,产生的氯化氢气体量也少,故而造成的污染较小。但结合实际教学情况来看,该实验缺少对蒸干产物作进一步灼烧的考虑以及盐类水解后所得产物的深层次分析,后续研究可进一步对其进行完善。
参考文献:
[1]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版2020年修订)[S]. 北京: 人民教育出版社,2020: 66~67.
[2]薛桂凤. 探究氯化铁溶液灼烧的变化——探究实验课的教学设计[J]. 化学教学,2018,(2): 50~53.
[3]高海军. 巧用粉笔做盐溶液蒸干产物判定实验[EB/OL]. [20130403](20230205). https://www.docin.com/p-627970044.html.
[4]陆燕海,林肃浩. 对氯化铁溶液蒸干及灼烧后产物的探析[J]. 中学化学教学参考,2010,(5): 47~48.

