含多吡啶的铜、镍、锌配合物的合成与抗癌活性研究*
唐婉毓,何雨慧,张清茹,李子风,王淑云,付腊腊,王小波
(湖北科技学院医学部药学院,湖北 咸宁 437100)
趋化因子受体4(CXCR4)是一种七层跨膜G-蛋白偶联受体,从属于GPCR家族,而CXCL12/CXCR4在一系列疾病如癌症、炎症反应中扮演重要角色[1]。已有较多文献报道[2-4],CXCR4在多达23种癌症细胞如乳腺癌、肺癌、白血病、前列腺癌等中均过表达。第一例进入临床评估的CXCR4拮抗剂为AMD3100(商品名:普乐沙福),它的结构特征为含有2个对称的四氮杂环十四烷。以它为先导化合物,有研究团队试图通过简化环结构等方式,设计新的化合物以进一步增强与CXCR4的结合能力,同时降低合成难度与成本[5]。另外,将有机小分子与金属离子结合形成配合物,来实现上述目标也成为该领域新的研究方向之一[6]。本课题拟在吡啶的2,6位上对称性地引入二甲基吡啶胺,形成含五个吡啶环的多吡啶化合物BPA-TPA,并与过渡金属离子Zn2+、Cu2+和Ni2+形成双核配合物,研究其对癌细胞的毒活性。
1 材料与方法
1.1 主要仪器与试剂
仪器:油浴锅、旋转蒸发仪、PHS-3C型pH计、DRX-400核磁共振仪(德国Bruker公司)、LCQ电喷雾质谱仪(ThermoFisher公司)、紫外-可见分光光度计(安捷伦Cary60)、荧光分光光度计(日立F-4700)等。
试剂:2,6-二溴甲基吡啶、二甲基吡啶胺、氢氧化钠、碳酸钾、浓硫酸、Cu(NO3)2·3H2O、氯化锌和六水硝酸镍等均购于探索平台(Adamas试剂公司);小牛胸腺DNA(CT-DNA)购于索莱宝生物试剂公司。
1.2 2,6-二溴甲基吡啶的合成
取10.0g(76.7mol)2,6-二溴甲基吡啶,加入250mL的三口烧瓶中,用40%的溴化氢溶液104mL溶解,再用恒压滴液漏斗缓慢滴加浓硫酸(10mL),之后保持110℃磁力搅拌反应20h。结束后将反应冷却至室温,再继续用冰水浴冷却并缓慢加入冰的浓氢氧化钠溶液(5mol/L)调至碱性(pH=12)。抽滤,得到大量白色固体,蒸馏水洗多次后,真空干燥。以正己烷重结晶,得无色透明针状晶体,即为2,6-二溴甲基吡啶,产率12%。1H NMR(400MHz,CDCl3):δ7.74-7.70 (t,1H),7.39-7.38 (d,2H),4.55 (s,4H)。
1.3 BPA-TPA的合成
向溶有2,6-二溴甲基吡啶(1.2 g,4.5mmol)的乙腈溶液(8mL)中加入二甲基吡啶胺(DPA,1.8g,9.0mmol)乙腈溶液(16 mL),再加入碳酸钾粉末(1.5g,10.8mmol)。于35 ℃下搅拌反应2h,溶液由黄色变成橙红色。过滤,滤液旋干,得到黄褐色的油状液体。随后用石油醚多次提取(80℃下剧烈搅拌),合并石油醚提取液,静置冷却,析出白色絮状结晶。抽滤得到产物0.7g,产率23.3%。1H NMR(400MHz,CDCl3):δ 8.51(d,4H),7.60(m,9H),7.43(d,2H),7.12(m,4H),3.91(s,8H),3.89(s,4H)。13C NMR(100MHz,CDCl3) δ 159.32,158.61,149.05,136.87,136.45,123.00,122.00,121.17,60.20。ESI-MS(阳离子模式,m/z):[BPA-TPA+Na]+理论值524.25,实测值524.25。
1.4 BPA-TPA-Cu2、BPA-TPA-Ni2和BPA-TPA-Zn2的合成
取BPA-TPA102.6mg溶于40mL的无水乙醇中,再加入三水硝酸铜(106mg,0.44mmol),在75℃下反应4h,得到蓝色浑浊溶液(瓶底有部分沉淀)。冷却,抽滤,得到蓝色固体粉末即为BPA-TPA-Cu2。HRMS(阳离子模式,m/z):[(BPA-TPA-Cu2)-4NO3+2HCOO]2+理论值358.5576,实测值358.5588。见图1。
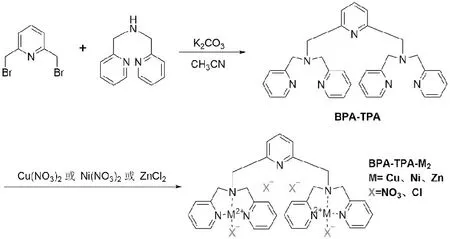
图1 配合物BPA-TPA-Cu2、BPA-TPA-Ni2和BPA-TPA-Zn2的合成路线
BPA-TPA-Ni2和BPA-TPA-Zn2的合成同BPA-TPA-Cu2,仅以六水硝酸镍和氯化锌替换三水硝酸铜,溶剂改变为甲醇。HRMS(阳离子模式,m/z):[(BPA-TPA-Ni2)-4NO3+2HCOO]2+理论值353.5645,实测值353.5638。[(BPA-TPA-Zn2)-2Cl]2+理论值350.5279,实测值350.5288。
1.5 化合物与CT-DNA的相互作用
在20mmol/L,pH=7.4的Tris-HCl缓冲液中,固定DNA的浓度(50μmol/L),取2mL置于石英比色皿中,加入EB(1mg/mL)10μL摇匀并放置3min后,逐次加入一定量的配体及配合物溶液,扫描并记录每次的荧光发射光谱。激发波长为270nm,激发和发射谱狭缝宽度均为5nm,扫描电压600V,扫描速度2400nm/min。
1.6 MTT实验
按照标准的MTT测试方法进行活性检测[7-8],分为4步:①种入细胞。在96孔板的第3~11列用排枪分别加入悬有细胞的200μL培养基,第2列作为溶剂空白,96孔板周围加培养基防止挥发,使每孔细胞数大约为1×104个,将96孔板放入37 ℃、CO2体积分数5%的培养箱中过夜,观察细胞生长情况,待80%细胞贴壁后,进行下一步。②加药。在24孔板的10个孔中各加入3mL培养基,将所加药物稀释到不同浓度梯度,用排枪将孔中原有的培养液吸掉,每一列加入相同浓度的药物,加完后,放入培养箱培养24h。③加MTT。在药物与细胞相互作用结束前4h,吸去培养液,用磷酸缓冲盐溶液(PBS)洗涤2次,然后每孔加入180μL PBS,再加入20μL 5mg/mL的MTT,放入培养箱继续培养4h。④加DMSO。4h后拿出96孔板,吸掉上清液,每孔加入150μL DMSO,放入摇床内摇10min,将紫色结晶物充分溶解,放入酶标仪卡槽内,在490nm波长处扫描,得到光密度(OD),OD可以间接地反映活细胞的数量(式1),以此即可求出半抑制浓度IC50。
R=ODexp/ODcontrol×100%
(1)
其中,R表示细胞存活率(即细胞活力),ODexp表示实验组OD,ODcontrol表示对照组OD。
2 结 果
2.1 配体及三个配合物与CT-DNA的相互作用
溴化乙锭(EB)是一种荧光染料,这种扁平分子可以嵌入DNA双链的配对碱基之间,形成EB-DNA复合物,荧光(610nm)大大增强[9-11]。当把配合物溶液滴加到EB-DNA复合物的溶液中,发现荧光逐步猝灭,说明配合物也能与DNA发生类似EB的嵌入作用。从不同配合物浓度下的EB-DNA复合体系的荧光光谱图(图2)得出,随着配体及配合物浓度的增大,EB-DNA复合物的荧光猝灭增强。其中,铜配合物BPA-TPA-Cu2的猝灭效果尤为显著。化合物对EB-DNA体系荧光的猝灭过程可由Volmer-Stern静态猝灭方程描述:I0/I=1+K[Q],其中I0和I分别为不存在和存在猝灭剂时的荧光强度,K为猝灭常数,[Q]是猝灭剂的浓度,计算得K(BPA-TPA-Cu2) = 6.2×104L/mol,表明BPA-TPA-Cu2与DNA的作用较强。
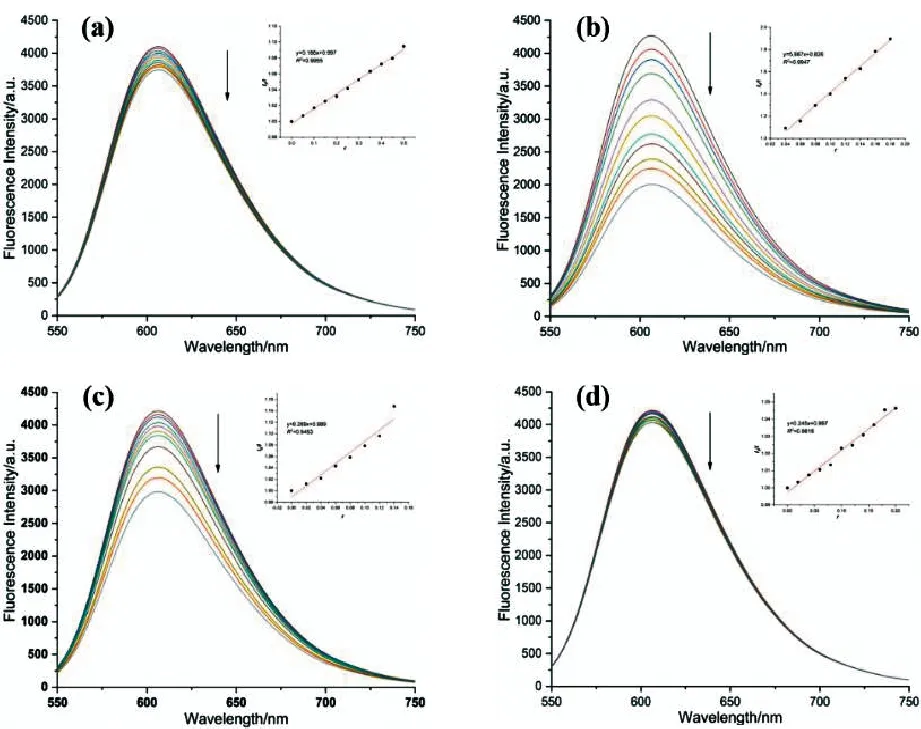
图2 配合物BPA-TPA(a)、BPA-TPA-Cu2(b) 、BPA-TPA-Ni2(c)和BPA-TPA-Zn2(d)对EB-DNA体系荧光光谱的影响(内嵌图为I0/I vs.r 作图)
2.2 配合物对癌细胞的毒活性测试
我们选择正常胶质细胞HEB为参照,系统研究了配合物BPA-TPA-Cu2、BPA-TPA-Ni2和BPA-TPA-Zn2对胰腺癌细胞株AsPC-1和胶质母细胞瘤细胞株U87的毒活性(表1)。三个配合物对正常细胞HEB的毒性较小,IC50值均大于100μmol/L。一线化疗药物顺铂对AsPC-1及U87的活性也不尽如人意,IC50值均大于100μmol/L。如图3所示,BPA-TPA-Cu2对胰腺癌细胞株AsPC-1的毒活性呈明显的浓度依赖性方式。当药物浓度为40μmol/L时,对AsPC-1的抑制率约为50%。结果表明,双核铜配合物BPA-TPA-Cu2对AsPC-1细胞表现出良好的毒活性,均明显优于含同类型配体的镍和锌配合物,且超过常用的化疗一线金属药物顺铂。对AsPC-1细胞的IC50达到了35.81μmol/L,而镍、锌配合物及对照组顺铂的IC50均大于100μmol/L,表明上述两株细胞对顺铂有一定程度的耐药,但我们制备的多吡啶类双核铜配合物BPA-TPA-Cu2具有良好的抗AsPC-1活性。
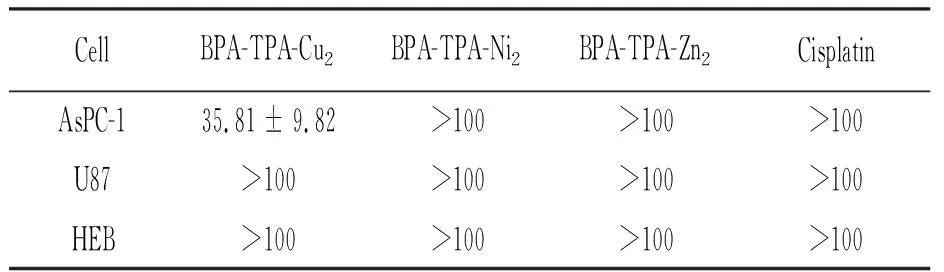
表1 三个配合物及顺铂对AsPC-1、U87和HEB的IC5024h数据汇总表(μmol/L)

图3 三个配合物BPA-TPA-Cu2、BPA-TPA-Ni2和BPA-TPA-Zn2对AsPC-1(胰腺癌)的毒活性
3 讨 论
基于经典CXCR4拮抗剂AMD3100的结构,我们设计合成了含五个吡啶单元的多吡啶类化合物BPA-TPA及相应双核过渡金属配合物BPA-TPA-Cu2、BPA-TPA-Ni2和BPA-TPA-Zn2。荧光光谱法研究表明BPA-TPA-Cu2与CT-DNA有较强的相互作用。进一步地,MTT实验表明,对于AsPC-1和U87细胞,铜配合物BPA-TPA-Cu2具有明显优于镍、锌配合物和顺铂的抑制细胞增殖能力,尤其对于AsPC-1。BPA-TPA-Cu2、BPA-TPA-Ni2和BPA-TPA-Zn2三个配合物具有完全相同的配体,仅仅只是金属元素的不同,而在抗癌活性上则表现迥异,我们推测可能与铜死亡有关。2022年3月,Tsvetkov等[12]首先提出了“铜死亡(cuproptosis)”这一全新的细胞死亡形式,它是一种铜和线粒体呼吸依赖的调控性细胞死亡形式,与其他已知的细胞凋亡、焦亡和铁死亡不同,为癌症治疗开辟了一个新的维度。铜元素作为一种重要的细胞内微量金属元素,对维持生物体内某些酶和蛋白的功能有非常重要的作用。然而,过量的铜则是有害的,并可能导致细胞死亡,其死亡机制涉及特定的线粒体代谢酶的破坏。铜与线粒体三羧酸循环的脂酰化酶结合,从而促进脂酰化酶(特别是二氢硫辛酸转乙酰酶,DLAT)的聚集,导致蛋白毒性应激,最终细胞死亡。因此,后续我们将继续研究BPA-TPA-Cu2的抗癌机理,包括探讨与CXCR4的相互作用机制,是否诱导了胰腺癌细胞的铜死亡等。

