木犀草素调控内质网应激-线粒体凋亡通路在脂毒性心肌损伤中的作用*
项 云,梁 潇,鲍翠玉,刘 涛
(1.湖北科技学院医学部药学院,湖北 咸宁 437100;2.湖北科技学院糖尿病心脑血管病变湖北省重点实验室;3.湖北科技学院附属第二医院)
在健康个体中,心脏脂肪组织调节心血管功能和能量分配,然而心脏脂肪组织的异位沉积使它具有脂毒性,加快心血管疾病的发展进程。内质网(endoplasmic reticulum,ER)是真核细胞中重要的细胞器,负责脂类、蛋白质和碳水化合物的合成和修饰,以及调节细胞内钙浓度[1]。内质网应激被触发时,产生大量未折叠或错误折叠的蛋白质,导致钙离子浓度和脂质合成紊乱[2]。细胞内甘油三酯(triglyceride,TG)蓄积引起脂质损害时,内质网应激对心肌细胞应激介导的脂质蓄积产生负面影响,轻度的应激可以恢复ER内稳态,但强烈且持续的应激则会引起心肌细胞凋亡,产生或加重心血管疾病。
木犀草素(LU)作为一种生物类黄酮,具有抗炎抗肿瘤的作用[3],且由于其抗氧化特性,表现出了较好的糖尿病治疗作用[4-5]。但目前木犀草素对脂毒性心肌损伤的保护作用及相关机制暂无报道,因此,本研究以内质网应激-线粒体凋亡通路为切入点,探讨木犀草素对H9c2心肌细胞脂毒性损伤的保护作用及其与ERS-线粒体凋亡通路的相关性。
1 材料与方法
1.1 试剂
H9c2大鼠心肌细胞(PWE-RA004)、木犀草素(纯度>98%)(MB6799)、DMEM高糖培养基(MA0212)均购于大连美仑生物有限公司;胎牛血清(11011-8611)购于浙江天杭生物科技股份有限公司;棕榈酸(palmitic acid,PA)(P5585)购于美国Sigma公司;Annexin V-FITC/PI双染细胞凋亡检测试剂盒(BB4101-3)购于贝博生物;丙二醛(Malondialdehyde,MDA)(A003-1)检测试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)(A001-3)均购于南京建成生物工程研究所;活性氧(reactive oxygen species,ROS)检测试剂盒(R001)购于北京威格拉斯生物公司;线粒体膜电位检测试剂盒(JC-1)(C2006)购于碧云天生物科技有限公司;p-PERK(MA5-15033)、p-IRE1(PA1-16927)、CHOP(MA1-250)、GRP78(MA5-27686)、Caspase-3(9661)、Bax(2772)、Bcl-2(4223)抗体均购于美国CST公司。
1.2 仪器
细胞CO2培养箱(美国,Thermo);多功能酶标仪(美国,Bio-Tek);多功能凝胶成像系统(美国,Bio-Rad);荧光定量PCR仪(美国,Bio-Rad);倒置荧光显微镜(日本,Olympus);电泳槽、电转膜仪(美国Bio-Rad);CKX41倒置相差显微镜(日本,Olympus);恒温空气浴摇床(上海,福玛实验设备)。
1.3 方法
1.3.1 PA与木犀草素的配制
使用1mL无水乙醇溶解25.64mg棕榈酸(PA),得到100mmol/L的PA母液。用无血清培养基配制得10mmol/L的木犀草素储备液。
1.3.2 实验分组
观察PWE-RA004细胞生长形态,待贴壁至70%~80%进行传代,用含0.25% EDTA胰酶消化细胞,随后按合适比例接种至培养皿内,根据本课题组的现有研究成果将实验组分为正常组、模型组(0.2mmol/L PA处理)[6]、木犀草素组(木犀草素处理+PA)。
1.3.3 Cell Counting Kit-8(CCK8)检测细胞增殖
细胞传代后接种于96孔板,待生长至60%~80%时给予PA 0.2mmol/L处理24h,木犀草素组使用木犀草素5、10、15、20μmol/L分别处理24h,每孔加入10μL CCK8溶液37℃孵育20~30min,测定532nm处的吸光度,计算不同浓度木犀草素对PA诱导心肌细胞增殖率的影响,选取增殖率最高的木犀草素浓度进行后续实验。
1.3.4 SOD、MDA生化指标测定
将细胞分组给药孵育结束后,冰上裂解细胞,4℃离心取上清,加入相应比例MDA溶液,于95℃水浴40min下流水冷却,离心10min后收集上清,加200μL上清液于96孔板中,测定其在532nm波长处的OD值。检测SOD时,裂解离心后取20μL上清加于96孔板中,随后按试剂盒要求加入相应SOD工作液,测定450nm处OD值,计算SOD抑制率。
1.3.5 ROS水平检测
细胞分组给药,孵育24h,弃去原培养基,使用PBS洗一遍后再用无血清培养基洗两遍,随后加入500μL ROS工作液孵育20min,随后PBS洗两遍,加入DAPI再孵育10min,置于荧光显微镜下,记录荧光强弱的变化。
1.3.6 线粒体膜电位检测
细胞接种于六孔板中分组给药,孵育24h,取出后吸去孔内培养基,用PBS洗3遍,加入提前配制好的工作液,放入培养箱内继续孵育20min,再置于冰上用JC-1缓冲液清洗2次,用荧光显微镜摄影记录。
1.3.7 细胞凋亡检测
将细胞分组给药,接种于六孔板中,24h后去除孔内原有液体,使用PBS清洗3次,根据试剂盒使用说明向每孔加入400μL结合液,随后再分别加入5μL Annexin V-FITC和10μL PI溶液,置于培养箱中避光孵育10min,PBS洗涤孔内细胞3次,立即置于荧光倒置显微镜下观察,可见PI发出红色荧光,FITC发出绿色荧光。
1.3.8 Westren Blot法检测蛋白表达
观察细胞贴壁至60%~70%后分组给药,24h后取出用PBS洗3遍,置于冰上裂解细胞,于4℃低温离心下收集细胞,吸上清液测定蛋白浓度。配制合适比例的SDS-PAGE胶进行凝胶电泳,转膜后根据相应分子量切下条带,使用脱脂奶粉封闭条带1h,随后用TBST洗3遍,一抗置于4℃冰箱内孵育过夜,二抗放于室温下孵育1h,用现配制的ECL发光液显影,用Image J分析条带灰度值。
1.4 统计学方法
使用软件Graphpad Prism 6对收集的数据进行统计并分析,采用单因素方差分析或t检验比较组间差异。P<0.05认为差异具有统计学意义。
2 结 果
2.1 木犀草素对高脂诱导的H9c2心肌细胞活性的影响
由图1可见,与正常组相比,模型组的细胞活性呈显著下降趋势,与模型组相比,木犀草素组细胞活性明显上升,组间差异均具有统计学意义(P<0.01),结果显示木犀草素可逆转PA造成的H9c2心肌细胞损害。
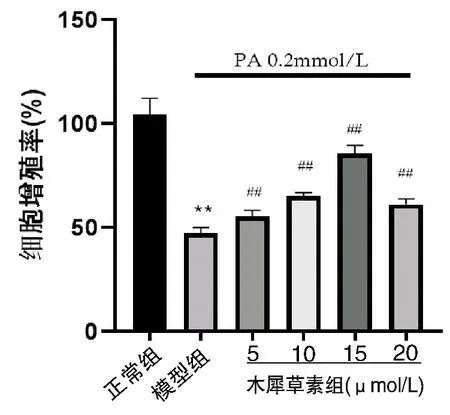
与正常组相比,**P<0.01;与模型组相比,##P<0.01;n=6图1 木犀草素处理对棕榈酸诱导的H9c2心肌细胞增殖率的影响
2.2 木犀草素对高脂诱导的H9c2心肌细胞内SOD、MDA含量的影响
如图2所示,使用SOD试剂盒检测细胞内超氧化物歧化酶含量,MDA试剂盒检测丙二醛水平,H9c2细胞经PA处理后SOD活性明显下降(P<0.05),MDA含量有所升高,而在木犀草素处理后SOD活力恢复,MDA活性较PA组显著下降(P<0.05)。结果均显示木犀草素可保护H9c2心肌细胞,减轻PA诱导的氧化损伤。
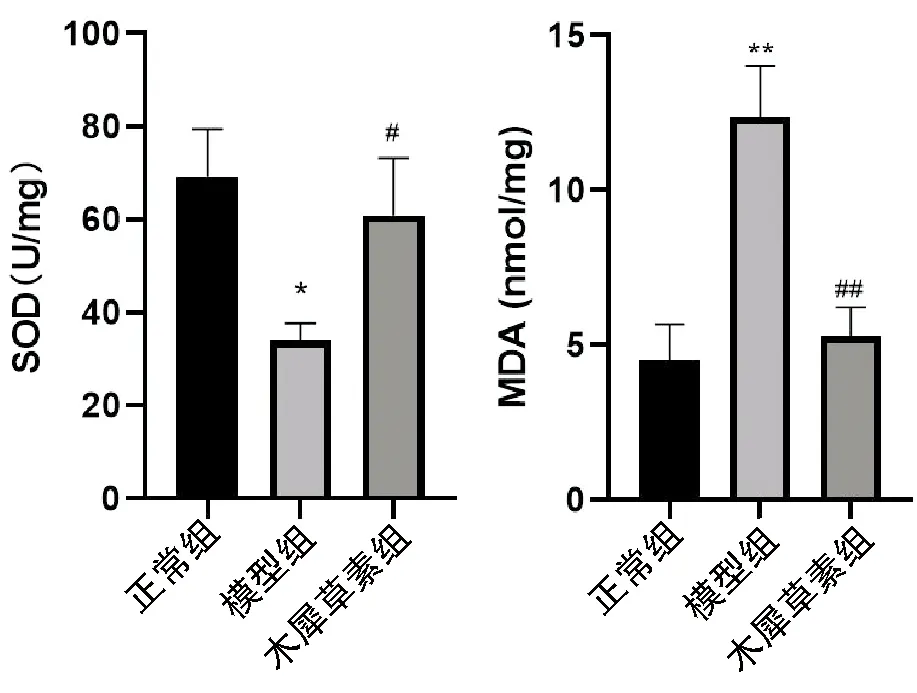
与正常组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01;n=3图2 木犀草素对高脂诱导的H9c2心肌细胞内SOD、MDA含量的影响
2.3 木犀草素对高脂诱导的H9c2心肌细胞内ROS水平的影响
如图3所示(标尺50μm),使用PA刺激H9c2心肌细胞24h后,使用DCFH-DA荧光探针检测木犀草素处理后细胞内ROS水平的变化,DAPI标记下的细胞核发出蓝色荧光,经PA处理后的实验组红色荧光增强,ROS水平升高,而使用木犀草素干预后红色荧光显著减弱,ROS水平接近正常组,红色荧光越强则表明细胞内的ROS水平越高。结果提示木犀草素可逆转PA诱导的心肌细胞氧化损伤。

与正常组相比,*P<0.05;与模型组相比,#P<0.05;n=3图3 木犀草素对高脂诱导下H9c2心肌细胞内ROS水平的影响(标尺=50μm)
2.4 木犀草素对高脂诱导的H9c2心肌细胞内MMP的影响
使用JC-1荧光探针试剂盒分析H9c2细胞内线粒体膜电位(mitochondrial membrane potential,MMP)的变化,根据JC-1染色原理,红色荧光越强,MMP越高;绿色荧光越强说明MMP越低。详见图4,PA处理后,红色荧光被削弱,绿色荧光增强。与PA组比,给予木犀草素干预后,红色荧光显著增强,绿色荧光明显变淡,表明木犀草素可有效逆转PA所致的MMP降低,增加H9c2心肌细胞线粒体膜的稳定性。
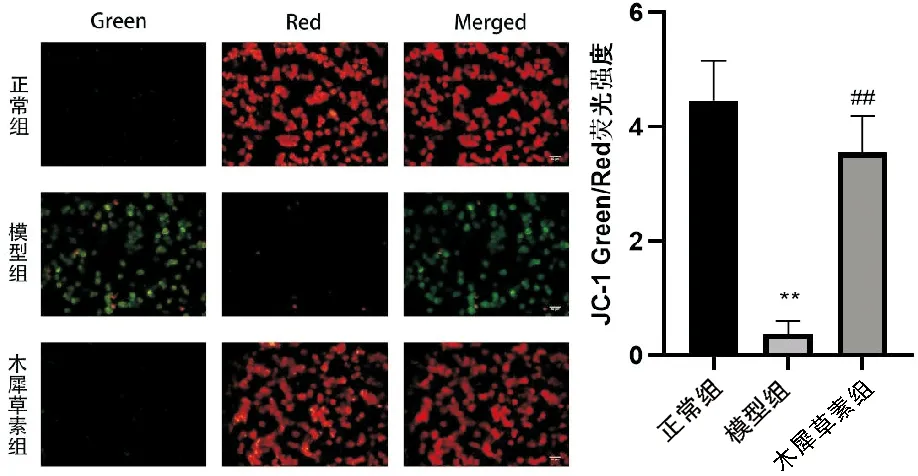
与正常组相比,**P<0.01;与模型组相比,##P<0.01;n=3图4 木犀草素对高脂诱导的H9c2心肌细胞内MMP的影响(标尺=50μm)
2.5 木犀草素对高脂诱导的H9c2心肌细胞凋亡的影响
使用Annexin V-FITC/PI双染试剂盒检测细胞凋亡程度。结果显示,在PA的诱导下,Annexin V-FITC标记的H9c2细胞内绿色荧光增强,使用PI标记的红色荧光同样增强,表明H9c2细胞的凋亡增多,而使用木犀草素处理后绿色荧光和红色荧光显著变淡,细胞凋亡程度减轻,见图5。
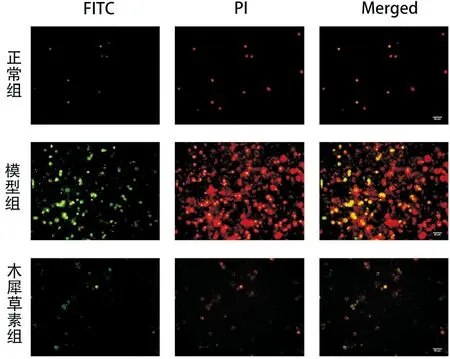
图5 木犀草素对高脂诱导的H9c2心肌细胞凋亡的影响(标尺=50μm)
2.6 木犀草素对高脂诱导的H9c2心肌细胞内质网应激相关蛋白的影响
如图6所见,与正常组相比,PA刺激后p-PERK、p-IRE1、CHOP、GRP78表达明显增加(P<0.01)。而这些改变在给予木犀草素干预后有所逆转,与PA组相比,p-PERK、p-IRE1、CHOP、GRP78蛋白表达降低。
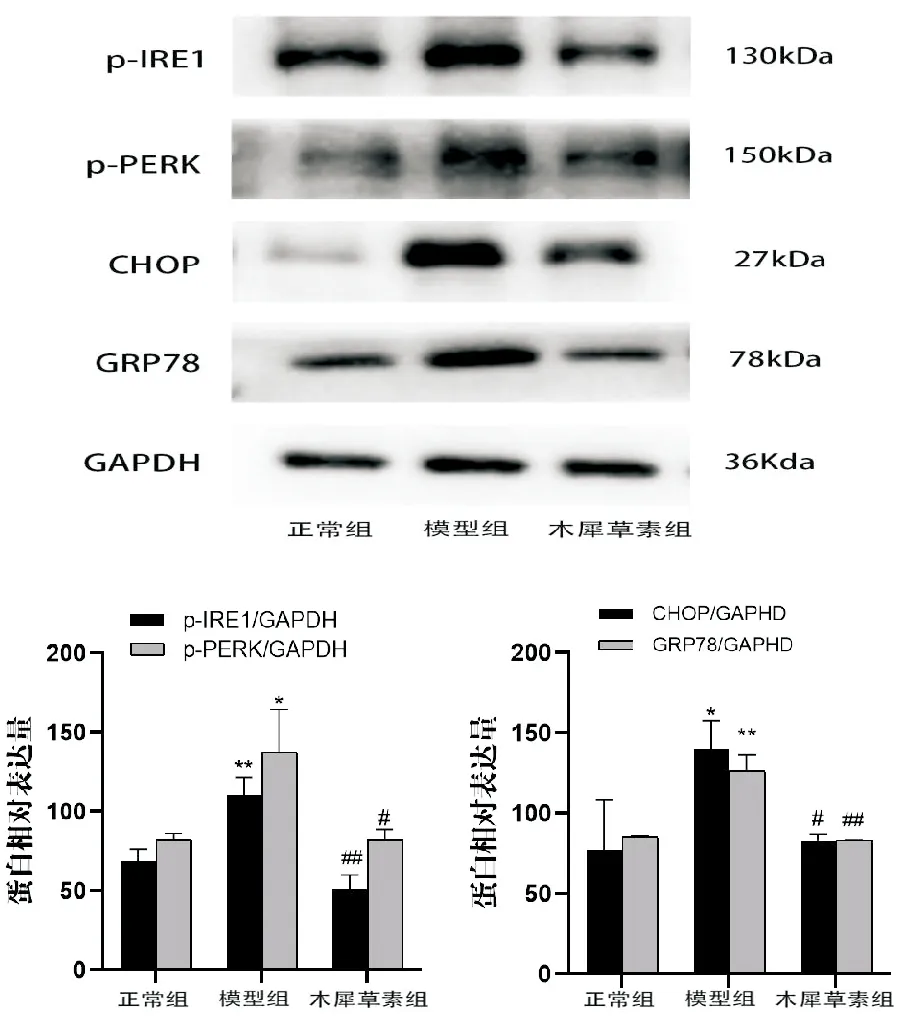
与正常组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01;n=3图6 木犀草素对高脂处理下H9c2心肌细胞内质网应激相关蛋白的影响
2.7 木犀草素对高脂诱导的H9c2心肌细胞凋亡通路相关蛋白的影响
如图7所示,与未处理实验组相比,PA组Cleaved caspase-3、Bax表达显著增加,Bcl-2组蛋白表达降低。给予木犀草素处理后逆转了这一改变,明显抑制PA所致的心肌细胞损伤,使Bcl-2蛋白表达升高,Cleaved casepase-3表达明显降低。
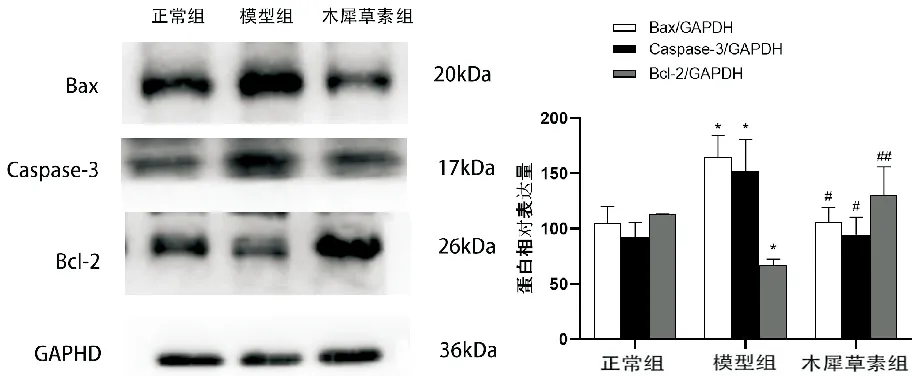
与正常组相比,*P<0.05;与模型组相比,#P<0.05,##P<0.01;n=3图7 木犀草素对高脂作用下H9c2心肌细胞凋亡通路相关蛋白的影响
3 讨 论
脂质是从组织和非极性溶剂中提取的疏水有机分子的异质组,由于其不溶于水,生物脂质按结构分类,包括膜相关脂质、脂肪组织中的三酰甘油(TAG)液滴以及血浆转运期间与白蛋白结合[6]。脂肪异位沉积可能作为主动机制,释放多种体内生化介质,影响胰岛素抵抗和炎症,这两种因素都会增加心血管风险[7]。脂毒性心肌损伤则涉及心脏脂质超负荷,导致心肌结构和功能改变[8],心肌细胞中饱和游离脂肪酸(SFFA)的积累,可导致心肌细胞应激和随后的心肌收缩功能障碍,减少过量的FA供应,对心脏功能有益[9]。
线粒体使应激反应的关键内分泌细胞器提供能量和信号,部分应激源,如线粒体DNA(mtDNA)突变、有毒化学物质、活性氧(ROS)生成等,可直接靶向并干扰线粒体功能[10]。Bcl-2蛋白家族是细胞凋亡过程中的调节因子,研究报道[11],B细胞淋巴瘤-2(BCL-2)家族成员驱使线粒体外膜通透性(MOMP)产生变化,导致凋亡诱导因子依赖性和caspase依赖性凋亡细胞死亡的激活。且BCL-2和Bax的激活会促进细胞色素C的释放,激活Casepase-3。过度的脂质过氧化作用会导致线粒体DNA、蛋白质和脂质的氧化损伤,引发线粒体功能障碍,增加氧化应激、内质网应激、细胞凋亡和炎症,进一步损害心肌[9]。
内质网(ER)在保持细胞生存和维持其正常生理功能上发挥突出的作用,当受到Ca2+紊乱、缺氧等刺激时,ER的正常生理功能被损害,进而导致ER功能紊乱[12-13],当内质网应激不断增强时,心肌细胞会通过激活各种适应过程来响应蛋白质折叠的变化,出现未折叠蛋白质反应(UPR)。正常情况下,UPR的分支PERK、IRE1被内质膜抑制[14],内质网应激时,PERK的激活直接使真核翻译起始因子2α(eIF2) 51位的丝氨酸磷酸化,缓解内质网应激,而受刺激的PERK/ATF4通路会活化介导促凋亡转录因子DNA损伤诱导转录物3(CHOP),诱导细胞死亡[15]。本次实验过程中,使用0.2mmol/L棕榈酸直接处理H9c2心肌细胞,作用24h后,细胞内GRP78、p-PERK、p-IRE1、CHOP表达水平升高,在棕榈酸的作用下心肌细胞出现内质网应激反应,使用木犀草素处理后有所逆转,相关蛋白表达下降。
综上所述,木犀草素对降低PA诱导的H9c2心肌细胞损伤有明显的抑制作用,减少氧化应激抑制细胞凋亡,调控ERS信号通路,降低线粒体介导的细胞凋亡,最终对心肌细胞起到有效的保护作用,目前,木犀草素通过调控ERS信号通路保护受脂毒性损伤的心肌细胞国内外暂无报道,此研究为木犀草素治疗心肌细胞脂毒性损伤奠定了基础,然而其是否能通过调控其他通路缓解脂毒性损伤还需进一步探讨。

