血清CysC、IL-35 水平与非ST 段抬高型心肌梗死患者PCI 治疗短期预后的相关性
万 伟 胡良坤 梅迎丽
(麻城市人民医院,湖北 黄冈 438300)
经皮冠状动脉介入术(Percutaneous coronary in-tervention,PCI)作为治疗非ST 段抬高型心肌梗死(Non ST elevation myocardial infarction,NSTEMI)的有效手段,能够疏通狭窄、闭塞血管,恢复患者心肌血流灌注,缓解病情[1]。但研究显示,即使经PCI治疗,仍有部分患者在术后发生不良心血管事件,导致患者病情加重,甚至猝死[2]。因此,为降低患者病死率,明确NSTEMI 患者PCI 治疗预后情况尤为重要。胱抑素C(CystatinC,CysC)在细胞基质的产生、降解动态平衡中发挥重要作用,且对半胱氨酸蛋白酶活性具有调节作用[3]。王建等研究表明,血清CysC在心血管疾病的发生、发展中发挥一定作用[4]。白细胞介素-35(Interleukin-35,IL-35)是IL-12 家族成员,对炎症、免疫细胞因子具有抑制作用,可抑制机体炎症、自身免疫性疾病的发生、发展[5]。郭利等研究表明,血清IL-35 水平与冠状动脉狭窄程度有关[6]。结合血清CysC、IL-35 作用机制,推测二者可能与NSTEMI 短期预后有关,且可能对NSTEMI 患者预后有一定预测价值。鉴于此,本研究观察血清CysC、IL-35 水平在NSTEMI 患者中表达,并分析二指标与患者短期预后的关系,现报道如下。
1 资料与方法
1.1 一般资料
本研究遵循《赫尔辛基宣言》原则,经医学伦理委员会审核,收集2018 年6 月至2020 年6 月医院收治的460 例NSTEMI 患者进行前瞻性队列研究。纳入标准:(1)NSTEMI 符合《不稳定性心绞痛和非ST 段抬高心肌梗死诊断与治疗指南》[7]中相关标准;(2)接受PCI 治疗;(3)24 h 内出现胸痛症状,且胸痛持续时间>30 min。排除标准:(1)合并其他心脏疾病,如先天性心脏病、急性心衰等;(2)合并急性脑血管疾病,如脑卒中;(3)严重肝肾功能障碍;(4)合并肝癌、胃癌等恶性肿瘤疾病;(5)合并感染性、血液性疾病;(6)合并凝血功能障碍;(7)合并自身免疫系统疾病,如类风湿关节炎;(8)合并呼吸、循环系统疾病。
1.2 方 法
1.2.1 PCI 治疗 全部患者均行PCI 治疗,治疗前患者口服300 mg 阿司匹林肠溶片(长白山制药,国药准字H22023170,规格:300 mg/片),300 mg 硫酸氢氯吡格雷(深圳信立泰药业,国药准字H20120018,规格:300 mg/片),进行碘过敏试验,于右臂、双侧腹股沟区进行碘伏消毒,采用局部麻醉,麻醉成功后经桡动脉穿刺,沿导丝将鞘管推送至桡动脉,成功后回抽鞘管内血液,以防气泡进入血管内,采用肝素盐水封闭鞘管。经导丝将造影导管推进,行冠状动脉造影,造影前给予3 000 U 肝素,经冠脉造影明确病变部位性质、特征。根据主动脉根部特征选择指引导管,放置指引导管后追加肝素,100 U/kg,以此为通路将导丝推至血管远端,并根据血管直径选取适合的球囊,对靶血管病变部位精确定位,进行球囊扩张,若血管狭窄≥70%,则置入相应药物洗脱支架;再次进行冠脉造影观察血管再通情况,确保介入治疗效果良好,完成介入治疗。
1.2.2 短期预后及分组方法 对全部行PCI 治疗的NSTEMI 患者进行为期12 个月的随访,全部患者均于出院后3、6、9、12 个月到院复查,观察并记录全部患者随访期间不良心血管事件发生情况,包括严重心力衰竭(根据临床症状、体征、心电图、心脏超声等检查确诊)、心脏骤停(呼吸断续或停止、瞳孔散大、颈动脉搏动消失、心音消失)、心源性休克(收缩压≤90 mmHg 或平均动脉压下降≥30 mmHg,神态改变、发绀、肢体发冷、尿量减少)、猝死(心脏骤停前存在严重缺氧、窒息情况,意识突然丧失,血压、脉搏消失)等,以首次发生上述不良心血管事件中的1 种为终点事件,若出现≥1 种表示预后不良。根据结果分为预后不良组和良好组。
1.2.3 实验室指标检测方法 取患者入院时腹静脉血5 mL,以3 000 r/min 速率离心10 min,取血清,采用酶联免疫吸附法检测血清CysC、IL-35 水平;采用化学发光法检测肌酸激酶同工酶(Creatine kinase-MB,CK-MB)、肌钙蛋白I(Cardiac troponin I,cTnI)水平。试剂盒均由武汉明德生物科技提供。
1.3 观察指标
设计一般基线资料调查问卷表,记录患者年龄、性别、合并症[高脂血症(甘油三酯水平≥2.3 mmol/L,或总胆固醇水平≥6.2 mmol/L)、高血压(参照《中国高血压基层管理指南(2014 年修订版)》[8]评定)、糖尿病(参照《糖尿病防治指南》[9]评定)]、吸烟史(吸烟指数(每日吸烟支数×吸烟年数)≥0.5)、饮酒史(男性饮酒量≥40 g/d,女性饮酒量≥20 g/d,且持续时间>5 年)、左心室射血分数(Left Ventricular Ejection Fractions,LVEF)。比较不同预后患者基线资料、入院时血清CysC、IL-35 水平及其他实验室指标,通过Logistic 回归分析血清CysC、IL-35 水平与NSTEMI患者PCI 治疗预后的关系,并分析血清CysC、IL-35预测NSTEMI 患者PCI 治疗预后的效能。
1.4 统计学方法
本研究计数、计量资料应用SPSS 23.0 软件分析,计数资料以n(%)表示,行χ2检验;计量资料经Shapiro-Wilk 正态性检验,正态分布者以±s表示,行t检验;血清CysC、IL-35 水平与患者PCI 短期预后的关系采用Logistic 回归分析;绘制受试者工作曲线(ROC),并计算曲线下面积(AUC)验证血清CysC、IL-35 水平预测效能;双侧检验水准α=0.05。
2 结 果
2.1 460 例NSTEMI 患者的短期预后结果
纳入的460 例NSTEMI 患者,经12 个月随访,随访时间为3-12 个月,平均随访时间(7.81±1.93)个月;短期预后不良79 例,占17.17%。
2.2 两组基线资料、实验室资料对比
较预后良好组比,预后不良组血清CK-MB、cTnI 水平较高,血清CysC、IL-35 水平较低,差异有统计学意义(P<0.05);两组其他基线资料对比,差异无统计学意义(P>0.05)。见表1。
表1 两组基线资料、实验室资料对比[±s/n(%)]
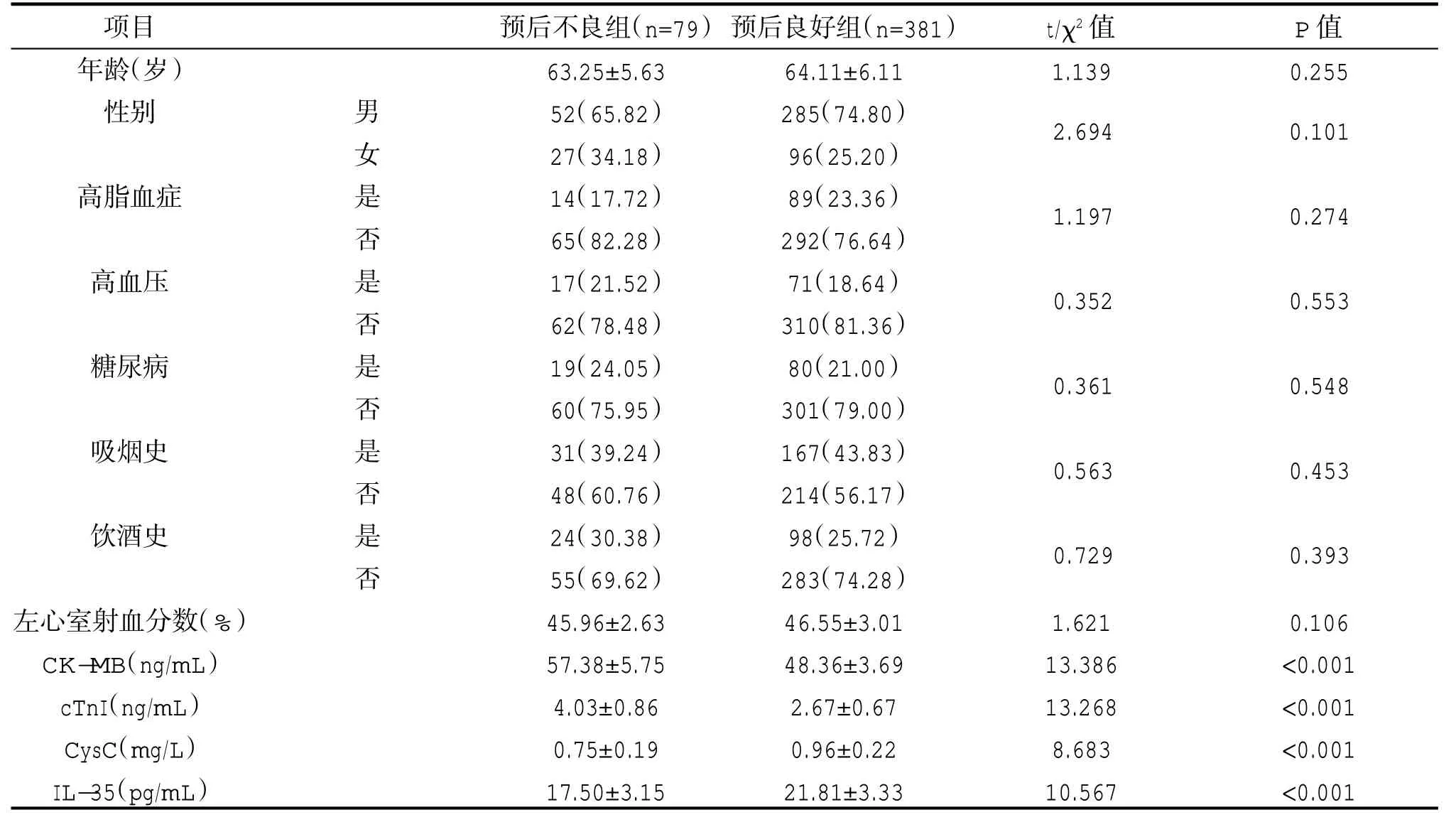
表1 两组基线资料、实验室资料对比[±s/n(%)]
项目年龄(岁)性别t/χ2 值1.139 P 值0.255 0.101预后不良组(n=79)63.25±5.63 52(65.82)27(34.18)14(17.72)65(82.28)17(21.52)62(78.48)19(24.05)60(75.95)31(39.24)48(60.76)24(30.38)55(69.62)45.96±2.63 57.38±5.75 4.03±0.86 0.75±0.19 17.50±3.15 1.197预后良好组(n=381)64.11±6.11 285(74.80)96(25.20)89(23.36)292(76.64)71(18.64)310(81.36)80(21.00)301(79.00)167(43.83)214(56.17)98(25.72)283(74.28)46.55±3.01 48.36±3.69 2.67±0.67 0.96±0.22 21.81±3.33高脂血症0.274 2.694高血压0.352 0.553糖尿病0.361 0.548吸烟史0.563 0.453饮酒史男女是否是否是否是否是否0.729 0.393左心室射血分数(%)CK-MB(ng/mL)cTnI(ng/mL)CysC(mg/L)IL-35(pg/mL)1.621 13.386 13.268 8.683 10.567 0.106<0.001<0.001<0.001<0.001
2.3 各主要变量与NSTEMI 患者PCI 治疗短期预后的关系回归分析
将NSTEMI 患者PCI 治疗短期预后情况作为因变量(1=预后不良,0=预后良好),表1 中具有统计学差异指标作为自变量(均为连续变量),Logistic 回归显示,血清CK、cTnl 水平高表达可能作为NSTEMI 患者PCI 治疗短期预后的风险因子(OR>1,P<0.05);血清CysC、IL-35 水平高表达可能作为NSTEMI 患者PCI 治疗短期预后的保护因子(OR<1,P<0.05)。见表2。
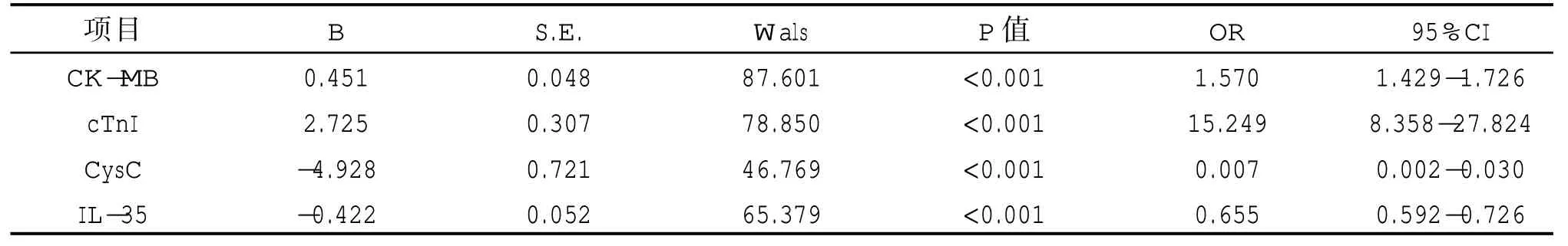
表2 各主要变量与NSTEMI 患者PCI 治疗短期预后的关系回归分析
2.4 血清CysC、IL-35 水平预测NSTEMI 患者PCI 治疗短期预后不良的风险价值
将入院时血清CysC、IL-35 作为检验变量,将NSTEMI 患者短期预后情况作为状态变量(1=预后不良,0=预后良好),绘制ROC 曲线发现(见图1),血清CysC、IL-35 单一及联合预测患者短期预后不良AUC 分别为0.772、0.825、0.840,以入院时血清CysC、IL-35 水平的cut-off 值取0.835 mg/L、19.005 pg/mL 时,可获得最佳预测价值。相关参数见表3。
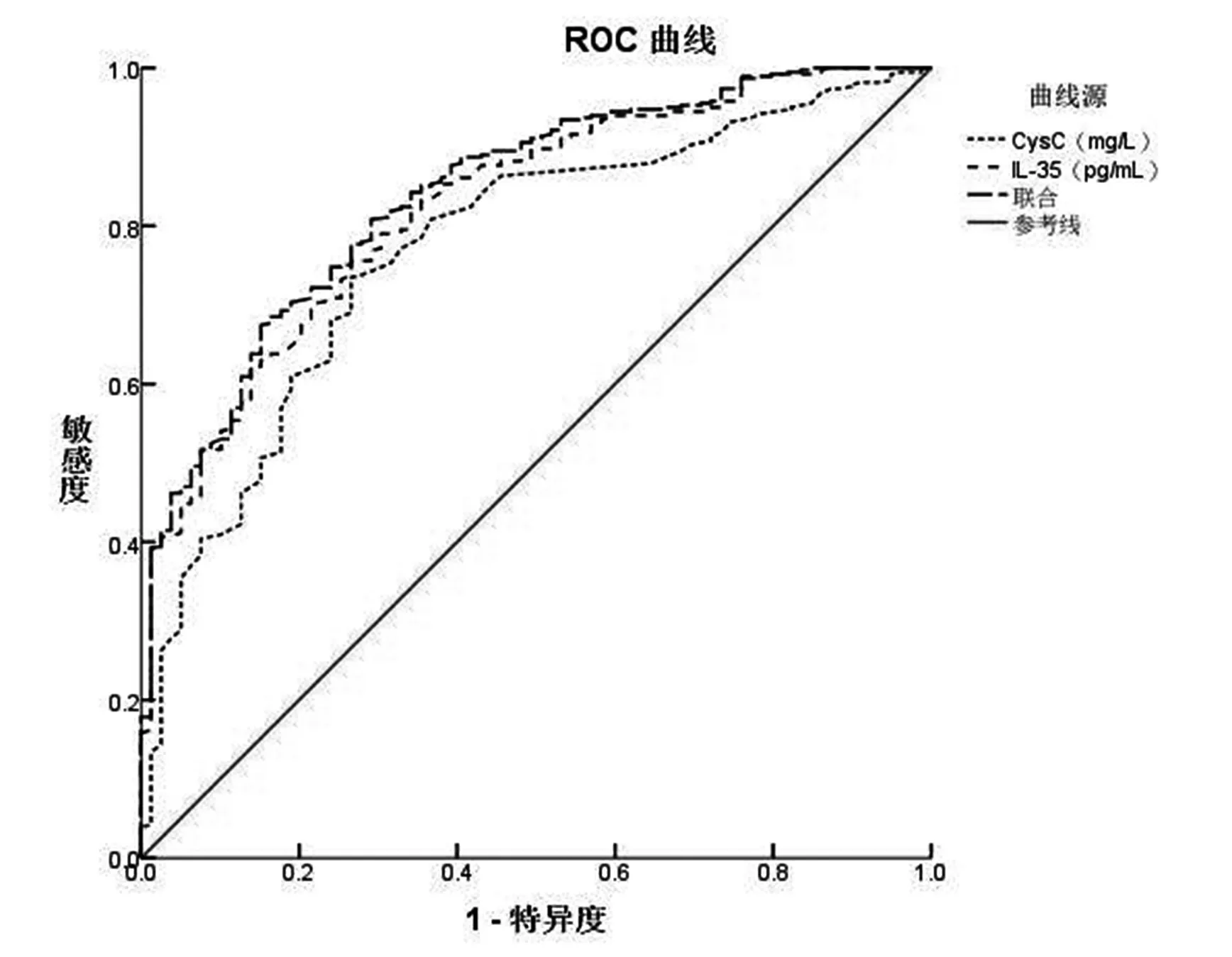
图1 血清CysC、IL-35 水平预测NSTEMI 患者PCI 治疗短期预后不良风险价值的ROC 曲线图
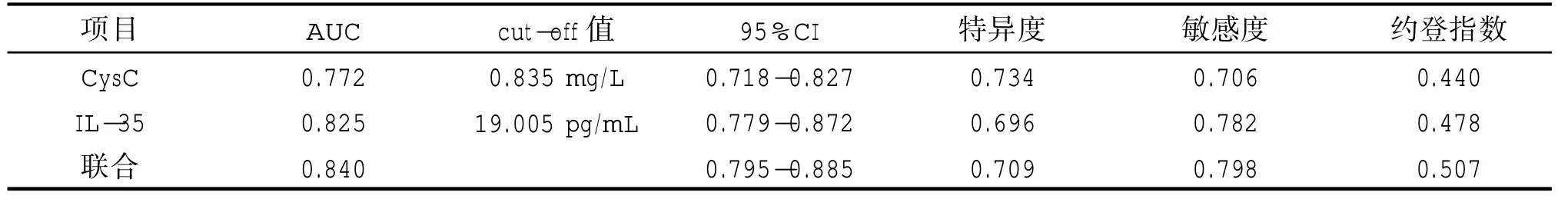
表3 血清CysC、IL-35 水平预测NSTEMI 患者PCI 治疗短期预后不良的风险价值
3 讨 论
王艳飞等研究表明,516 例NSTEMI 患者中,有92 例发生不良心血管事件,预后不良发生率为17.83%[10]。本研究中,全部460 例NSTEMI 患者,术后经为期12 个月随访,有79 例患者预后不良,占17.17%,与上述研究结论相似。由此可见,NSTEMI患者PCI 治疗后短期预后不良发生率较高,临床需予以重视。
CK-MB、cTnI 均为临床较为重要的心肌标志物,CK-MB 在心脏含量相对较高,当心肌受损时,CK-MB 可进入血液循环,导致血清CK-MB 水平骤增[11]。而cTnI 是存在于人体心肌细胞的正常物质,当心肌损伤时,可经心肌细胞释放至血液,血清cTnI 水平增加。本研究发现,预后不良患者CKMB、cTnI 呈高表达,且Logistic 回归发现,血清CK、cTnl 水平高表达可能作为NSTEMI 患者PCI 治疗短期预后的风险因子。但因血清CK-MB、cTnl 水平在心肌损伤中敏感度较高,NSTEMI 患者均伴有不同程度的心肌损伤,血清CK-MB、cTnl 水平明显骤增。因此,临床仍需探寻其他生物学指标共同预测患者预后。
作为半胱氨酸蛋白酶抑制剂,血清CysC 可影响中性粒细胞的迁移,同时参与机体炎性反应。IL-35 是属于IL-12 家族的抗炎因子,主要由调节性T淋巴细胞、巨噬细胞、激活树突状细胞、内皮细胞产生,具有基因多态性,对T 细胞扩张、IL-10 的产生具有促进作用。本研究结发现,预后不良者血清CysC、IL-35 水平呈低表达,且Logistic 回归显示,以上两指标低表达增加患者预后不良的风险。其具体的机制可能是,基质金属蛋白酶(Matrix metalloproteinases,MMPs)可促进动脉粥样硬化血管破溃,进而引起动脉斑块失稳,病情进展。CysC 作为MMPs 抑制剂,可降低此类蛋白活性,而血清CysC水平降低可导致MMPs 水平增加,促进病情进展。另一方面,CysC 对血管壁细胞外基质降低具有一定抑制作用,可延缓血管壁重构,进而抗动脉粥样硬化。研究指出,血清CysC 低表达可提通过炎症反应途径加重细胞损伤,组织蛋白酶表达异常,进而导致细胞外基质降解,血管壁重构,患者预后不良风险较高。IL-35 可与调节性T 细胞受体结合,对Teff 细胞的增殖、Th17 细胞的分化具有抑制作用,同时诱导T 细胞产生,增强自身免疫调节功能。动脉粥样硬化作为慢性炎性反应的发展过程,多种炎性因子参与其中,导致硬化斑块不断增厚、破损,进而引起不良心血管事件。而IL-35 可抑制炎症激活,阻止斑块发展,进而降低NSTEMI 患者PCI 治疗后不良心血管事件发生率。
最后,绘制ROC 曲线发现,血清CysC、IL-35 单一与联合均可预测患者短期预后不良,且以入院时血清CysC、IL-35 水平的cut-off 值取0.835 mg/L、19.005 pg/mL 时,可获得最佳预测价值。但本研究并未观察血清CysC、IL-35 水平之间的关系,研究存在局限,未来仍需进一步研究。
综上所述,血清CysC、IL-35 水平与NSTEMI 患者PCI 治疗短期预后有关,二者联合检测更利于NSTEMI 患者PCI 治疗短期预后的预测。建议临床可通过检测NSTEMI 患者血清CysC、IL-35 水平预测患者PCI 治疗预后情况,以便尽早采取干预措施。

