低频脉冲电刺激联合摄食-吞咽训练在AIS后吞咽障碍的应用及疗效*
谢逍 魏继鸿 刘双 李淳 廖波 王扬洁
(电子科技大学医学院附属绵阳医院·绵阳市中心医院康复医学科,四川 绵阳 621000)
急性缺血性脑卒中(Acute ischemic stroke,AIS)指各种原因致机体局部或广泛脑血管狭窄甚至闭塞,致使脑组织血供中断,出现循环障碍,脑组织缺氧缺血甚至软化坏死[1]。据统计[2],我国目前脑卒中发病率约0.12%~0.18%,且每年新发病例在200万以下,幸存者当中有2/3的患者出现一定程度功能障碍,包括吞咽、肢体活动、言语障碍等,其中吞咽障碍发生率约57%~73%。吞咽障碍常会导致呛咳、胃内容物反流等的发生,如处理不及时,可致营养不良、吸入性肺炎、窒息等较为严重的后果,加剧患者生理、心理、经济等方面的负担,不利于疾病恢复,严重影响患者生活质量,增加死亡风险。目前,卒中后吞咽障碍缺乏针对性治疗药物,临床主要通过吞咽康复训练促进功能恢复。摄食-吞咽训练结合食物针对性对患者吞咽功能展开训练,加强吞与咽等肌群生理运动以及协调能力。与此同时,电刺激技术的发展与应用为脑卒中后吞咽障碍患者提供了新的治疗方案。自从由Freed等[3]研发的表面神经肌肉刺激器-Vitalstim吞咽治疗仪获得美国药物管理局批准后,低频脉冲电刺激已广泛应用于吞咽障碍的治疗。低频脉冲电刺激通过神经、肌肉细胞刺激,动作电位将外部刺激传递至组织,达到运动、感觉等的宏观效应。本研究探讨AIS患者在摄食-吞咽训练的基础上联合使用低频脉冲电刺激疗效,阐述其应用价值,旨在为临床疾病治疗提供参考,现将结果报告如下。
1 资料与方法
1.1 一般资料 选取本院2019年6月—2021年8月AIS后吞咽功能障碍的患者107例,随机分为观察组(n=54)和对照组(n=53)。观察组中男30例,女24例;年龄51~76岁,平均(67.23±7.12)岁;梗死部位:顶叶7例,额叶5例,基底10例,脑干12例,颞叶4例,丘脑4例,小脑4例,枕叶8例。对照组中男29例,女24例;年龄53~77岁,平均(66.41±6.89)岁;梗死部位:顶叶8例,额叶4例,基底11例,脑干11例,颞叶5例,丘脑4例,小脑4例,枕叶6例。
1.2 纳入与排除标准 纳入标准:①符合中华医学会神经病学分会《中国急性缺血性脑卒中治疗指南》中AIS诊断标准[4]。②经洼田饮水试验检查,存在Ⅲ~Ⅴ级吞咽障碍。③初次发病。④年龄≥18岁。⑤意识清楚,可配合量表调查。⑥疾病确诊前无吞咽功能障碍症状。⑦经医院伦理委员会批准,患者及家属知情同意。排除标准:①严重失语、听力或视力障碍。②合并全身性感染或恶性肿瘤。③存在焦虑抑郁等精神障碍。④既往脑外伤、出血性脑血管疾病史。⑤合并咽喉局部疾病。⑥心脏起搏器佩戴者或对电极过敏及皮肤感缺失者。⑦妊娠及哺乳期妇女。
1.3 方法
两组均给予脑神经营养、脑循环改善、高压氧治疗等,护士协助下进行喉抬高训练、体位调整,调整食物和留置饮食,保证吞咽运动安全,以经过冰冻后的棉棒对患者舌根、软腭、咽后壁等部位进行刺激,3~5 s/次,指导患者空吞咽、舌部伸缩等,5 min/次,2次/d。在此基础上,对照组给予摄食-吞咽训练,观察组在对照组的基础上使用低频脉冲电刺激治疗,两组均持续治疗1个月。
1.3.1 摄食-吞咽训练 安静环境下,指导患者仰卧,头部前屈,床头抬高30°~40°,按循序渐进原则,由流质-半流质-正常饮食过渡,食物的质地和大小要求:既能刺激患者吞咽又不容易被滞留,进食量:由纤溶3~4 mL/口逐步增加到20~30 mL/口,控制在30 min左右,进食后饮用约2 mL水,视恢复情况鼓励自主进食。
1.3.2 低频脉冲电刺激 采用吞咽神经和肌肉电刺激仪(常州思雅医疗器械有限公司,YS1001P)进行。参数设置脉冲宽度11,脉冲频率80 Hz,输出强度:0~30 mA。电极放置:第1和第2电极分别放置于舌骨上方、环状软骨以上,3、4电极与第1电极等距离放置,根据实际情况进行调整,若存在会厌谷滞留和喉部移动障碍现象,电极紧贴舌骨上水平排列放置,3、4电极正中排列,第3、第4电极分别放置于甲状上切迹上、甲状软骨上切迹处,20 min/次,1次/d,每个疗程12 d,两个疗程间隔2 d,共治疗两个疗程。
1.4 观察指标
1.4.1 吞咽功能评价 ①洼田饮水试验[5]:治疗前及治疗1个月后进行洼田饮水试验,安静状态下饮30~40 ℃的纯净水30 mL,观察所需时间及是否出现呛咳,Ⅰ级: 1次性饮用完,未出现呛咳情况; Ⅱ级: 分2次或以上饮完,无呛咳情况发生; Ⅲ级:1次饮完,但有呛咳现象; Ⅳ级:分2次或以上饮完,部分呛咳现象; Ⅴ级:无论几次均不能完全饮完,且不时有呛咳情况发生,Ⅰ~Ⅴ级分别计1~5分。②标准吞咽功能评价量表(SSA)评价[6]:患者治疗前及治疗1个月后进行检测,从意识、呼吸、软腭运动、头与躯干控制、唇闭合、咽功能、喉功能、咽反射、自主咳嗽等进行检查,嘱连续3次5 mL纯净水吞咽,观察若无异常,60 mL纯净水吞咽,观察饮用时间和呛咳发生情况,得分范围为17~46分,得分越高代表吞咽功能越差。③吞咽功能初筛量表(EAT-10)[7]:患者治疗前及治疗1个月后进行EAT-10评分检测,量表共包括10项与吞咽障碍相关的问题,每一项题分5个等级(0、1、2、3、4 分) ,0分为正常,4分为严重吞咽障碍,≥3分为存在吞咽功能异常。
1.4.2 舌骨喉复合体动度 于治疗前及治疗1个月后进行吞咽钡剂造影,观察舌骨向前、上移以及喉向前、喉上移最大幅度。
1.4.3 纤维鼻咽喉镜吞咽功能检查(Fiberoptic endoscopic evaluation of swallowing,FEES) 采用日本Olympus T3型纤维鼻咽喉内窥镜进行:患者保持平时进食体位(坐或半卧),蘸1%丁卡因涂抹鼻腔黏膜表面,纤维鼻咽喉镜插入至后鼻孔,嘱患者吞咽动作,评估软腭封闭鼻咽入口功能;后纤维喉镜进入口咽,观察梨状窝、会厌谷等分泌物潴留情况,观察咽部和会厌结构和位置;喉镜继续进入会厌后部,观察喉结构以及喉前庭内有无分泌物的潴留以及分泌物是否到声门下,嘱作吞咽、咳嗽、屏气、咳嗽、发音动作,观察声带;随后进食试验,观察不同量、不同黏度的食物吞咽过程,比较两组声带麻痹、食物渗漏、食物潴留、误吸发生情况,声带麻痹:患侧声带呈弓形,发音时声门闭合不良,有裂隙;食物渗漏:咽期吞咽反射启动前1 s食物头部已至下咽部;食物潴留:即吞咽后食物在下咽部留滞;误吸:食物经过声门水平,进入声门下、气管内。
1.4.4 肺功能评价 对比两组治疗前及治疗1个月后肺功能指标水平,包括最长呼气时间、第一秒用力呼气容积(Forced expiratory volume in one cecond,FEV1)、用力肺活量(Forced vitalcapacity,FVC)以及最大吸气压(PImax)。
1.4.5 营养指标评价 于治疗前后采集外周空腹静脉血5 mL,3000 r/min转速下离心15 min,取血清,速率散射免疫比浊法测定血清总蛋白(TP)、白蛋白(ALB)、转铁蛋白(TRF)、前白蛋白(PALB)含量。测定患者治疗前后体质量指数(BMI)。
1.4.6 并发症 比较两组治疗期间并发症发生情况,吸入性肺炎:存在有可能发生吸入性肺炎的基础疾病;吞咽后出现吞咽功能障碍等症状;有明显肺炎体征;影像学显示肺部明显炎症;痰液培养结果为阳性。营养不良:患者BMI指数男性<20 kg/m2,女性<19 kg/m2,患者血红蛋白水平低于100 g/L,血清白蛋白低于32 g/L。

2 结果
2.1 两组患者洼田饮水试验、SSA评分、EAT-10评分比较 两组治疗前洼田饮水试验、SSA评分、EAT-10评分比较差异均无统计学意义(P>0.05);观察组治疗1个月后洼田饮水试验评定、SSA评分、EAT-10评分低于对照组(均P<0.05)。见表1。
表1 两组洼田饮水试验、SSA评分、EAT-10评分比较分)Table 1 Comparison on scores of water swallow test, SSA and EAT-10 between the two groups
2.2 两组患者舌骨喉复合体软度比较 两组治疗前舌骨喉复合体动度比较差异均无统计学意义(P>0.05);观察组治疗后舌骨喉复合体动度包括舌骨向前、上移以及喉向前、喉上移最大幅度均大于对照组(P<0.05)。见表2。

表2 两组舌骨喉复合体软度比较Table 2 Comparison on the softness of hyolaryngeal complex between the two groups
2.3 两组患者治疗后FEES检测结果比较 观察组治疗后FEES评价中声带麻痹、食物渗漏、食物潴留、误吸比均低于对照组(P<0.05),见表3。
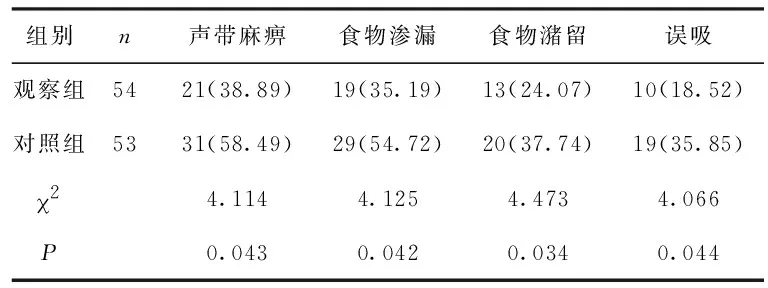
表3 两组治疗后FEES检测结果比较[n(×10-2)]Table 3 Comparison of FEES results between the two groups after treatment
2.4 两组患者肺功能水平比较 两组治疗前肺功能指标水平比较差异均无统计学意义(P>0.05);观察组治疗后肺功能指标最长呼气时间、FEV1、FVC以及PImax水平均大于对照组(P<0.05)。见表4。
表4 两组肺功能水平比较Table 4 Comparison of lung function between the two groups
2.5 两组患者BMI及营养指标水平比较 两组治疗前BMI及营养指标水平比较,差异无统计学意义(P>0.05);观察组治疗1个月后BMI大于对照组,血营养指标TP、ALB、TRF、PALB水平均高于对照组(P<0.05)。见表5。
表5 两组BMI及营养指标水平比较Table 5 Comparison of BMI and nutritional indexes between the two groups
2.6 两组患者并发症发生情况 观察组吸入性肺炎发生率为5.57%(3/54)低于对照组20.75%(11/53),营养不良发生率为3.70%(2/54)低于对照组18.87%(10/53)(均P<0.05)。
3 讨论
正常吞咽是一种复杂神经反射过程,需口腔、咽、食管26块肌肉共同协调完成[8]。脑卒中后呑咽障碍是指因脑血管疾病导致的进食困难,食物不能被安全有效从口送到胃中,机体得不到足够营养与水分,易出现营养不良、脱水等现象,严重影响患者恢复,有效改善卒中患者吞咽功能具有重要临床与社会价值[9-10]。
常规治疗虽可促进吞咽功能在一定程度上有所改善,但治疗周期长,且需持续坚持。摄食-吞咽训练指导患者从流质-半流质-正常饮食过渡,强化吞咽反射,提升舌肌群活动能力,促进吞咽功能恢复,且摄食训练刺激卒中后吞咽障碍患者肠道蠕动和胃液分泌,加强消化功能,改善营养状态,有利于病情恢复[11-12]。低频脉冲电刺激则可刺激患者神经与肌肉,保持脑部高级运动中枢兴奋,重建和修复受损神经元及反射弧,利于新中枢至咽喉运动通路的形成,改善吞咽功能,同时低频脉冲电刺激促进血液循环,改善吞咽协调性,提高吞咽反射灵敏度[13-14]。
本研究中,观察组治疗1个月后洼田饮水试验评定、SSA评分、EAT-10评分均低于对照组,提示观察组患者吞咽功能明显改善,且效果优于对照组,与尹姗姗等[15]研究结果一致。一方面摄食-吞咽训练刺激吞咽反射,改善吞咽协调性,促进吞咽功能的恢复;另一方面通过生理性电刺激神经肌肉,使得外周神经去极化,肌肉保持轻度收缩状态,从而有效改善局部微循环,提高咽部肌肉灵活及协调性,同时低频电刺激舌咽、舌下神经、舌喉返神经等,使大脑中枢兴奋,增强突触功能,从而有效改善患者吞咽功能[16-17]。何子龙等[18]研究显示神经肌肉电刺激联合吞咽康复训练可提高脑卒中后吞咽障碍患者舌骨喉复合体活动度。本研究中,治疗1个月,观察组舌骨向前、上移以及喉向前、喉上移最大幅度均大于对照组,提示低频脉冲电刺激联合摄食训练可有效提高患者舌骨喉复合体动度,摄食-吞咽训练强化患者吞咽反射,改善舌骨喉复合体动度,在此基础上联合使用低频脉冲电刺激,促进舌骨喉周边肌肉群收缩,增加肌肉群肌力,改善舌骨喉复合体动度,促进形成新的中枢至咽喉运动传导通路,维持血液循环稳定,修复神经元,利于吞咽中枢恢复,减轻吞咽障碍,利于舌骨喉复合体动度改善[19-20]。与此同时本研究显示观察组治疗后FEES评价中声带麻痹、食物渗漏、食物潴留、误吸比例低于对照组,在摄食训练的基础上联合使用低频脉冲电刺激,增强神经兴奋性,帮助吞咽功能的改善和重塑,下颌、舌肌、舌咽相关肌肉锻炼调动失用肌群,修复吞咽功能,减少FEES检测不良事件发生风险。
部分卒中患者受累侧呼吸肌功能降低、胸廓顺应性下降,血氧饱和度降低,肺泡上皮细胞、肺毛细血管内皮细胞均受累,导致患者出现通气障碍[21]。相关研究显示[22]脑卒中后呼吸功能下降可导致咳嗽和咳痰等气道廓清功能受限,与吞咽障碍之间关系密切。本研究中观察组治疗后最长呼气时间、FEV1、FVC以及PImax水平均大于对照组,治疗后肺功能改善效果优于对照组,低频脉冲电刺激作用于咽皮质运动区时,大脑功能区域连接增强,脑干中枢模式发生器对吞咽、呼吸调控作用得到增强,在治疗吞咽障碍的同时,加强了呼吸功能。吞咽障碍与营养不良密切相关,二者互为因果,形成恶性循环[23]。AIS患者静息能量消耗增加,应激状态下出现高代谢与负氮平衡,能量消耗较多,难以满足日常需求;部分康复期脑卒中吞咽障碍患者,参加康复训练,能量消耗也较大[24]。吕静等[25]研究显示神经肌肉电刺激治疗脑性瘫痪吞咽障碍可有效改善患者营养状态。本研究中观察组治疗1个月后BMI指数大于对照组,血营养指标TP、ALB、TRF、PALB水平均高于对照组,表明低频脉冲电刺激联合摄食-吞咽训练有利于改善AIS后吞咽障碍患者营养状态,低频脉冲电刺激联合摄食-吞咽训练通过改善吞咽功能,进一步保证了患者的营养摄入量,强化了营养状态[26]。本研究的不足之处在于研究样本量较少,干预时间较短,在一定程度上影响研究结果, 后续还需扩大样本量,延长干预时间,作进一步研究。
4 结论
低频脉冲电刺激联合摄食-吞咽训练治疗AIS后吞咽障碍,可有效促进患者吞咽功能的恢复,改善舌骨喉复合体动度,增强呼吸功能,提高营养状态,降低不良事件发生风险。

