ds区ⅧB过渡金属原子催化甲烷氧化的理论分析
刘红霞,侯冬岩,李铁纯
(1.鞍山师范学院 化学与生命科学学院,辽宁 鞍山 114007;2.辽宁省天然产物活性分子开发及利用重点实验室,辽宁 鞍山 114007)

甲醇作为基础化学原料,很容易转化为烯烃、芳烃等重要的化学原料和燃料.甲烷是天然气储量的主要成分,甲烷氧化生成甲醇的反应如果能够实现大规模的工业生产,将极大地帮助人类摆脱对石油的依赖.然而,甲烷氧化生成甲醇的过程需要催化剂的参与才能进行,在催化反应过程中,通常需要昂贵的抗氧化剂、腐蚀性物质或反应介质[1-7],且这些物质只适合在实验室中使用而并不适合大规模商业化生产,因此,甲烷氧化的反应条件仍然是一个未解的难题.尽管在温和条件下的气相反应中,甲烷可以通过分子氧化直接转化为甲醇,但该过程或者是需要进行化学计量的(因此需要水提取步骤)[8-14],或者太慢、产率低且不切实际[15].目前,还未有报道使用催化剂来有效地将天然气中的甲烷直接转化为甲醇,因此,开发能够选择性氧化甲烷的催化剂是非常重要的.SHAN等[16]提出了两种催化甲烷氧化为甲醇和乙酸的方法:(1)在温和条件下,CH4在H2和CO的作用下生成乙酸和甲醇并进一步氧化;(2)CH4在O2和CO2的作用下直接氧化为甲醇.然而,其大规模工业化应用仍然是催化领域的一个难题.因此,研究甲烷的催化氧化反应非常重要.
掺杂金属已被证明能有效改善氧化物的物理和化学性质[17-18].掺杂后,氧化物离子的电荷状态发生改变,电荷平衡受到干扰而产生过量电荷.因此,掺杂金属影响主体氧化物的电子、光学性质和化学反应机理,能削弱氧化物晶体内的化学键[19],增强催化剂的表面吸附能力[20-21],有助于活化和解离分子[22].金属的掺杂倾向于增强材料在反应中的活性.本研究希望通过掺杂过渡金属实现甲烷的有效催化氧化.
考虑催化剂潜在的重要性和相当有限的信息,我们对甲烷氧化生成甲醇反应的势能面进行了详细的理论研究,本研究最终给出:(1)催化甲烷氧化生成甲醇反应的势能面信息;(2)甲烷氧化生成甲醇的反应机理;(3)甲烷氧化生成甲醇的速率常数.这些结果可以为甲烷氧化研究提供一些有价值的信息.
1 计算方法
所有计算均使用GAUSSIAN03程序包[23]进行.使用混合密度泛函B3PW91/LanL2DZ方法优化所有反应物、产物、中间体和过渡态的几何结构[24-25].众所周知,过渡金属原子的全电子计算消耗时间过多,因此,有必要引入相对论有效核势来描述内核电子.过渡金属原子的5s25p65d106s1最外层价电子通过LanL2DZ基组[26-27]进行描述.通过谐波振动频率计算证实了甲烷氧化反应稳定点结构的稳定性,即稳定态均为实频,而过渡态有且只有一个虚频.为了确认过渡态连接指定的中间体或产物,在B3PW91水平上进行内反应路径计算.在考虑小曲率隧道效应校正[28-29]的基础上,计算在100~1 000 K的温度范围内主反应通道速率控制步骤的速率常数.
2 结果与讨论
甲烷氧化生成甲醇反应的稳定点的优化结构如图1所示.为方便讨论,反应物R的能量设为零.CH4+O2+M(M@Fe、Co、Ni、Ru、Rh、Pd、Os、Ir、Pt)相关反应路径的势能面信息绘制见图2(a~c).

图1 甲烷氧化反应稳定点的优化结构示意图
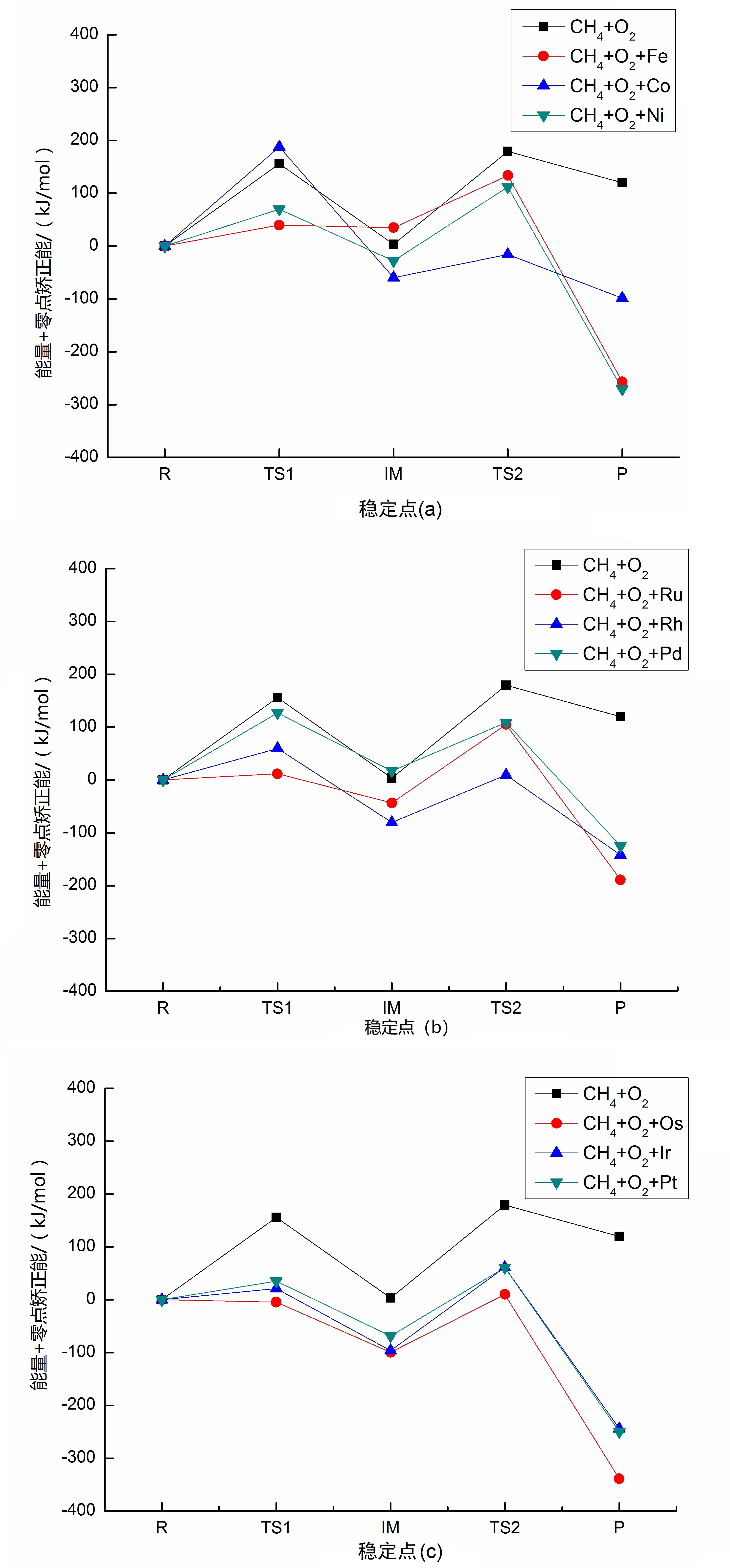
图2 在B3PW91+ZPE水平下甲烷氧化反应的势能面示意图
2.1 相关能
生成焓是确定理论上预测该反应是否稳定的一种较好的判据,焓值数据可以评估反应路径的可行性.为了探索获取这些化合物(R)的热力学可行性,计算CH4+O2+M(M@Fe、Co、Ni、Ru、Rh、Pd、Os、Ir、Pt)吸附过程的能量及结构.
CH4+O2+M→R(CH4+O2+M)
(1)
表1计算结果表明,CH4+O2+M(M@Fe、Co、Ni、Ru、Rh、Pd、Os、Ir、Pt)的吸附过程是放热的,CH4+O2+M在温和条件下是热力学稳定的.
2.2 势能面
在CH4+O2反应的势能面上,先是过渡态TS1(CH3…H…O2)发生氢提取反应形成中间体IM.随后,中间体IM经过过渡态TS2(CH3…OH…O)发生羟基提取反应,生成产物P(CH3OH+O).鉴于实际上过渡态TS1和过渡态TS2的能垒均较高,一般在无法克服高能垒情况下,甲烷氧化反应很难如此进行下去.

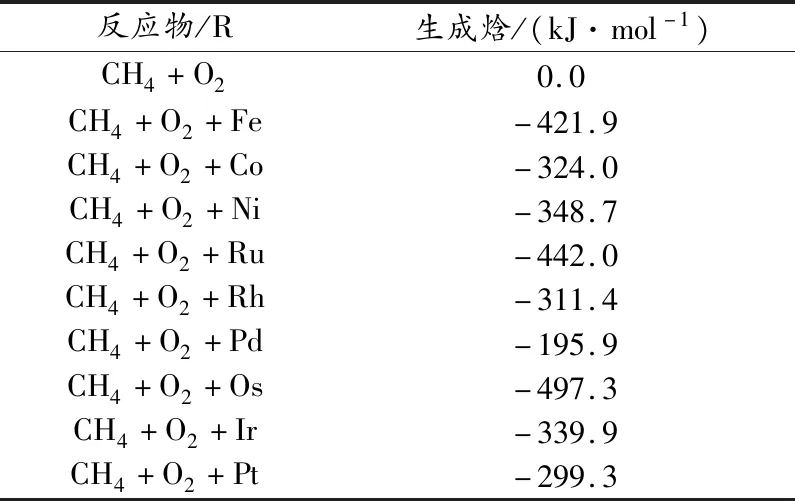
表1 CH4+O2+M(M@Fe、Co、Ni、Ru、Rh、Pd、Os、Ir,Pt)吸附过程的生成焓
路径1R→IM→P(CH3OH+O)
与CH4+O2反应相比,加入催化剂后,CH4+O2+M(M@Fe、Co、Ni、Ru、Rh、Pd、Os、Ir、Pt)反应机理与未加入催化剂时相同.除Co外,过渡态的能垒显著下降,所有产物的能量都是负值,说明该催化反应为放热反应.计算结果表明,过渡态的能量变化与生成焓变化一致.
根据所得反应势能面信息,得到了甲烷氧化为甲醇的反应通道(路径1).在元素周期表中,第五周期原子(Ru、Rh、Pd)随着核外电子数的增加,反应能垒随着生成焓的增加而增大;第六周期的原子(Os、Ir、Pt)发生了同样的变化;而第四周期的原子(Fe、Co、Ni)却不符合这一规律.
2.3 动力学
分别对催化前后甲烷氧化为甲醇反应进行动力学计算.在100~1 000 K温度范围内计算主要通道的热力学函数焓变ΔH、熵变ΔS以及速率常数,其结果列于表2中.
速率常数计算公式如下:
(2)
(3)
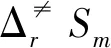
对表2~5数据进行分析,该反应的速率常数k随着温度的升高而显著增加,在100~1 000K范围内,发现理论速率常数与温度成正相关,因此,该反应利于在较高温度下进行[30-31].在室温下,第五和第六周期的过渡金属原子催化氧化甲烷反应的反应速率常数随着原子序数增大呈降低的趋势,这可能是因为催化原子半径增加,增大了反应的空间位阻,导致反应速率下降.而第四周期的Fe、Co、Ni变化不规律,是与上述生成焓和势能面分析该周期变化没有规律有关.此外,加入催化剂后甲烷氧化生成甲醇反应的速率常数明显增大,说明ⅧB过渡金属原子可以很好地催化该反应.到目前为止,还没有可用的实验研究来验证这个理论结果,但这将为寻找更有效的催化剂提供理论指导.
对过渡金属催化甲烷氧化反应的相关能、势能面及动力学信息进行详细的研究.计算结果表明,甲烷氧化为甲醇是通过氢迁移和羟基迁移反应得到主要产物P(CH3OH+O).该反应主要发生在高温区间内,随着温度升高反应速率增加.热力学研究表明,Ⅷ B过渡金属催化甲烷氧化反应具有较好的热力学稳定性.在第五和第六周期的金属元素中,随着核外电子数的增加,其反应能垒随着生成焓的增加而增大,而第四周期的Fe、Co、Ni不符合此规则.动力学研究表明,在100~1 000 K温度区间理论速率常数与温度呈正相关,该反应的速率常数随温度的升高而显著增加.因此,ⅧB的过渡金属能较好地催化甲烷氧化反应.

表2 B3PW91水平下甲烷氧化反应速控步标准摩尔活化熵变、标准摩尔活化焓变和速率常数
表3 B3PW91水平下ds区ⅧB过渡金属催化甲烷氧化速控步CH4+O2+M(M@Fe、Co、Ni、Ru、Rh、Pd、Os、Ir、Pt)→IM在100~1 000 K温度范围内的标准摩尔活化熵变
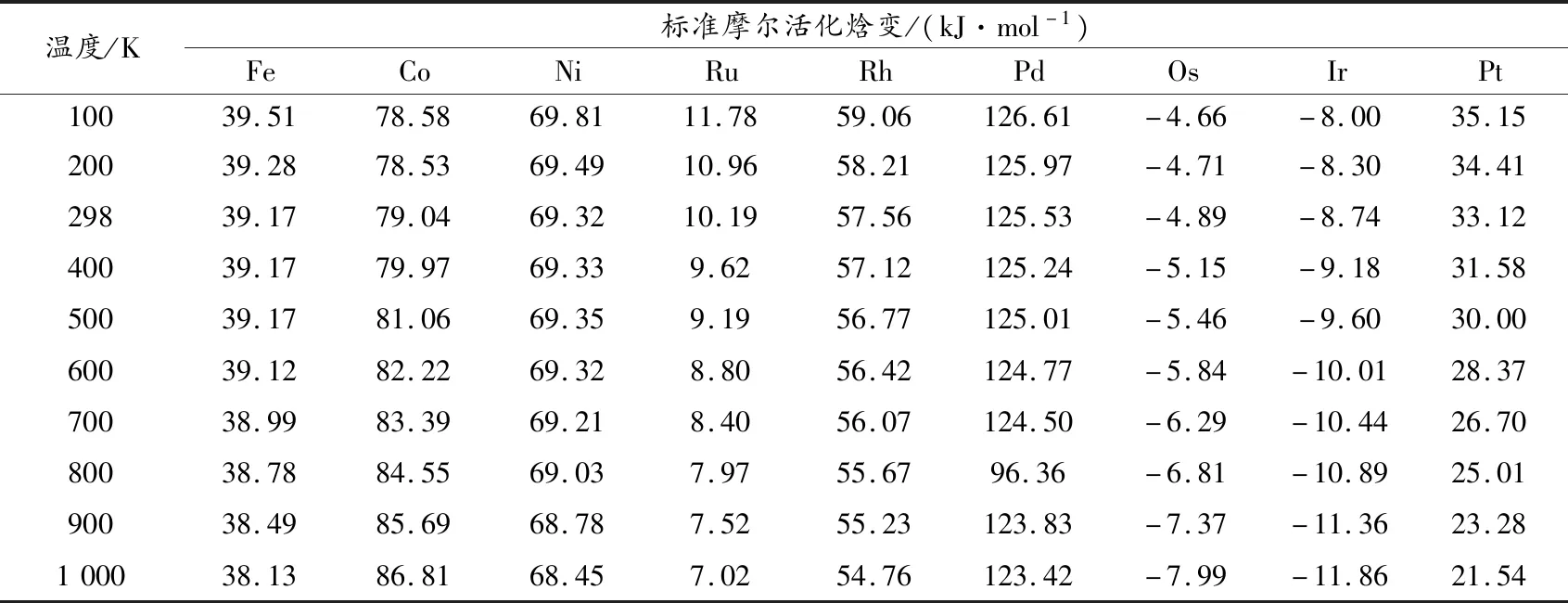
表4 B3PW91水平下ds区ⅧB过渡金属催化甲烷氧化速控步CH4+O2+M(M@Fe、Co、Ni、Ru、Rh、Pd、Os、Ir、Pt)→IM在100~1 000 K温度范围内的标准摩尔活化焓变
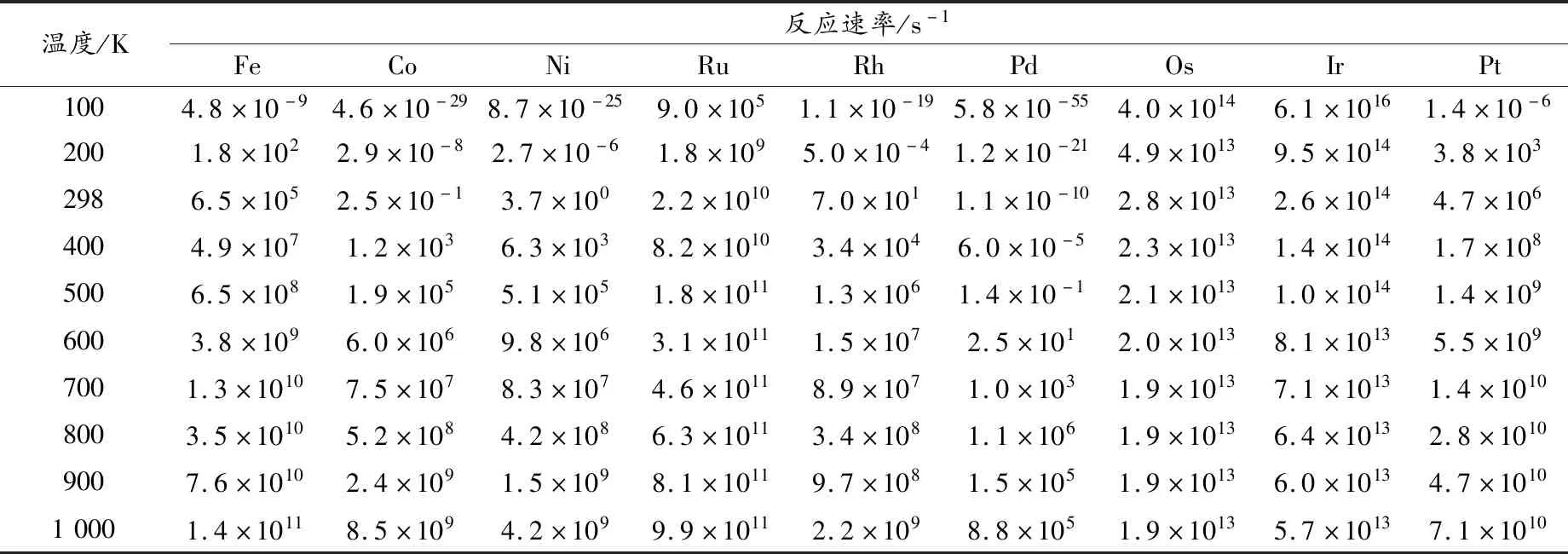
表5 B3PW91水平下ds区ⅧB过渡金属催化甲烷氧化速控步CH4+O2+M(M@Fe、Co、Ni、Ru、Rh、Pd、Os、Ir、Pt)→IM在100~1 000 K温度范围内的反应速率
——《势能》

