超声辅助酶解提取五味子多糖及其抗细胞氧化应激研究
朱翰林 赵 恒 翟博文 张卯玉 付玉杰
(1.东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040;2.东北林业大学化学化工与资源利用学院,哈尔滨 150040;3.北京林业大学林学院,北京 100083)
五味子(Schisandra chinensis)全株近无毛,为木兰科(Schisandraceae)木质藤本,喜湿怕涝,适宜生长温度为18~28 ℃,其浆果为深红色球形肉质,可入药[1]。五味子是主产于吉林省、黑龙江省、辽宁省的道地药材,习称“北五味子”,现被认定为三级保护植物。既往关于五味子的研究主要包括植物资源保护、组织培养[2]、五味子枯叶病致病原菌[3]、五味子茎基腐病致病原菌[4]、五味子提取物的生物活性[5]和药理作用[6-7]、五味子多糖的体内试验作用机制[8-10]等,而关于五味子多糖的提取分离工艺还有待优化。
有些多糖存在于植物细胞的胞壁外,但大多数多糖仍然存在于细胞壁内,如淀粉作为储能营养物质在需要时被分解为葡萄糖。提取多糖方法有微波辅助提取、水酶辅助提取、真空提取、超声波辅助提取等,这些提取方法各有利弊,而传统溶剂提取方式无法有效提取植物中的多糖,提取率较低且耗时长[11]。鉴于此,如何高效和充分地提取五味子中多糖成分成为当前研究中的重点。超声提取法的优势包括低温下运行、防止活性成分结构损坏、提取时间较短、安全性高、维护保养方便、萃取效率高、物理化降低多糖分子量等[12]。据报道,植物材料在超声波场作用下,通过“空化效应”得到外力冲击,溶液内气泡的形成、在极短时间和极小空间内爆破压缩,形成瞬间高温高压的环境[13],使细胞破碎、目标物质高效率分离出来。纤维素酶是自然界中含量丰富的可再生生物资源,具有用量低、耗能少、对人体无害、高效分解纤维素、对环境友好等特点,其作用温度为30~60 ℃,符合多糖提取的温度要求,能确保在提取过程中较少地破坏活性多糖的结构[14]。例如,朱亚伟等[15]使用响应面优化纤维素酶酶解-微波辅助法提取桑(Morus alba)叶多糖。孙彤彤等[16]通过Box-Behnken 响应面法优化得到虎耳草(Saxifraga stolonifera)总酚,并测定其抑制五步蛇毒PLA2 酶活性,结果表明虎耳草总酚含量与其抑制酶活性作用呈极显著正相关。有研究优化了向日葵(Helianthus annuus)茎芯多糖的提取工艺,在最优条件下所得多糖含量为6.56%,说明不同种属植物间多糖含量差异明显,比较得出长白山产区五味子的多糖含量的丰富性[17]。目前关于超声辅助纤维素酶酶解提取五味子多糖的研究鲜见报道,而五味子多糖对于脂多糖诱导的HepG2细胞氧化应激的抑制能力也未见报道。
本研究选择产于长白山地区的五味子干果为原料,以多糖得率为考察指标,通过单因素试验和Box-Behnken design(BBD)响应面优化试验,探索超声辅助纤维素酶酶解工艺提取五味子多糖的最佳条件(加酶量、超声功率、超声酶解时间、料液比),并对获得的五味子多糖开展细胞氧化应激保护活性研究,以期为五味子多糖的深入开发和利用提供理论依据。
1 材料与方法
1.1 材料与试剂
五味子干果购自吉林省长白山地区,−20 ℃存储;脂多糖(LPS,Escherichia coli026:B6)、N-乙酰半胱氨酸(NAC)购自Sigma 公司;纤维素酶(酶活性为50 000 U·g−1)、丙二醛(MDA)含量检测盒、超氧化物歧化酶(SOD)活性检测盒购自Solarbio 公司;D-无水葡萄糖购自阿拉丁有限公司。浓硫酸、蒽酮、无水乙醇购自国药集团化学试剂有限公司;所用其他化学试剂均为分析纯。
1.2 仪器与设备
CO2细胞培养箱购自SIM 公司;BS110 型电子天平购自Sartorius 公司;DL-CJ-2N 型生物洁净工作台购自哈东联电子技术公司;DK-8D 型恒温热水槽购自上海市森信实验器材公司;1-15K型高速冷冻离心机购自Sigma 公司;Stat Fax-3200 型酶标仪购自AWARENESS 公司;CytoFLEX 型贝克曼流式细胞仪购自贝克曼库尔特公司;JY92-IIN 型超声波细胞粉碎机购自宁波新芝生物科技股份有限公司;RE-52AA 型旋转蒸发仪购自上海青浦沪西仪器厂;Ultrospec5300pro 型紫外分光光度计购自美国通用电气公司。
1.3 试验方法
1.3.1 五味子多糖制备工艺流程
将五味子干果用超声波清洗仪清洁表面并沥干后,置于烘箱中60 ℃干燥至恒质量。随后精确称取30.00 g 粉碎过80 目筛,得五味子粉末。将粉末按料液比1 g∶5 mL的比例与无水乙醇混合,4 ℃下静置浸泡12 h后,采用回流提取法重复提取3次,每次1.5 h,旋转蒸发浓缩后收集组分使用0.45 μm滤纸过滤去除包含脂溶性成分的提取液,保留残渣并烘干至恒质量。精确称定五味子残渣5.00 g,以料液比1 g∶30 mL 的比例加入150 mL 蒸馏水搅拌均匀,再添加纤维素酶混匀,调节pH 至4.8,置于超声波提取仪中在50 ℃下以455 W 功率运转40 min,提取结束后4 ℃下以5 000 r·min−1离心20 min,去除沉淀并保存上清液。用Sevag 法向上清液中以3∶1 的体积比加入氯仿和正丁醇的混合溶液,振荡离心去除蛋白质,蒸发浓缩至稠膏状。将稠膏状物充分消解于5 倍体积的无水乙醇中在4 ℃下过夜醇沉,随后取沉淀物浸入80%乙醇溶液中充分洗涤并置于烘箱中50 ℃干燥至恒质量,用100 mL蒸馏水溶解再导入截留分子质量为1 000 u的透析袋中,在4 ℃下透析72 h,每隔12 h 更换透析所用超纯水,最后冷冻干燥得五味子多糖。
1.3.2 多糖含量和得率测定
以D-无水葡萄糖为对照,使用蒽酮比色法测定计算吸光度与葡萄糖浓度的关联并绘制葡萄糖标准曲线。回归方程为y=9.743 5x−0.025 8,回归系数R2=0.998 4。精确称定经最佳制备工艺所得的五味子多糖100 mg 溶于100 mL 超纯水,搅拌均匀得1 g·L−1五味子多糖水溶液,再取该溶液0.1 mL滴加纯水至1 mL,加入4 mL蒽酮试剂,沸水浴10 min,室温放置10 min后,在波长620 nm下测定吸光度。根据D-无水葡萄糖标准曲线计算样品溶液的多糖含量。五味子多糖得率的计算公式:
五味子多糖得率=(五味子多糖质量/五味子粉末质量)×100% (1)
1.3.3 五味子多糖提取的单因素试验
根据制造商说明的纤维素酶最佳使用条件,固定酶解pH 为4.8,提取温度为50 ℃。通过单因素试验考察加酶量、超声功率、超声酶解时间、料液比这4个因素对五味子多糖得率的影响。
1.3.3.1 不同加酶量的设置
加 酶 量 分 别 设 置 为150、300、600、1 200、1 800 U·g-1,在pH 为4.8、提取温度为50 ℃、超声功率为520 W、料液比为1 g∶20 mL、超声辅助酶解时间为60 min 的条件下提取五味子多糖,测定多糖得率。
1.3.3.2 不同超声功率的设置
超声功率分别设置为325、390、455、520、585 W,在pH为4.8、提取温度为50 ℃、料液比为1 g∶20 mL、加酶量为1 200 U·g-1、超声辅助酶解时间为60 min的条件下提取五味子多糖,测定多糖得率。
1.3.3.3 不同提取时间的设置
提取时间分别设定为10、20、40、60、80 min,在pH为4.8、提取温度为50 ℃、料液比为1 g∶20 mL、加酶量为1 200 U·g−1、超声功率为455 W 的条件下提取五味子多糖,测定多糖得率。
1.3.3.4 不同料液比的设置
料液比分别设定为1 g∶10 mL、1 g∶20 mL、1 g∶30 mL、1 g∶40 mL、1 g∶50 mL,在pH 为4.8、提取温度为50 ℃、加酶量为1 200 U·g−1、超声功率为455 W、超声辅助酶解时间为40 min的条件下提取五味子多糖,测定多糖得率。
1.3.4 响应面法优化五味子多糖提取工艺
以五味子多糖得率为响应值,根据Box-Behnken试验设计原理,选取加酶量、超声功率、超声酶解时间、料液比4 个试验因素,通过Design-Expert 软件进行4 因素3 水平的响应曲面分析,因子水平见表1。
1.3.5 抗细胞氧化应激能力测定
1.3.5.1 细胞中MDA和SOD的含量测定
将HepG2细胞接种到6孔板(2×105个·孔−1)上并孵育过夜。细胞经NAC(5 mmol·L−1)或五味子多糖(100、200、400 mg·L−1)预处理4 h 后,再加入LPS(10 mg·L−1)共同孵育24 h,依据制造商的说明书,采用丙二醛(MDA)含量检测盒和超氧化物歧化酶(SOD)活性检测盒测定各组细胞内MDA、SOD水平。
1.3.5.2 细胞中活性氧水平的测定
DCFH-DA 无荧光,能穿过细胞膜,之后被细胞内的酯酶水解生成不能通透细胞膜的DCFH,随后细胞内的活性氧(ROS)将氧化无荧光的DCFH,使其转化为有荧光的DCF。因此,使用DCFH-DA荧光探针探究HepG2细胞中的ROS水平。细胞处理 参 照1.3.5.1,之 后 将 浓 度 为10 μmol·L−1的DCFH-DA 荧光探针的DMEM 溶液与悬浮细胞在37 ℃共孵育20 min,用冷PBS洗涤细胞3次后使用流式细胞仪的FITC 通道检测各组的荧光强度,以所得平均荧光强度代表细胞内ROS 含量,随后通过FLOWMAX软件分析结果。
1.3.6 数据处理与统计分析
每组试验独立重复3 次及以上,使用Excel、Graphpad Prism 9.0 和Desgin Expert 13.0 软 件 进 行统计学分析、数据处理和绘图。采用普通单向方差分析和Dunnett’s 多重比较分析计算各组间的统计学差异。当P<0.05 时,确认组间比较差异具有统计学意义。
2 结果与分析
2.1 单因素试验结果分析
2.1.1 加酶量对超声辅助酶解后的多糖得率的影响
由图1可知,五味子多糖得率在加酶量为150~1 200 U·g−1时处于上升趋势,在1 200~2 400 U·g−1时多糖得率呈略微下降趋势。纤维素酶将纤维素分解成寡糖或单糖,破坏五味子细胞壁,提高细胞内容物分解效率。因此,当纤维素酶添加量提升时,酶解效率越高,细胞裂解越充分,导致多糖得率增加。当加酶量加大至2 400 U·g−1时,多糖得率不再增加,可能与植物细胞被充分酶解后得到的酶解产物(如二糖等)迅速积累抑制酶活性和酶解过程有关[18]。由此,选取600~1 800 U·g−1为后续Box-Behnken 响应面优化分析的加酶量水平范围。

图1 各因素对五味子多糖得率的影响Fig.1 Effects of factors on extraction yield of S. chinensis polysaccharides(SCPs)
2.1.2 超声功率对超声辅助酶解后的多糖得率的影响
由图1 所示,在超声功率325~455 W 内,五味子多糖得率随超声功率的增加而增大,在超声功率455~585 W 内,五味子多糖得率随超声功率的增加而降低。高能量超声波作用于植物细胞壁时,因空化作用复合机械振动作用产生极大压力破坏细胞并释放胞内溶质,随超声波功率的增大,细胞的破坏效率提升[19],继而提升五味子多糖提取率。但当超声波功率逐渐增加达到一定程度后,多糖得率下降,其原因可能是高超声功率带来的热效应加速了热不稳定多糖的分解,在纤维素酶的作用下使其加速降解为单糖、二糖等[20]。因此,选取390~520 W 为后续Box-Behnken 响应面优化分析的超声功率水平范围。
2.1.3 提取时间对超声辅助酶解后的多糖得率的影响
由图1 所得,随着超声辅助酶解时间的增加,五味子多糖得率在提取时间为10~40 min 内呈整体上升趋势,在提取时间为40~80 min 内呈整体下降趋势。超声辅助酶解时间过短时,超声破裂植物细胞的物理作用和纤维素酶酶促反应不足,所得多糖含量较低;当超声辅助酶解时间过长时,酶过度催化多糖酶解合并超声热效应导致多糖得率下降。综上考虑,选择提取时间20~60 min为后续Box-Behnken 响应面优化分析的提取时间范围。
2.1.4 料液比对超声辅助酶解后的多糖得率的影响
在五味子多糖提取过程中,料液比通过影响五味子与酶的接触面积,进而影响多糖得率。由图1 可知,当料液比在1 g∶10 mL~1 g∶30 mL 的范围内,五味子多糖得率随料液比的提升而增大。其原因是当水的体积较小时,底物与纤维素酶的接触面积较低,酶解不充分,所得多糖含量较。在料液比为1 g∶30 mL~1 g∶50 mL 的范围内,五味子多糖得率呈现下降趋势,原因可能由于水的比例过大,纤维素酶浓度下降,同时酶不易于底物充分接触,酶解程度下降,多糖得率较低。综合分析,选取1 g∶20 mL ~1 g∶40 mL 为后续Box-Behnken 响应面优化分析的料液比水平范围。
2.2 响应面法优化五味子多糖提取试验
2.2.1 五味子多糖提取工艺的BBD分析
根据单因素试验结果,将加酶量(A)、超声功率(B)、提取时间(C)和料液比(D)作为考察因素,以五味子多糖得率为响应值,设计4 因素3 水平Box-Behnken 响应面试验,对五味子多糖的提取工艺进行优化,以确定五味子多糖的最佳提取条件,试验设计和结果见表2。使用design expert 13.0软件将表2中所得数据结果进行多元回归拟合,得到五味子多糖得率对加酶量、超声功率、提取时间、料液比的二次多项回归方程如下:

表2 Box-Behnken试验设计及结果Table 2 BBD experiment design and results
YSCPs=21.29+2.63A+2.30B+2.45C−0.08D−0.03AB−0.007 5AC+0.207 5AD+0.34BC+0.277 5BD−
2.2.2 回归模型的方差分析
通过design expert 13.0软件进一步对表2中的数据进行回归分析、方差分析与显著性检验,所得结果如表3 所示:F值为39.42,表明模型具有显著性,P<0.05 说明分析后差异显著,P<0.000 1 说明分析后差异极显著;由此可知模型回归显著(P<0.000 1),有统计学意义,且失拟项的P为0.238 7,大于0.05,表明其检验不显著,建模成功;在回归模型中,一次项(A、B和C)和二次项(A2、B2和C2)都对五味子多糖得率影响极其显著,而二次项D2影响显著。由4 个因素的F值对比可得各因素对五味子得率的影响程度由大到小依次为加酶量(A)、提取时间(C)、超声功率(B)、料液比(D);方程拟合相关系数R2和修正相关系数AdjR2分别为0.975 3和0.950 5,表明该回归模型拟合程度良好;方程的变异系数CV%为5.011 3,说明模型可以较好地反映试验数据的真实性;通常信噪比Adeq Precision 大于4 代表模型良好,五味子多糖回归方程的信噪比为20.317 1,表明此模型可用于引导优化试验设计。综上所述,该模型可靠性优,可用预测五味子多糖最佳得率的工艺条件。

表3 方差分析与显著性检验Table 3 Analysis of variance and significance test
2.3 三维响应面图分析
利用试验数据生成三维响应面图(图2),图中反映了不同水平的各因素对五味子多糖得率的影响和各因素之间的交互影响关系。如图2a 所示,随着加酶量的增加,五味子多糖得率先上升后下降,而随着超声功率的增加,五味子多糖的提取率逐渐增加,当超声功率达到500.00 W 左右时,多糖得率最高;等高线表现为介于圆形与椭圆形之间,说明加酶量和超声功率的交互作用较弱。如图2b 所示,当超声功率和料液比分别为455.00 W和1 g∶30.00 mL时,随着提取时间和加酶量的不断增加,五味子多糖得率呈先上升后下降趋势,同时等高线表现为近圆形,说明提取时间和加酶量的交互作用极弱。如图2c 所示,当超声功率和提取时间分别为455.00 W 和40 min 时,随着料液比的增加到1 g∶22.26 mL,多糖得率上升至平衡水平,随后在料液比为1 g∶36.80 mL开始下降,随着加酶量的增加,多糖得率先迅速上升后缓慢下降;此外,由等高线为椭圆形表明加酶量和料液比的交互作用较强。如图2d 所示,当加酶量和料液比分别为1 200 U·g−1和1 g∶30.00 mL 时,随着超声功率和提取时间的不断累加,五味子多糖得率先升后降,二者影响下所呈现的响应面相对陡峭,说明它们与多糖得率的关联度均较大;等高线显示为近圆形,表明超声功率和提取时间的交互影响轻微。如图2e所示,当加酶量和提取时间各为1 200 U·g−1和40 min 时,且超声功率和料液比分别达到459.12 W和1 g∶30.63 mL时,响应面分析得到多糖得率最高,随着二者数值的增加,多糖得率先增加后下降,超声功率一侧响应面较为陡峭,而料液比一侧响应面较为平缓,说明超声功率较料液比对多糖得率的影响大;所组成的等高线为椭圆形,表明超声功率和料液比的交互影响较大。如图2f所示,当加酶量和超声功率分别为1 200 U·g−1和455.00 W 时,随着提取时间和料液比的不断累加,五味子多糖得率呈先上升后下降趋势;等高线显示为椭圆形,意味着此二因素的交互作用较强。综上所述,加酶量、超声功率和提取时间与料液比之间存在较为较强的交互作用,且与方差分析表中数据吻合。
2.4 优化提取参数与试验验证
响应面试验模型得到的各因素最优水平如下:加酶量为1 417.82 U·g-1,超声功率为499.38 W,提取时间为46.05 min,料液比为1 g∶31.84 mL,最优五味子多糖得率为22.39%。考虑到实际操作的可行性,将加酶量、超声功率、提取时间和料液比分别调整为1 420 U·g-1、500.00 W、46 min和1 g∶32 mL,在此条件下经3 次重复试验所得五味子多糖实际得率为22.25%,与预测值的相对误差仅为0.63%,说明Box-Behnken 响应面法优化得到的提取工艺条件真实可靠。
2.5 五味子多糖对LPS 诱导的细胞氧化应激的影响
为了研究五味子多糖是否能抑制由LPS 诱导的HepG2 细胞氧化应激,检测了LPS 和五味子多糖作用后的细胞中ROS、MDA 和SOD 水平。如图3所示,与对照组相比,LPS 组细胞的ROS、MDA 水平显著上升,SOD 水平则显著下降,表明LPS 成功导致HepG2 细胞发生氧化应激损伤;与LPS 处理组细胞相比,不同质量浓度的五味子多糖(100、200、400 mg·L−1)或N-乙酰半胱氨酸(NAC)预处理的细胞的MDA 和ROS 的含量降低,SOD 水平升高,表明五味子多糖通过剂量依赖性的方式恢复细胞SOD 水平、降低MDA 和ROS 积累量从而有效逆转LPS 诱导的HepG2 细胞氧化应激。与阳性对照NAC相比,400 mg·L−1的五味子多糖预处理细胞使其抗氧化能力提升,达到接近于NAC 所提供的抗氧化保护指标水平。
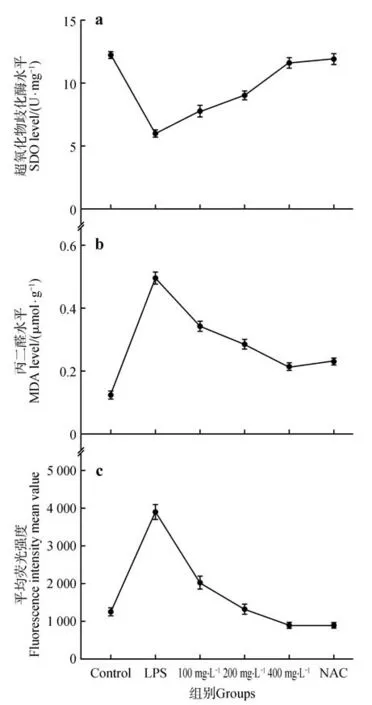
图3 五味子多糖对LPS诱导的细胞氧化应激的影响a.五味子多糖对细胞内超氧化物歧化酶水平的影响;b.五味子多糖对细胞内丙二醛水平的影响;c.五味子多糖对细胞内活性氧水平的影响Fig.3 Effect of SCPs on LPS-induced oxidative stress in HepG2 cells a.Effect of SCPs on SOD levels in cells;b.Effect of SCPs on MDA lev⁃els in cells;c.Effect of SCPs on ROS levels in cells
3 讨论与结论
本研究在单因素试验的基础上,利用Box-Bohnken Design 结合响应面法优化了超声辅助酶解提取五味子多糖的工艺条件,最优提取工艺参数为:加酶量为1 420 U·g−1,超声功率为500 W,提取时间为46 min,料液比为1 g∶32 mL,该条件下五味子多糖得率为22.25%(以干质量计)。有研究[21]论证说明应用超声波辅助提取法的五味子多糖得率近似于热水浸提法的2倍,其在最佳工艺条件下的平均得率为18.61%,同时宋海燕等[22]研究结果显示采取经单因素试验和响应面法优化得到的最佳纤维素酶酶解工艺提取五味子多糖的收获率为19.38%,而本试验结合了超声波提取法与纤维素酶酶解法,最终的五味子多糖得率高于上述研究结果,表明此二种方式的联合提取法的提取效率优于任意单一的超声波提取法或纤维素酶酶解法。Box-Bohnken Design 响应面分析得出在五味子多糖提取工艺的4个因素中,加酶量为最高影响因素,大于超声功率的影响程度。吴金松等[23]采取超声辅助酶法提取山药皮水溶性多糖,通过正交试验的极差和方差分析得出因素加酶量影响程度高于因素超声功率,与本研究分析结论一致。此外,研究发现五味子多糖以剂量依赖性的方式恢复细胞SOD 水平,降低MDA 和ROS 积累量,从而有效逆转LPS 诱导的HepG2 细胞氧化应激。本研究结果为五味子多糖的深入开发和利用提供了一定的理论参考与数据支撑。

