巨桉EgrWAT1基因克隆和功能初步分析
张昊楠 陈珊珊 徐建民 罗 萍 王晓萍 许志茹 范春节*
(1.东北林业大学生命科学学院,哈尔滨 150040;2.国家林业和草原局热带林木培育重点实验室,中国林业科学研究院热带林业研究所,广州 510520;3.林木遗传育种国家重点实验室,东北林业大学/中国林业科学研究院,哈尔滨/北京 150040/100091)
桉树是桃金娘科(Myrtaceae)桉属(Eucalyp⁃tus)的统称,又称尤加利树,原产于澳大利亚及其附近岛屿,自1890—1899 年引入我国已有130 多年的历史[1],目前多分布于我国海南、广东、广西等地。桉树作为生物质的主要来源之一[2],具有重要的经济价值,在造纸和家具行业中被广泛应用[3-4]。桉树具有生长速度快、材性好、基因组小等优点,因此对桉树材性改良育种可作为研究的重要方向[5]。如有研究通过反义4CL基因来降低巨尾桉(Eucalyptus urophylla×E.grandis)和尾叶桉(E.uro⁃phylla)植株的木质素含量,以降低造纸的生产成本同时减少环境污染[6-7]。因此若能筛选和鉴定出抗逆以及改良桉树的材性基因将对解决桉树材性改良应用和应对生物和非生物胁迫奠定重要基础。
拟南芥(Arabidopsis thaliana)walls are thin 1(WAT1)基因是Pesquet 等[8]在筛选百日草(Zinnia elegans)分化培养过程中与次生壁形成相关的数百个基因中被发现,其与紫花苜蓿(Medicago trun⁃catula)NODULIN 21(MtN21)为同源基因。拟南芥AtWAT1基因编码一种液泡膜蛋白,主要在木质部导管和纤维细胞等维管组织相关的器官中表达,同时发现AtWAT1在信号级联中主要定位于FRA3 下游和NST1/SND1上游,与纤维细胞中次生细胞壁的形成有关[9-10]。对WAT1突变体植株进行分析,发现木质部和束间纤维的次生细胞壁含量显著降低,导管厚度和形态没有显著变化。在这个过程中,生长素含量和转运受到抑制,生长素调控途径相关基因表达量下调,说明WAT1基因通过介导生长素的运输作用于纤维细胞中次生细胞壁沉积[11]。此外还发现WAT1基因通过响应光变化影响相关基因作用于次生壁的形成[12]。与之类似,Tang 等[13]研究证明棉花(Gossypiumspp.)的WATs(GhWATs)基因主要在根、节间、下胚轴表达量较高,棉花WATs基因突变植株中木质部发育受到抑制、木质素沉积增加、木质素合成增加和木质化相关基因表达量升高、生长素运输受阻。此外,GhWATs基因突变植物体中水杨酸(SA)含量升高并且激活SA 合成和信号应答相关基因的表达。Denance等[12]研究也证明在拟南芥WAT1突变体中SA 含量升高并且抑制了吲哚乙酸、色氨酸和葡萄糖苷合成。此外,在其他研究中发现SA 与生长素水平呈负相关[13-15]。而且在拟南芥、棉花和番茄(Solanum lycopersicum)中的研究发现其WAT1突变体植株都呈现出对黄萎病、青枯病和维管束病原体的抗性增强[13,16-17],说明WAT1可能是分子培育抗病品种过程中可利用的重要候选基因,将来可用于桉树的抗病育种研究。
本研究通过前期的转录组测序分析发现巨桉(Eucalyptus grandis)WAT1基因在次生木质部中以及在初生生长到次生生长转换过程中表达量显著升高。为进一步研究其功能,对巨桉中EgrWAT1基因克隆,探究其基因结构特征,并利用qRT-PCR技术对其在不同组织部位以及在SA、MeJA、高盐胁迫(NaCl)、缺磷(SH-P)、缺硼(SH-B)等胁迫处理下的表达模式进行分析。初步对EgrWAT1基因功能进行分析,期望为桉树应对逆境胁迫和材性改良的分子机制和分子育种提供理论依据。
1 材料与方法
1.1 试验材料
植物材料为巨桉无性系GL1,均培育于中国林业科学研究院热带林业研究所。选取生长状态良好且相对均一的植株,对植株分别进行SA、Me⁃JA、NaCl、SH-P、SH-B 处理。分别用0.1 mmol·L−1SA、0.1 mmol·L−1MeJA 进行喷施处理,分别在0、1、6、24、168 h后取叶片;200 mmol·L−1NaCl 进行灌根处理,分别在0、1、6、24、168 h 后取叶片;配制缺磷、缺硼的霍格兰营养液培养幼苗,0 h、6 h、24 h、48 h、96 h、21 d 后取叶片。每个处理5 株植株,每个处理3 个重复,每次取样统一采取4~6 的叶片。收集不同组织部位的样品以及各种激素和逆境处理后的样品迅速置于液氮中预冷,立即放置于冰箱中 −80 ℃保存,用于RNA提取。
1.2 方法
1.2.1 EgrWAT1基因的生物信息学分析
利用ExPASy(https://www.expasy.org/)数据库在线预测EgrWAT1 蛋白的基本理化性质,包括理论等电点、氨基酸长度、蛋白分子质量、外显子数量。利用WoLF PSORT(https://wolfpsort.hgc.jp/)预测EgrWAT1 蛋白亚细胞定位。利用在线网站Gene Structure Display Server 2.0(http://gsds.gaolab.org/)绘制EgrWAT1基因的基因结构。利用SOPM(NPS@:SOPMA secondary structure predic⁃tion(ibcp.fr))和SWISS-MODEL(https://swissmodel.expasyorg/interactive)在线工具分别进行EgrWAT1的蛋白质二级结构和三级结构分析;利用SMART(http://smart.embl-heidelberg.de/)在线网站分析蛋白质保守结构域。
通过NCBI BLASTP(http://blast.ncbi.nlm.nih.gov/)在线查找在拟南芥、水稻(Oryza sativa)、大豆(Glycine max)、苜蓿、葡萄(Vitis vinifera)和杨树(Populus trichocarpa)中巨桉WAT1的同源序列。通过PFAM 和SMART对不同植物的成员序列进行验证,并利用Phytozome 网站获得各成员的蛋白序列、基因序列和CDS 序列。利用MEGA 6.0 软件将各WAT1成员的氨基酸序列,利用内置的Clustal W程序进行多重序列比对,选用邻接法(Neighbor-Joining,N-J)构建系统进化树(校验参数Bootstrap值设置为重复1 000次)。
1.2.2 总RNA的提取及cDNA第一链的合成
收集约0.1 g 的材料放在冻存管中,迅速放入液氮中冻存。利用EASYspin 植物RNA 提取试剂盒(购于北京艾德莱生物科技有限公司)方法进行材料总RNA 提取,然后经过DNaseⅠ消化基因组DNA,得到纯化的总RNA。利用NanoDrop-2000仪器(购于美国赛默飞世尔科技公司)检测所提取RNA 的质量和浓度。利用Superscript Ⅲ反转录试剂盒(购于美国英杰生命技术有限公司)将提取的RNA进行cDNA第一条链的合成。
1.2.3 EgrWAT1基因克隆
从Phytozome13(https://phytozome-next.jgi.doe.gov/)数据库中筛选下载获得巨桉WAT1基因序列(Eucgr.D02535.1)。利用Primer Premier 5.0软件设计特异性基因克隆引物,由北京擎科生物科技有限公司合成。以巨桉cDNA 作为模板进行PCR 扩增。获得的目的片段连接到克隆载体pEASY blunt-T1 Cloning Kit(购于北京全式金生物技术有限公司)上,并将连接产物转化大肠杆菌(Esche⁃richia coli)感受态细胞DH5α,次日选取阳性菌液送至北京睿博兴科生物技术有限公司进行序列测定。
1.2.4 EgrWAT1基因表达模式分析
选取EgrEF2基因为内参基因并且根据EgrWAT1S和EgrWAT1L基因克隆后测序所得序列,利用Primer Premier 5.0 软件设计特异定量引物。利用SYBR Premix ExTaqⅡ试剂盒(购于北京宝日医生物技术有限公司)和Light Cycler 96 荧光定量分析仪(购于瑞士霍夫曼罗氏公司)进行qRT-PCR 分析。为避免试验误差确保数据准确性,试验设置3 个生物学重复、3 个技术重复。利用2-ΔΔCt法对所得数据进行相对定量分析,并利用GraphPad Prism 8 和SPSS 22 进行统计学分析和图片绘制。
1.2.5 过表达载体构建
采用限制性内切酶KpnⅠ和XbaⅠ(购于北京宝日医生物技术有限公司)对EgrWAT1S和EgrWAT1L基因的产物和植物过表达载体pROKⅡ质粒进行双酶切,酶切产物分别进行回收纯化。利用T4DNA 连接酶将回收产物连接到表达载体中,然后将构建的载体用热激法转入到大肠杆菌感受态细胞DH5α(购于北京天根生化科技有限公司)中。次日,在筛选平板上挑取单克隆菌落进行PCR 验证,选取阳性菌液送至北京睿博兴科生物技术有限公司进行序列测定。将序列验证成功的菌液置于冰箱中−80 ℃保存,重组质粒命名为pROKⅡ-EgrWAT1S和pROKⅡ-EgrWAT1L。阳性重组质粒通过电转化法转化至农杆菌(Agrobacteri⁃um)感受态细胞GV3101(购于北京天根生化科技有限公司)中,次日进行菌落PCR验证,验证成功的阳性菌落于冰箱中−80 ℃保存,用于后续转化试验。
2 结果与分析
2.1 EgrWAT1基因基本信息和蛋白质理化性质分析
Gene Structure Display Server 2.0 在线网站的基因结构分析结果显示,EgrWAT1基因与拟南芥WAT1基因一样均含有6 个外显子和5 个内含子(见图1A)。通过Phytozome 网站分析得知WAT1基因定位于6号染色体,EgrWAT1基因序列长度为2 073 bp、CDS 序列长度为1 071 bp,编码356 个氨基酸。预测蛋白相对分子质量为3.904 kDa、理论等电点为9.23;亚细胞定位预测分析结果显示EgrWAT1 主要定位在液泡、细胞膜,这与拟南芥WAT1 定位一致。其蛋白的二级结构由51.69%的α螺旋、4.49%的β折叠、26.12%的无规则卷曲和17.70%延伸链组成(见图1B)。对巨桉和拟南芥的WAT1 蛋白三级结构进行预测,结果发现其均含有大量α螺旋结构,也进一步证明其作为膜蛋白的结构(见图1C、D)。对EgrWAT1 蛋白保守结构域进行分析发现其含有2 个EamA 保守结构域,与拟南芥相同,且长度均为137 个氨基酸(见图1E)。

图1 EgrWAT1s基因的结构分析及蛋白二级、三级结构预测分析A.EgrWAT1s和AtWAT1s基因的结构分析;B.EgrWAT1蛋白二级结构预测分析(蓝色表示α螺旋,绿色表示β折叠,黄色表示无规则卷曲,红色表示延伸链);C.桉树EgrWAT1蛋白三级结构预测;D.拟南芥AtWAT1蛋白三级结构预测;E.EgrWAT1蛋白保守结构域分析Fig.1 Gene structure analysis and protein secondary and tertiary structure prediction of EgrWAT1 gene A.Gene structure analysis of EgrWAT1s and AtWAT1s;B.Prediction analysis of secondary structure of EgrWAT1 protein(Blue represented α helix,green represented β folding,yellow represented random curl,and red represented extended chain);C.Three-dimension structure prediction of EgrWAT1 protein;D.Three-dimension structure prediction of AtWAT1 protein;E.Conserved domains of EgrWAT1 protein
2.2 EgrWAT1基因系统进化分析
为了研究巨桉中EgrWAT1 和其他植物WAT1蛋白的遗传进化关系,利用MEGA 软件对拟南芥、水稻、杨树、葡萄、苜蓿、大豆WAT1 蛋白序列构建系统发育进化树(见图2)。结果发现,EgrWAT1基因与拟南芥WAT1基因(At1g75500)的蛋白质同源相似度为66.3%。EgrWAT1 与杨树的WAT1 蛋白同源性最高,也说明巨桉EgrWAT1与毛果杨(Pop⁃ulus trichicarpa)PtWAT1(Potri.011G148400.4.p)的亲缘关系最近,其他物种相对较远。

图2 EgrWAT1与其他植物WAT1蛋白的系统进化树At.拟南芥;Egr.巨桉;Gm.大豆;Mt.紫花苜蓿;Os.水稻;Pt.毛果杨;Vv.葡萄Fig.2 Phylogenetic tree analysis of EgrWAT1 protein and other plant WAT1 proteins At.Arabidopsis thaliana;Egr.Eucalyptus grandis;Gm.Glycine max;Mt.Medicago truncatula;Os.Oryza sativa;Pt.Populus trichocarpa;Vv.Vitis vinifera
2.3 EgrWAT1基因克隆
以巨桉的cDNA为模板,利用设计的克隆特异性引物(见表1)对巨桉WAT1基因进行PCR 扩增。经过克隆得到了EgrWAT1基因的2 个转录本,扩增产物经电泳检测后进行回收并将其进行测序(见图3)。分别获得长度为1 071、1 171 bp 的转录本序列,分别命名为EgrWAT1S和EgrWAT1L。将2条基因序列进行氨基酸序列分析发现,EgrWAT1S能够正常翻译成完整的氨基酸序列,并保留了WAT1 的功能结构域。而EgrWAT1L则是第2 个内含子保留的转录本,对其进行氨基酸序列分析时发现其出现提前终止事件,并不能形成完整蛋白结构,但是其能够转录,可能会通过转录行使作用。
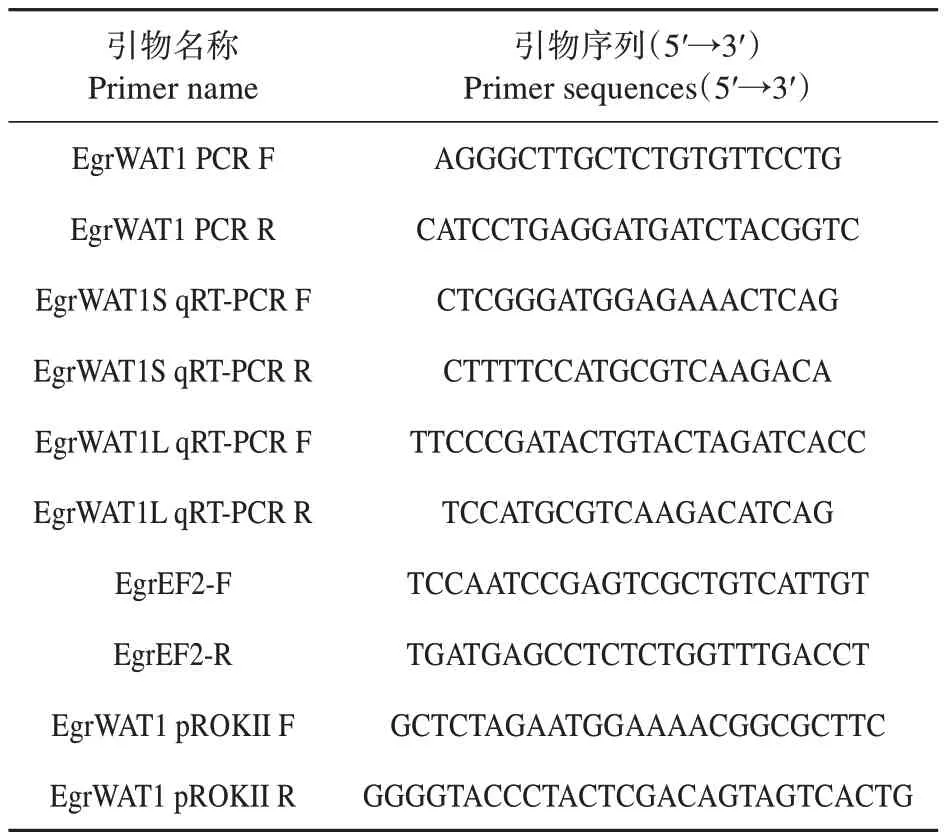
表1 引物序列Table 1 Primer sequences
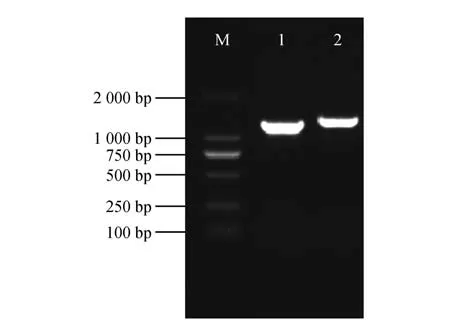
图3 EgrWAT1基因克隆M.DL2000 DNA Marker;1.EgrWAT1S基因PCR产物;2.EgrWAT1L基因PCR产物Fig.3 Gene cloning of EgrWAT1 M.DL2000 DNA Marker;1.PCR product of EgrWAT1S;2.PCR prod⁃uct of EgrWAT1L
2.4 EgrWAT1S和EgrWAT1L在不同组织部位及节间中的表达情况
为进一步了解WAT1基因的表达模式,通过实时荧光定量PCR 对转录本EgrWAT1S和EgrWAT1L基因在不同组织部位以及在不同节间的表达进行分析(见图4)。EgrWAT1S和EgrWAT1L在不同组织部位的表达呈现出明显不同的模式。EgrWAT1S在根中表达量最高,与之不同,EgrWAT1L在韧皮部表达量显著高于其他部位。而在不同节间,EgrWAT1S和EgrWAT1L表达趋势相似,但其表达量的变化呈现出显著不同。这些结果表明EgrWAT1L转录本可能通过转录后调控来影响WAT1基因的表达和作用,进而影响其在桉树生长发育过程中行使功能。

图4 EgrWAT1S 和 EgrWAT1L基因在不同组织部位中的表达模式A.EgrWAT1S基因在不同组织部位中的表达模式;B.EgrWAT1L基因在不同组织部位中的表达模式;C.EgrWAT1S基因在不同节间中的表达模式;D.EgrWAT1L基因在不同节间中的表达模式;A.茎尖;R.根;P.韧皮部;YL.幼叶;ML.成熟叶;XY.木质部Fig.4 Expression patterns of EgrWAT1S and EgrWAT1L in different tissues A.Expression pattern of EgrWAT1S in different tissues;B.Expression pattern of EgrWAT1L in different tissue parts;C.Expression pattern of EgrWAT1S in different internodes;D.Expression pattern of EgrWAT1L in different internodes;A.Apical meristem;R.Root;P.Phloem;YL.Young leaf;ML.Mature leaf;XY.Xylem
2.5 EgrWAT1S和EgrWAT1L基因在不同激素处理和胁迫下的表达情况
为了进一步研究EgrWAT1S和EgrWAT1L在应对激素或者胁迫时的表达量变化,开展了MeJA 和SA 不同处理时间其表达量的变化研究。结果表明:EgrWAT1S和EgrWAT1L的表达呈现出明显不同甚至相反的表达趋势。经过MeJA 处理6 h,EgrWAT1S转录本的表达量显著升高,与对照相比其表达量上调了5.65 倍,在168 h 时表达量达到对照的7.61 倍。与之相反,EgrWAT1L转录本表达量经过MeJA处理后表达量下降(见图5A、B)。与Me⁃JA 处理不同,经过SA 处理6 h 和24 h,EgrWAT1S的表达量显著上调,分别达到对照的156.95 和43.70 倍,而在168 h 处理后其表达量急剧下降,与对照相比都有明显的降低。而EgrWAT1L转录本在经过SA 处理1~24 h 时表达量变化均不明显,而在经过168 h 处理后,其表达量显著升高,达到对照的1.61倍(见图5C、D)。
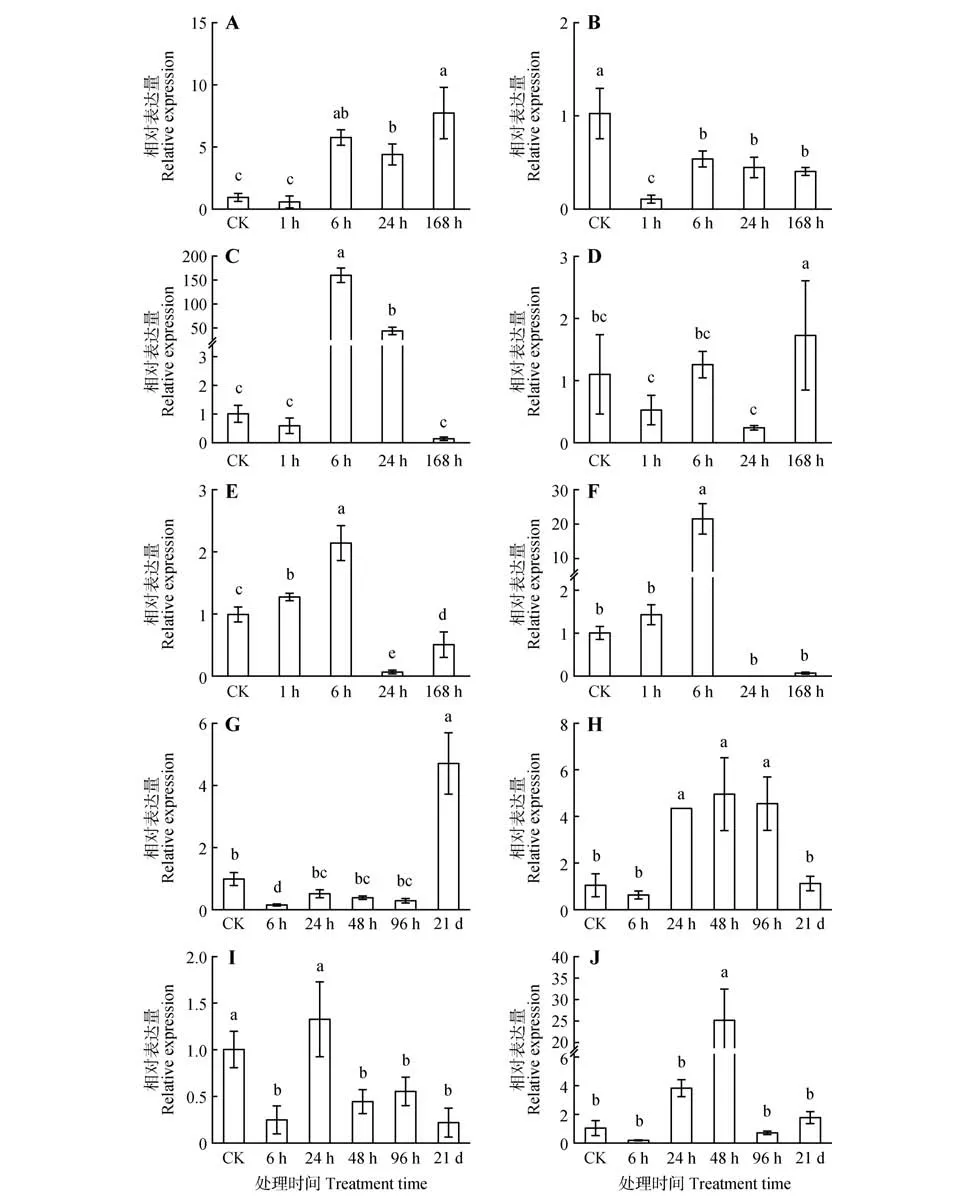
图5 EgrWAT1基因在不同激素和胁迫处理下的表达模式A,B.EgrWAT1S 和EgrWAT1L 基因分别在MEJA 处理不同时间下的表达模式;C,D.EgrWAT1S 和EgrWAT1L 基因分别在SA 处理不同时间下的表达模式;E,F.EgrWAT1S和EgrWAT1L基因分别在盐胁迫处理不同时间下的表达模式;G,H.EgrWAT1S和EgrWAT1L基因分别在缺磷处理不同时间下的表达模式;I,J.EgrWAT1S和EgrWAT1L基因分别在缺硼处理不同时间下的表达模式Fig.5 Expression patterns of EgrWAT1 under different hormone and stress treatments A,B.Expression pattern of EgrWAT1S and EgrWAT1L in different time of MEJA;C,D.Expression pattern of EgrWAT1S and EgrWAT1L in different time of SA;E,F.Expression pattern of EgrWAT1S and EgrWAT1L in different time of NaCl;G,H.Expression pattern of EgrWAT1S and EgrWAT1L in differ rent time of SH-P;I,J.Expression pattern of EgrWAT1S and EgrWAT1L in different time of SH-B
对盐胁迫、缺磷以及缺硼条件下EgrWAT1S和EgrWAT1L表达量变化的分析表明,经过盐胁迫处理6 h,EgrWAT1S和EgrWAT1L转录本的表达量显著升高,分别达到对照的2.15 和7.20 倍,而在24 h处理后其表达量显著降低,分别为对照的0.08 倍和0.02 倍(见图5E、F)。经过缺硼胁迫处理6 h,EgrWAT1S转录本表达量显著下降,达到对照的0.25 倍,而在24 h 处理后表达量显著升高。而EgrWAT1L转录本在经过处理48 h后表达量显著升高,达到对照的23.77倍(见图5G、H)。与上述2 种胁迫不同,缺磷胁迫处理下EgrWAT1S和EgrWAT1L转录本的表达呈现相反的表达趋势。经过缺磷胁迫处理21 d,EgrWAT1S转录本表达量显著上调,达到对照的4.70 倍。而EgrWAT1L转录本经过处理24 h 后表达量则显著上调,达到对照的4.11 倍,而在21 d 处理后其表达量急剧下降(见图5I、J)。这些结果表明在不同激素和胁迫处理过程中,EgrWAT1L转录本可能通过转录控制来影响EgrWAT1S的表达,进而影响到其蛋白行使功能。
2.6 EgrWAT1S 和EgrWAT1L 基 因 过 表 达 载 体构建
为进一步研究EgrWAT1S和EgrWAT1L转录本的功能,选取proKⅡ质粒作为过表达载体(见图6A),通过酶切连接的方式将2 个转录本构建到过表达载体proKⅡ上,然后将重组质粒转化GV3101农杆菌。经过筛选培养,挑取阳性单菌落进行摇菌和进一步的菌落PCR 验证。结果如图6B 所示,经过35S 启动子元件、NPT Ⅱ元件、LB元件、RB元件的检测,表明EgrWAT1S和EgrWAT1L转录本已整合到表达载体中并转化到根癌农杆菌(Agrobac⁃terium tumefaciens)中,可用于下一步的遗传转化。
3 讨论
WAT1基因是MtN21基因的同源基因,EgrWAT1基因编码蛋白含有2个跨膜结构域,均为MtN21 家族蛋白典型结构域EamA,约占总蛋白的77%。该结构域命名源于大肠杆菌中氨基酸输出蛋白、具有药物或代谢产物转运蛋白中的特征结构域[18-19],因此主要参与生长和生物活性物质转运等过程[20]。拟南芥WAT1 也包含2 个EamA 保守结构域,可推测其功能具有相似性。经过基因结构和系统进化树等分析表明巨桉EgrWAT1基因与毛果杨WAT1基因亲缘关系较近。经预测EgrWAT1 编码蛋白的亚细胞定位于液泡膜,该结果与拟南芥、棉花、香蕉(Musa nana)WAT1s 蛋白的研究结果[9,13,21]一致。由此推测巨桉WAT1蛋白可能作为液泡膜蛋白参与体内生长活性物质或激素运输有关。
本研究以巨桉无性系GL1 为材料对EgrWAT1基因进行克隆,发现存在着另一转录本EgrWAT1L。与EgrWAT1S相比,转录本EgrWAT1L是由于第二个内含子保留形成的1 个新的转录本。通过对其氨基酸序列预测分析发现转录本出现提前终止,不能翻译成完整的蛋白质。为了进一步研究EgrWAT1L的作用,因此与EgrWAT1S同时开展了其在不同组织部位和不同激素、胁迫条件下表达水平分析。值得注意的是,在不同组织部位中和不同胁迫处理下EgrWAT1S与EgrWAT1L转录本表现出明显不同甚至相反的表达模式。这些说明EgrWAT1L可能以一种转录后调控的方式影响WAT1基因起作用。在早期的研究中也发现,可变剪接是多细胞生物发育过程中一种重要的调控机制[22],通过转录后调节基因表达[23]。在杨树次生木质部发育过程中,NAC 结构域蛋白(SND)家族基因PtrSND1通过可变剪切形成新的剪接变体PtrSND1-A2IR形成新的蛋白质。但是新的蛋白质缺乏DNA 结合域和反式激活活性,与原PtrSND1相互作用形成功能缺失的异源二聚体,从而调控杨树木质部形成[24]。同时发现杨树中维管相关NAC 结构域(VND)基因的剪接变体PtrVND6和PtrSND1,可以发挥相互交叉调节作用,进一步调控木材形成中的转录网络[25]。内含子保留是可变剪接的一种主要模式,并且终止子提前出现的转录本可能会通过竞争性抑制从而抑制原蛋白。杨树WND基因通过保留内含子2形成新的剪接变体PtrWND1B-s和PtrWND1B-l在杨树纤维细胞壁增厚中起拮抗作用[26]。巨桉中EgrWAT1可能通过形成EgrWAT1L转录本在特定条件下负调控EgrWAT1S转录本从而在桉树生长发育过程中发挥作用,具体作用机制需要进一步研究。
不同组织部位的qRT-PCR 分析结果显示EgrWAT1S在茎中表达量较高,并且随着木质化程度增加其表达量也呈升高趋势,即在节间11 中表达量最高。因此EgrWAT1S基因可能参与木本植物初生生长到次生生长的转换,尤其是桉树的次生生长。Lee等[27]发现通过激活BR 缺陷型番茄的WAT1基因恢复了其次生木质部发育缺陷,而且进一步证实番茄SlWAT1是调节维管形成层中局部生长素稳态和信号输出以促进次生生长的关键调节因子。Ranocha 等[9]研究结果表明,拟南芥中WAT1在信号级联中FRA3的下游和NST1/SND1的上游发挥作用,促进次生细胞壁形成。这些结果都说明EgrWAT1基因在木材形成和次生木质部发育中起着重要的作用,而通过解析EgrWAT1基因功能以及调控其表达水平获得改变次生生长与次生木质部发育的转基因材料,可以用于后续的研究与生产。
前期大量的研究结果表明茉莉酸甲酯、水杨酸等生长调节剂可作为植物应对生物和非生物胁迫反应的信号分子,其在多种植物中都能减缓对病原菌侵染等逆境胁迫的伤害[28-30]。同时发现在水杨酸处理条件下可以提高桉树幼苗对青枯病的抗性[31-33]。并且已在多种植物中研究表明WAT1s的表达在SA 处理下呈现诱导作用,如拟南芥、棉花、香蕉[13,16,21]。这与本研究中结果一致,即外源施加SA 处理一定时间后均促进了巨桉中EgrWAT1S基因的表达,其中EgrWAT1S基因的表达量受SA 诱导较EgrWAT1L更为显著,在处理6 h后可以达到对照的170 倍左右。有研究表明乙烯反应相关因子ERF1基因可以通过正向调控木质素合成相关基因和提高木质素含量来提高对黄萎病的抗性[34]。因此,WAT1基因可能也可以在乙烯调控和木质素含量之间作为“中枢”基因,在抗病等方面发挥重要作用。之前研究表明在拟南芥、棉花和番茄的WAT1突变植株均有利于提高植株对黄萎病、青枯病等的抗性。目前,随着桉树栽培面积扩大其伴随而来的病害发生也日趋严重,其中青枯病和焦枯病发病率最高[35]。本研究构建过表达载体,期望通过获得巨桉WAT1转基因植株为进一步探索WAT1基因在生长调控、逆境胁迫过程中的作用具有重大意义。

