紫穗槐WRKY42基因耐盐碱性的功能研究
孙 宇 张艺腾 成慧慧
(1.黑龙江生态工程职业学院,哈尔滨 150080;2.黑龙江省农业科学院耕作栽培研究所,哈尔滨 150028;3.东北盐碱植被恢复与重建教育部重点实验室,东北林业大学生命科学学院,哈尔滨 150040)
植物所处的环境是多变的,但其能够对环境的刺激做出响应,植物感知胁迫信号并通过转录调节生理和生化途径来维持生长发育,如ABA 的积累就是针对干旱或盐碱胁迫信号的传导反应;H2O2、超氧阴离子等活性氧的增加同样是盐碱、干旱等逆境胁迫响应途径的信号分子[1-3]。非生物胁迫下信号传导表达调控作用的转录调节因子(TFs),许多TFs家族的成员参与非生物胁迫反应,包括NAC,拟南芥(Arabidopsis thaliana)转录激活因 子(ATAF)和 杯 形 子 叶(CUC),MYB,APETALA2/乙烯反应因子(AP2/ERF),WRKY 和碱性亮氨酸拉链(bZIP)等转录因子[4-5]。植物转录因子的特有结构在盐胁迫中发挥重要作用从而改善其生长发育。目前研究表明,转录因子既有抗逆性的正调节因子,如过表达SmyB2基因水稻(Oryza sativa)、SlWRKY28基因山新杨(Populus da⁃vidiana)等表现出对盐、冷和干旱胁迫的耐受性增强[6-7];也有少数转录因子为响应盐碱和干旱胁迫的 负 调 节 因 子[8-9],如GmWRKY27 通 过 与Gm⁃MYB174 作用负调节GmNAC29 而提高大豆(Gly⁃cine max)植株的抗逆性[10]。WRKY 蛋白与受体调节蛋白相互作用形成转录调控网络行使功能[11]。
WRKY 转录因子是植物应激反应中研究最广泛的家族[12]。因此,它在抗旱耐盐碱等胁迫中可能扮演非常重要的角色。WRKY 转录因子的结构差异决定其调节功能不同,明确植物的WRKY 转录因子结构是很必要的。近年来,研究表明WRKY 蛋白具有1 个或2 个WRKYGQK 基序和锌指基序的保守DNA 结合结构域,并通过作用于启动子上的W-box 顺式元件来调节基因表达[13]。根据WRKY 结构域的数量及其锌指基序的不同,WRKY 蛋白可分为3 组,第2 组是由5 个亚类组成[14]。此外,WRKY 蛋白含有谷氨酸富集结构域、脯氨酸富集结构域和亮氨酸拉链结构。综上,WRKY TFs 在植物应激反应以及植物生长和发育过程中的作用已被广泛研究。
紫穗槐(Amorpha fruticosa)为抗旱耐受盐碱性极强的灌木树种[15],颜淑云等[16]研究紫穗槐响应干旱胁迫对其生理生化指标影响的结果,揭示了其幼苗抵御干旱胁迫的生理适应性变化调节机制。紫穗槐逆境胁迫下的转录组学研究表明其AfWRKY42转录因子[17]上调表达,不过,AfWRKY42转录因子在耐盐碱方面调节作用的研究鲜见报道。为阐明AfWRKY42 转录因子的耐盐碱功能,本研究分离AfWRKY42基因并加以生物信息学分析,进一步检测盐碱胁迫下的表达特性,通过超表达本氏烟草(Nicotiana tabacum)植株的抗逆性表型和相关生理指标的检测,解析Af⁃WRKY42基因功能,为植物的分子编辑育种奠定基因资源基础。
1 材料与方法
1.1 材料与试剂
植物材料紫穗槐种子由延边大学吴松权课题组馈赠,本氏烟草种子由中国科学院东北地理与农业生态研究所卜庆云课题组馈赠。
大肠杆菌(Escherichia coli)JM109、根癌农杆菌(Agrobacterium tumefaciens)EHA105 由东北盐碱植被恢复与重建教育部重点实验室保存。
载体pMD18-T vector 购自大连宝生物有限公司,植物表达载体(pBI121-35S-MCS-GFP)由本实验室保存。
胰蛋白胨及酵母提取物粉末购自于默克化工技术(上海)有限公司,DNA凝胶回收试剂盒、质粒DNA 提取试剂盒和RNA 提取试剂盒等购于康为世纪生物科技有限公司。
限制性内切酶BamHⅠ、HindⅢ、KpnⅠ和SpeⅠ,T4-DNA 连接酶购自Fermentas 公司,高效率逆转录cDNA试剂盒和Blend-TaqDNA聚合酶购自TOYOBO生物公司;氨苄青霉素和潮霉素试剂购自Sigma公司,分别配制成50 g·L−1的储备液,其他试剂均为国产或进口分析纯试剂。
1.2 方法
1.2.1 基因的克隆及生物信息学分析
以逆境胁迫下紫穗槐转录组测序获得Af⁃WRKY42(登录号:MT859406)基因核苷酸序列为基础[18],设计特异性克隆引物AfWRKY42-F1 和R2(表1)。通过RT-PCR 的方法扩增AfWRKY42基因,将F1/R2 引物与提取的紫穗槐幼苗RNA 反转录成cDNA 模板混合,再加入Blend-TaqDNA 聚合酶组成PCR 反应体体系,在9700 PCR 仪上扩增双链DNA,琼脂糖凝胶电泳并纯化DNA,连接插入pMD18-T载体上,转化克隆到菌株JM109,以限制性内切酶BamHⅠ/HindⅢ酶切pMD18-T-AfWRKY42质粒DNA 鉴定,送样至吉林省库美生物科技有限公司测序。
以测序获得的核苷酸序列为比较基准,通过NCBI 在线网站分析该基因的ORF,并用ProtParam工具进一步得到编码蛋白质的理化性质(https://web.expasy.org/protparam/);利用在线网站SMART:Main page(http://smart.embl-heidelberg.de)分析预测其保守结构域;在NCBI 上Blastp 在线分析软件比对获得同源性较高的序列,并使用在线网站Clustal Omega 进行多序列比对,进一步应用MEGA6.0软件最大邻接法(NJ)构建系统发育进化树(bootstrap 值设为1 000);以及在https://services.healthtech.dtu.dk/service.php?TMHMM-2.0 网站预测其跨膜结构,采用在线工具纽普生物-NovoPro预测其蛋白二级结构,NetPhos 3.1(https://services.healthtech.dtu.dk/service.php?NetPhos-3.1)分析其磷酸化位点。
1.2.2 AfWRKY42 基因的表达特性分析及蛋白亚细胞定位检测
为了分析AfWRKY42基因在紫穗槐不同组织器官的差异表达特性,选取3年生紫穗槐在生长发育过程中的不同组织(根、嫩茎、嫩茎表皮、叶、花序),提取总RNA,并反转录cDNA。
选取水培法培养长势一致的4周紫穗槐幼苗,以150 mmol·L−1NaCl 和30 mmol·L−1NaHCO3分别处理0、6、12、24、48 h,提取其根和叶的RNA。取其总RNA 作为模板反转录成cDNA。将cDNA 稀释100 倍作为实时荧光定量的PCR 检测模板。内参基因引物和AfWRKY42特异定量性引物(见表1),按Guan 等[19]方法在MxPro-Mx3000P 系统进行表达量数据采集,应用DPS 软件的邓肯法进行数据差异性分析,以Origin软件作图。
通过生物信息学网站http://psort.hgc.jp/form.html 进行亚细胞预测分析,确定AfWRKY42 蛋白发挥功能的场所。再加以试验研究验证,根据植物表达载体模型,增设KpnⅠ/SpeⅠ位点引物,PCR产物双酶切电泳,回收DNA 片段,连接,构建pBI121::AfWRKY42::GFP 重 组 质 粒,并 以PEG6000为介导的DNA转化拟南芥叶肉原生质体方法,转基因瞬时表达系统检测35S-AfWRKY42-GFP 融合蛋白的荧光表达,验证AfWRKY42 蛋白的亚细胞表达发挥作用的位置。
1.2.3 过表达AfWRKY42 烟草对盐碱胁迫的耐受性分析
以含有PBI121::AfWRKY42::GFP质粒的农杆菌EHA105 侵染四叶期的野生型本氏烟草的叶片,在50 mg·L−1的Kana 分化培养基上筛选再生抗性芽,进一步分化培养获得抗性转化子,PCR 检测基因的染色体整合,Kana抗性平板播种筛选,并收获抗性的转基因种子至T3代,对T3代的激素抗性植株进行qRT-PCR 分析[20],依据转AfWRKY42基因植株的表达量,选择T3 代株系作为后期胁迫试验材料。
将同期收获的野生型(WT)和转基因(T3 代#1,#4,#5)烟草种子点播在土中,烟草培养2 个月后,对WT 和过表达AfWRKY42的3 个不同株系分别 进 行 不 同 浓 度 的NaCl(200、300 mmol·L−1),NaHCO3(300、400 mmol·L−1)灌根处理7 d,每天处理1 次,处理后土壤pH 分别约为8.4 和9.2。于光/暗为16 h/8 h、(25±1)℃培养,处理其表型有变化后,以Fluor Cam 荧光成像检测系统对最大光合效率(Fv/Fm)的分析,考察植物对逆境胁迫的抗性,自顶叶向下第3 片开始取3 片叶检测其叶绿素荧光参数、叶绿素含量[21],设置n=3次重复。
2 结果与分析
2.1 AfWRKY42基因的克隆与生物信息学分析
2.1.1 AfWRKY42基因的克隆
以RT-PCR 扩增双链DNA 片段,反应产物电泳显示:在1 300 bp 左右处有DNA 条带(图1A),将其回收并与pMD-18-T 进行连接、转化,在Amp平板上筛选到阳性克隆,扩大培养后提取重组质粒DNA,以BamHⅠ/HindⅢ双酶切电泳结果表明,有目的DNA 条带(图1B)。重组质粒送样测序结果表明与转录组测序的核苷酸序列相同,AfWRKY42登录NCBI GenBank基因号为MT859406。

图1 紫穗槐AfWRKY42基因的PCR克隆与酶切鉴定A.RT-PCR 产物(P)电泳;B.#1,pMD18-T-AfWRKY42的质粒DNA 双酶(BamHⅠ/HindⅢ)切电泳鉴定;M.DNA MarkerFig.1 PCR cloning and enzyme digestion of the AfWRKY42 gene A.Electrophoresis of RT-PCR product(P);B.#1,electrophoresis of identification of plasmid DNA double enzyme(BamHⅠ/HindⅢ)di⁃gestion of pMD18-T-AfWRKY42;M.DNA Marker
2.1.2 AfWRKY42蛋白的生物信息
克隆到AfWRKY42基因开放阅框1 356 bp,编码451个氨基酸,其蛋白分子质量为49.83 kDa;分子式为C4125H6896N1356O1679S330,理论等电点为4.99,该蛋白的不稳定系数为52.54,平均亲水系数为0.947,为疏水蛋白。软件预测到AfWRKY42 蛋白含有1 个WRKY 结构域(210~270),2 个低复杂区域和1 个螺旋区域(图2A)。对AfWRKY42 蛋白的二级结构进行预测,有14 个α螺旋和9 个β转角(图2B)。NJ法构建AfWRKY42的系统发育树(图2C)发现:它和木豆(Cajanus cajan)的WRKY47、藜豆(Mucuna pruriens)的WRKY42 蛋白序列亲缘关系最接近。同时软件分析AfWRKY42蛋白与其他物种的Motif结构图显示出含有1个WRKYGQK 结构域(图2D),磷酸化位点预测大于0.75的有20个。

图2 AfWRKY42蛋白的生物信息A.AfWRKY42的结构图谱;B.蛋白的二级结构预测(α螺旋为蓝色,β转角为绿色,延伸链为红色,无规则卷曲为紫色);C.系统发育进化树,木豆(CcWRKY47,CcWRKY42),刺毛黧豆(MpWRKY42),鸡血藤(SsWRKY42),高粱蚜(GsWRKY42),大豆(GmWRKY42),菜豆(PvPHA⁃VU),豇豆(VuWRKY31),小豆(VaWRKY6),绿豆(VrWRKY6),相思子(ApWRKY42),藜豆(CaWRKY42);D:(a)AfWRKY42 蛋白Motif 结构图,(b)Motif位置图和共有基序图Fig.2 Bioinformation of AfWRKY42 protein A.Structural mapping of AfWRKY42;B.Predicted secondary structure of AfWRKY42 proteinalpha helix is blue,beta corner is green,extended chain is red,and irregular curl is purple;C.AfWRKY42 phylogenetic tree,Cajanus cajan(CcWRKY47,CcWRKY42),Mucuna pruriens(Mp⁃WRKY42),Spatholobus suberectu(sSsWRKY42),Melanaphis sacchar(iGsWRKY42),Glycine max(GmWRKY42),Phaseolus vulgari(sPvPHA⁃VU),Vigna unguiculata(VuWRKY31),Vigna angulari(sVaWRKY6),Vigna radiata(VrWRKY6),Abrus precatoriu(sApWRKY42),Cicer arieti⁃num(CaWRKY42);D(.a)Motif position map,(b)Motif shared motif map
2.2 AfWRKY42 基因的表达特性及蛋白亚细胞定位
2.2.1 AfWRKY42组织器官表达特性
通过荧光定量PCR 技术检测紫穗槐Af⁃WRKY42基因在根、嫩茎、嫩茎表皮、叶、花序中的表达情况,发现AfWRKY42基因在上述各个组织器官中都有表达,该基因在嫩茎的表皮中表达量最高,而在根中的表达量最低(作为对照),叶中的表达量是根的5.1 倍,在嫩茎的表皮中表达量是根中的11.3倍(图3)。

图3 在根、嫩茎、嫩茎表皮、叶、花序组织中AfWRKY42基因的表达特征Fig.3 Pattern of AfWRKY42 gene expressed in root,stem,epidermal,leaf,and inflorescence respectively
2.2.2 盐碱胁迫诱导AfWRKY42 基因的表达特性
本研究又检测了紫穗槐分别在盐(NaCl)、碱(NaHCO3)胁迫处理下,AfWRKY42在根和叶中不同胁迫时间的表达量。荧光定量PCR 检测表明:在150 mmol·L−1NaCl 胁迫下,AfWRKY42在叶片中6 h 相对表达最低,随后升高,在12 h 表达量为对照组的1.8 倍(图4A~B);在根中呈现先上升后下降的趋势,在12 h 表达量是对照组的5.3 倍,达到表达峰值;紫穗槐在30 mmol·L−1NaHCO3处理下,AfWRKY42基因在叶片中,处理12、24 h 分别为0 h表达量的3.1、1.5倍,在胁迫处理48 h之后,表达量虽有下降,但不显著;在根中同样是12 h 表达量最高,是0 h 时表达量的4.5 倍,之后随着胁迫时间的延长,表达量下降(图4C~D)。总之,盐碱胁迫诱导AfWRKY42基因在根和叶中表达升高,表明该基因响应盐碱逆境。

图4 AfWRKY42基因盐碱胁迫的表达特性A.在150 mmol·L−1 NaCl 胁迫处理下AfWRKY42 基因紫穗槐叶的相对表达模式;B.叶的相对表达模式;C.在30 mmol·L−1 NaHCO3胁迫处理下AfWRKY42 基因紫穗槐根的相对表达模式;D.叶的相对表达模式;*和**分别表示不同胁迫时间的相对表达量与对照组之间在P<0.05和P<0.01水平上差异显著;数据为平均值±标准误差,下同Fig.4 Expression characteristics of AfWRKY42 gene under saline stress A.Relative expression pattern of AfWRKY42 gene in Sophora japonica leaves under 150 mmol·L−1 NaCl stress treatment;B.Relative expression of AfWRKY42 in leaves;C.Relative expression pattern of AfWRKY42 gene in roots of Sophora japonica under 30 mmol·L−1 NaHCO3 stress treatment;D.Relative expression patterns of leaves* and ** indicate significant differences in relative expression between different stress times and the control at the P<0.05 and P<0.01 levels,respectively;Data are mean±standard error,the same as below
2.2.3 AfWRKY42蛋白的亚细胞定位验证
以克隆AfWRKY42基因编码蛋白的氨基酸为基础,在线选择植物蛋白亚细胞定位预测,初步预测结果:定位在细胞核中为主,其概率为65.0%,在微体中的概率为10.0%,在线粒体基质中概率为10.0%,在细胞膜中的概率为0。在Olympus 荧光显微镜下观察转化的拟南芥原生质体细胞的压片,检测到35S::AfWRKY42::GFP 融合后绿色荧光蛋白在细胞核中呈现绿色荧光表达(图5),展示其融合蛋白的细胞核定位,表明AfWRKY42 是定位在细胞核的转录因子,其发挥功能的场所在细胞核。这与上述PSORT软件预测的亚细胞位置为细胞核的高概率相一致,表明AfWRKY42 转录蛋白在细胞核中发挥转录调节的作用。

图5 AfWRKY42蛋白在拟南芥原生质体中的亚细胞定位A.35S::GFP的绿色荧光蛋白;B.明场;C.合并图;D.35S::AfWRKY42::GFP的绿色荧光蛋白;E.明场;F.合并图Fig.5 Subcellular localization of AfWRKY42 protein in Arabidopsis protoplasts A.Green fluorescent protein;B.Bright field;C.Merge of 35S::GFP;D.Green fluorescent protein;E.Bright field;F.Merge of 35S::GFP Of 35S::Af⁃WRKY42::GFP
2.3 过表达AfWRKY42基因烟草的鉴定
为了鉴定目的基因的功能而转化本氏烟草,将野生型烟草(WT)作为阴性对照,PBI121::Af⁃WRKY42::GFP质粒作为阳性对照,PCR 检测Kana抗性的再生植株的基因组整合结果(图6A),只有阴性对照没有扩增出条带,转基因烟草条带大小与质粒的一致,说明AfWRKY42整合到烟草基因组DNA 上。转AfWRKY42基因植株有与阳性对照相同的DNA,表明获转基因株系。在经过2 代筛选后获得T3 代的阳性植株,qRT-PCR 分析表明,转AfWRKY42的T3#1,#4,#5 植株表现出更高的表达量(图6B),获得过表达的#1,#4,#5 株系作为后期胁迫的试验材料。

图6 转AfWRKY42基因烟草的鉴定A.AfWRKY42基因整合的PCR 检测(M.DNA 标准;CK+.阳性对照;CK-.阴性对照;1~4.T0代不同转基因株系);B.AfWRKY42转基因烟草相对表达量(WT.野生型植株;#1~#5.转基因植株);*和**分别表示转基因株系与WT之间在P<0.05和P<0.01水平上差异显著;下同Fig.6 Identification of transgenic tobacco with AfWRKY42 gene A.PCR identification of AfWRKY42 transgenic tobacco(M.Marker;CK+.Positive control;CK-.Negative control;1−4.T0 generations of different trans⁃genic lines);B.AfWRKY42 transgenic tobacco relative expression analysis(WT.Wild-type plants;#1~#5.Transgenic plants);The relative expres⁃sions are at the **P<0.01 level;The standard error of three biological replicates;* and ** indicate significant differences between transgenic strains and WT at the P<0.05 and P<0.01 levels,respectively,as follows;the same as below
2.4 过表达AfWRKY42烟草对盐碱胁迫的耐性
对转AfWRKY42基因烟草进行200、300 mmol·L−1NaCl的盐胁迫处理后,从植物表型上看,植株叶片明显萎蔫变黄,野生型更为严重(图7A);取3片叶进行叶绿素荧光检测(图7B),对最大光量子效率(Fv/Fm)进行统计分析发现,叶片从上到下Fv/Fm逐渐升高,而且转基因株系的明显高于对照组WT叶片的Fv/Fm(图7D);对其叶绿素含量测定的结果同样也呈现比对照升高的趋势(图7C)。转AfWRKY42基因烟草的Fv/Fm和叶绿素含量显著高于WT,表明转化AfWRKY42烟草对盐胁迫的耐性高于WT。

图7 盐(NaCl)胁迫对转AfWRKY42基因烟草影响A.植株表型;B.叶绿素荧光;C.叶绿素含量;D.最大光量子效率(Fv/Fm)Fig.7 Effect of salt(NaCl)stress on transgenic tobacco with AfWRKY42 gene A.Plant phenotype;B.Chlorophyll fluorescence;C.Chlorophyll content;D.Maximum light quantum efficiency(Fv/Fm)
转AfWRKY42基因烟草分别在300、400 mmol·L−1NaHCO3处理第7天时,表型出现明显差异(图8A),野生型植株明显枯萎,荧光检测同样可以看出转基因植株与WT 之间的差异(图8B)。检测到转基因植株叶绿素和最大光量子效率(Fv/Fm)高于WT(图8C~D),表明过表达植株的光合作用强于WT,WT受NaHCO3胁迫的伤害比转基因的大,转基因#4株系抗性最为明显,表现出较强的耐碱性盐的特性。
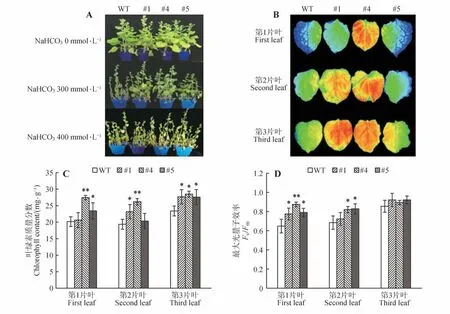
图8 转AfWRKY42基因烟草对NaHCO3胁迫的耐性A.植株表型;B.叶绿素荧光;C.叶绿素含量;D.最大光量子效率(Fv/Fm)Fig.8 Tolerance of transgenic tobacco with AfWRKY42 to NaHCO3 stress A.Plant phenotype;B.Chlorophyll fluorescence;C.Chlorophyll content;D.Maximum light quantum efficienc(yFv/Fm)
3 讨论
紫穗槐作为公路和斜坡保护的重要树种,在中国东北广泛种植。研究表明紫穗槐幼苗以生理调节的适应性机制来抵御逆境胁迫,是抗盐性较强的物种。此外,WRKY 转录因子是植物在非生物逆境胁迫的抗逆调节蛋白。WRKY TFs 广泛参与植物发育及各种生物/非生物胁迫反应[22],本研究检测紫穗槐中AfWRKY42基因在嫩茎的表皮中表达量最高,随着盐(NaCl)胁迫的时间延长而表达量呈现增加的趋势,碱性盐(NaHCO3)胁迫诱导增加更加显著,与AtWRKY11和AtWRKY17基因受盐胁迫处理影响,表达量上调相同,表现出抗逆性基因的特点[23],推测AfWRKY42基因可能是抗盐碱性的调节基因。
为了进一步研究AfWRKY42 转录因子的抗盐碱性调节功能,本研究克隆了AfWRKY42基因,生物信息分析印证它在210~270 氨基酸处有1 个WRKY 结构域,属于WRKY 蛋白家族IIb 亚家族[24]的疏水蛋白,而且是与木豆的WRKY47、藜豆的WRKY42 蛋白序列亲缘关系最接近的转录因子。亚细胞定位与蛋白质的功能有着非常重要的联系,蛋白质在细胞中的正确定位是细胞系统高度有序运转的前提保证。通过AfWRKY42蛋白氨基酸的组成预测在细胞核的概率最大;本研究还通过转化的拟南芥原生质体细胞检测,观察到Af⁃WRKY42-GFP 融合绿色荧光蛋白在细胞核,表明AfWRKY42 在细胞核发挥转录因子功能,与前人研究的转录因子在细胞核行使作用位置[25]相同。为了在植物中探究AfWRKY42响应盐碱胁迫的功能作用,本研究在异源植物本氏烟草过表达Af⁃WRKY42基因(图6),盐(NaCl)碱(NaHCO3)的胁迫处理后,植株叶片明显萎蔫变黄,而野生型更为严重,并且检测到叶片的叶绿素荧光的Fv/Fm和生理上的叶绿素含量都是转基因株系明显高于对照组WT。目前,研究植物响应盐胁迫的生长、形态和光合作用,显示在盐胁迫的耐盐性与Fv/Fm相关,反应光合作用调节而体现耐盐碱生理特性。过表达AfWRKY42植株的光合作用强于WT,受盐碱处理引起的伤害比WT株系的小,表现较强的耐盐碱的特性,对响应盐碱胁迫能够发挥重要抵御性调节作用。总而言之,本研究揭示AfWRKY42基因响应盐碱胁迫提高植物的耐受性,可能是调节紫穗槐的叶绿素合成,从而影响光合作用以赋予对盐碱或其他非生物胁迫抗性的基因。

