外源蔗糖影响AtKEA1和AtKEA2调节拟南芥幼苗根的生长
郑 晟 高海霞 苏 敏 卢尚欢 张腾国 武国凡
(1.西北师范大学生命科学学院,兰州 730070;2.青海师范大学高原科学与可持续发展研究院,西宁 810016)
K+/H+反向转运蛋白(KEAs)是H+耦合的协同转运蛋白,其功能是通过膜转移K+以交换质子(H+)[1-4]。拟南芥(Arabidopsis thaliana)中KEA 基因家族包括6 个成员,即AtKEA1(At1g01790)、At⁃KEA2(At4g00630)、AtKEA3(At4g04850)、AtKEA4(At2g19600)、AtKEA5(At5g51710)和AtKEA6(At5g11800)[5-6]。根据生物信息学分析发现,At⁃KEAs基因家族分为2 个分支,第1 个分支是At⁃KEA1~3,第2 个分支是AtKEA4~6。拟南芥KEA1和KEA2定位于叶绿体内膜,它们具有很高的氨基酸序列相似度(84.5%)[2],其中N-端结构域决定其亚细胞定位,并且正确的亚细胞定位对于AtKEA1和AtKEA2 生物学功能的执行非常重要[7]。当KEA1 和KEA2 功能缺失时,其突变体叶片的叶绿体结构肿胀,包膜受损,类囊体密度降低,从而导致光合作用效率降低[8]。这表明AtKEA1 和At⁃KEA2在调节叶绿体内K+动态平衡和pH 平衡中发挥重要功能[8-9]。
叶绿体中光合作用产生的蔗糖是植物重要的能量来源。蔗糖既是营养物质,也是信号分子。内源蔗糖通过激活或抑制光合作用来调节体内的蔗糖水平。低浓度的蔗糖激活光合作用和光合产物的运输,而高浓度的蔗糖促进光合产物的储藏[10]。此外,在外源添加蔗糖的条件下,植物选择性地激活或者抑制相关基因的表达以更有效和精细的方式进行生长发育和代谢。有研究发现,外源施加50 g·L−1蔗糖可以增加桃子(Prunus persica)根系的总体积和总表面积,促进侧根的数量和生长,并促进SnRK1的活性;外源海藻糖的施用会抑制植物的根系生长,蔗糖处理可以逆转海藻糖对SnRK1 酶活性和根系生长的抑制作用[11]。另外,蔗糖与植物激素信号途径具有交联作用,如蔗糖与ABA 参与种子或者果实的成熟过程[12];植物的根尖是生长素合成的主要器官,蔗糖的含量水平与生长素的合成转运密切相关[13];蔗糖和乙烯含量或信号途径存在负调控[5];细胞分裂素能够调节蔗糖的代谢等[14]。
目前,定位于叶绿体的钾离子转运蛋白参与植物根系生长发育的研究鲜有报道;钾离子反向转运体介导蔗糖代谢及信号网的功能也未见相关研究。此外,对于KEA 基因家族生物学功能及其分子机制的探究还处于起步阶段,因此,进一步挖掘KEA 基因家族各成员的生物学功能,将有助于深入了解钾离子及pH 平衡在光合作用乃至生长发育中的生理与分子机制。
本研究采用植物生理学、生物化学以及分子生物学等技术方法,利用拟南芥KEA 功能缺失突变体,研究拟南芥KEA1 与KEA2 在外源蔗糖应答中的生理作用及其相关机制,进一步揭示植物KEA 转运蛋白的生物学功能,阐明外源蔗糖对植物离子转运蛋白的作用机理,为植物抵御逆境以及揭示植物生长发育规律奠定新的理论基础。
1 材料与方法
1.1 试验材料和生长条件
拟南芥野生型(Col-0)由西北师范大学生理生化与分子生物学实验室保存,kea1(SAIL_586_D02)和kea2(SALK_096774)的T-DNA 插入突变体从拟南芥生物资源中心(ABRC)订购。kea1kea2双敲除突变体是通过将kea1与kea2遗传杂交产生。利用SIGnAL 网站设计的等位基因特异性引物进行PCR 筛选,确定纯合突变株系(http://signal.salk.edu)。
培养皿中生长的幼苗,种子在体积分数20%次氯酸钠中消毒10 min,然后用无菌去离子水冲洗5 次。将无菌种子种在pH 为5.7~5.8 的Murashige-Skoog(MS)培养基上,在4 ℃黑暗中春化3 d 后,将幼苗放置于培养箱中22 ℃、光照16 h/黑暗8 h 的周期下垂直生长10 d,光照强度为100 μmol·m−2·s−1。
1.2 碘化丙啶(PI)染色
PI 染料可以使细胞壁着色而凸显根的结构。取培养10 d 的拟南芥幼苗根系浸入10 μg·mL−1PI染液,孵育3 min,用ddH2O 清洗3 次,制片后在激光共聚焦显微镜(Leica SP8,德国)下观察。
1.3 组织化学染色
用硝基蓝四氮唑(NBT)染色法检测植物叶片中超氧阴离子(O·−2)的分布。将幼苗放入0.5 mg·mL−1的NBT 溶液浸泡1 h,然后将幼苗在煮沸的混合液(V(乳酸)∶V(甘油)∶V(乙醇)=1∶1∶3)中脱色1 min。每个处理至少使用3株幼苗。
1.4 内源糖含量测定
采用高效液相色谱法(HPLC-ELSD)检测,测定样品中糖组分含量,采用高效液相色谱仪(Wa⁃ters e2695,美国),配置Waters2998 检测器。称取0.5 g 样品,加入80%乙腈溶液1 mL;低温水浴超声30 min,4 ℃ 12 000g离心5 min,取上清液,重复提取2 次合并上清液;过0.22 μm 有机相滤膜,放入−20 ℃冰箱待上机检测。检测条件:CNW氨基柱(150.0 mm×4.6 mm,3.5 μm),流动相为V(乙腈)∶V(水)=3∶1,进样量5 μL,柱温30 ℃,流速1 mL·min−1,漂移管温度85 ℃,雾化温度70 ℃,增益值10。在该色谱条件下,葡萄糖保留时间约为10.5 min,果糖保留时间约为8.9 min,鼠李糖保留时间约为6.2 min。
1.5 转录组测序(RNA-seq)
RNA-seq 由上海欧易生物科技(中国)有限公司测序。使用mirVana™ miRNA ISOlation Kit(Am⁃bion)提取拟南芥总RNA,用带有Oligo(dT)的磁珠富集mRNA。使用TruSeq Stranded mRNA LTSam⁃ple Prep Kit(Illumina)构建文库,然后在Illumina测序平台(Illumina HiSeq X Ten,美国)测序。利用NGS QC Toolkit 软件质控并去除接头,得到高质量的clean reads。将clean reads 使用hisat2 比对到拟南芥的参考基因组。基因FPKM 表达量值使用cufflinks 软件定量。挑选出P值小于0.05 的差异基因,利用热图的形式展示差异基因在不同样本间的表达模式。文中转录组数据制作的韦恩图、箱线图和火山图等基于上海欧易云平台软件绘制(https://cloud.oebiotech.com/task/)。
1.6 实时荧光定量PCR分析
称取适量生长10 d的野生型Col-0和kea1kea2双突变体材料,使用Plant RNA Extraction Kit(艾科瑞生物,中国)提取拟南芥幼苗总RNA。按照艾科瑞生物公司的Evo M-MLV 反转录试剂盒及其操作说明完成模板cDNA 的合成。根据基因的CDS 序列,利用NCBI 引物设计网页及软件Primer Pre⁃mier 5 设计荧光定量PCR 引物对(表1),以拟南芥ACTIN7为内参基因。使用艾科瑞生物公司SYBR Green Premix Pro Taq HS 预混型qPCR 试剂盒,在ABI QuantStudio 5 实时定量PCR 仪上设计反应程序进行反应,每个样品设3次生物学重复。PCR反应体系(20.0 μL):10.0 μL 2×SYBR Green Pro Taq HS Premix,cDNA 模板2.0 μL,10 μmol·L−1上下游引物各0.5 μL,RNase free ddH2O 7.0 μL。反应条件:95℃预变性30 s,95℃变性5 s,60℃退火30s,40个循环;温度提升至95℃获得熔解曲线,数据结果采用2−ΔΔCt法进行定量分析。

表1 试验中使用的引物Table 1 Primers sequence used in this study
1.7 数据统计分析
采用GraphPad Prism 8.0 和SPSS 26.0 进行数据处理和统计分析。根长及内源糖含量统计分析方法为t检验(Student’st-test);qRT-PCR 结果进行单因素方差分析(one-way ANOVA),采用图基(Tukey)检验法在α=0.05 水平上进行不同处理组之间的差异性检验。
2 结果与分析
2.1 KEA1和KEA2功能缺失对拟南芥根生长的影响
如图1A 所示,在不含蔗糖的MS 培养基中,kea1kea2功能缺失突变体的根长明显短于野生型Col-0。与野生型植株相比,kea1kea2突变体的主根长度在不添加蔗糖的MS 培养基中减少了65%(图1B),表明KEA1和KEA2参与了拟南芥幼苗根的生长。
2.2 KEA1和KEA2功能缺失对拟南芥根尖分生组织的影响
为了了解KEA1 和KEA2 功能缺失影响了拟南芥根尖细胞的大小还是数量,采用PI 染色的方法对生长10 d 的拟南芥Col-0 和kea1kea2突变体幼苗根部进行组织染色。结果如图2 所示,发现kea1kea2突变体的根尖分生组织区域与野生型Col-0 相比较短,说明kea1kea2突变体根尖分生组织可能受到了影响从而抑制了根的生长。
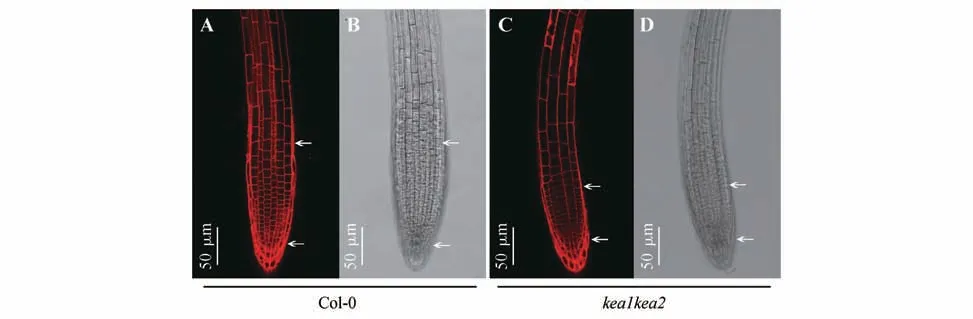
图2 kea1kea2突变体幼苗根尖细胞结构A,C.PI染色荧光图像;B,D.DIC图像;图中箭头标示根尖分生区Fig.2 The root tip cell structure of kea1kea2 mutant seedlings A,C.Fluorescence images of PI staining;B,D.DIC images;The arrows marked the apical meristematic zone
2.3 外源糖对kea1kea2突变体幼苗根生长的影响
为了研究不同种类的糖对Col-0 和kea1kea2突变体根生长的影响,用等浓度的蔗糖、葡萄糖、果糖、鼠李糖和海藻糖处理拟南芥幼苗。结果显示,与Col-0 相比,当MS 培养基中分别加入88 mmol·L−1的葡萄糖、果糖、鼠李糖和海藻糖时,kea1kea2突变体的根长分别减少20%、40%、43%和24%(图3B~F),而加入88 mmol·L−1(30 g·L−1)的蔗糖,两者根长间无显著性差异(图3A,F)。这个结果表明,30 g·L−1的外源蔗糖能够基本恢复由于KEA1 和KEA2 功能缺失引起的根长变短,而其他种类的糖只能使其在一定程度上恢复。暗示KEA1 和KEA2 功能缺失引起的根长变短,可能是由于影响了拟南芥幼苗体内的糖含量。

图3 在含有不同糖的培养基中生长的kea1kea2突变体幼苗的表型A~E.生长10 d的幼苗表型;F.幼苗根长度统计(ns.无显著性差异)Fig.3 Phenotype and root length of kea1kea2 mutant seedlings grown under different types of sugars A−E.Phenotypic picture showed seedlings growing for 10 d;F.Root length of seedlings from A to E,nonsignificant comparison(sP>0.05)marked in the figure as ns
2.4 拟南芥幼苗部分内源糖含量
如图4所示,与不添加蔗糖的MS培养基相比,在添加30 g·L-1蔗糖处理后,拟南芥幼苗中的蔗糖、葡萄糖、果糖和鼠李糖含量均显著增加,说明外源蔗糖促进了拟南芥蔗糖、葡萄糖、果糖和鼠李糖的积累。其中,在不添加蔗糖条件下,野生型Col-0中蔗糖和鼠李糖含量比突变体kea1kea2高(图4A,D);当添加30 g·L−1蔗糖处理后,野生型Col-0 和突变体kea1kea2中蔗糖、葡萄糖和果糖的含量均无显著性差异(图4A~C),鼠李糖有一定的变化(图4D)。这些结果进一步说明KEA1 和KEA2 可能通过影响拟南芥幼苗体内糖含量来调节根的生长。
2.5 转录组差异表达基因分析
为了进一步了解KEA1和KEA2功能缺失对拟南芥幼苗转录水平基因表达的影响,进行了转录组测序分析。箱线图结果显示(图5B),相同处理下3个重复样本基因表达分布一致性高,Col-0 和kea1kea2突变体在有无蔗糖条件下基因表达分布差异明显。韦恩图结果显示(图5A),有28个基因在4种比较组中均呈现差异表达,Col-0和kea1kea2突变体在蔗糖存在条件下(C+S_vs_k1k2+S),有63个差异表达基因不同于其他3个比较组;Col-0在有无蔗糖条件下(C_vs_C+S),有812个差异表达基因不同于其他3 个比较组;在无蔗糖条件下(C_vs_k1k2),Col-0和kea1kea2突变体有67个差异表达基因不同于其他3 个比较组;kea1kea2突变体在有无蔗糖条件下(k1k2_vs_k1k2+S),有1 970个差异表达基因不同于其他3个比较组。火山图进一步分析显示(图5C~F),在无蔗糖条件下(C_vs_k1k2),与Col-0相比,kea1kea2突变体中下调基因的数量多于上调基因的数量;在C_vs_C+S和k1k2_vs_k1k2+S组中,上调基因的数量多于下调基因的数量;在C+S_vs_k1k2+S中,下调基因的数量与上调基因的数量基本相等。以上结果表明,KEA1和KEA2功能缺失会影响拟南芥幼苗转录水平上许多基因表达下调,而蔗糖会在一定程度上弥补这种影响。
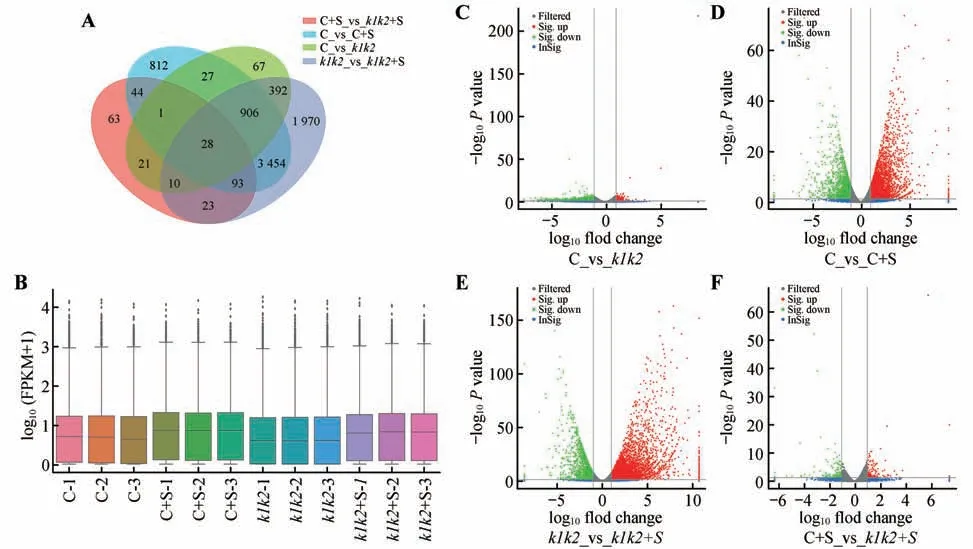
图5 转录组测序差异表达基因分析A.韦恩图;B.箱线图;C~F.火山图(绿色表示下调基因,红色表示上调基因);C.野生型Col-0;C+S.Col-0+蔗糖;k1k2. kea1kea2突变体;k1k2+S.kea1kea2+蔗糖Fig.5 Analysis of differentially expressed genes by transcriptome sequencing A.Venn Plot;B.Box-whisker Plot;C−F.Volcano Plo(tGreen indicated down-regulated genes,and red indicated up-regulated genes);C.Col-0;C+S.Col-0+Sucrose;k1k2. kea1kea2;k1k2+S.kea1kea2+Sucrose
2.6 外源蔗糖对拟南芥幼苗蔗糖信号通路相关基因表达的影响
对转录组测序结果筛选分析发现,在不添加蔗糖的情况下,与野生型Col-0相比,kea1kea2突变体中的蔗糖生物合成基因(SPS1、2、3、4和SPP1、2)、蔗糖代谢基因(SUS、CINV2、CWINV4等)和参与蔗糖转运基因(SUC2、SUC7、SWEET12等)的表达水平相对较低(图6A~C),表明KEA1 和KEA2的功能缺失可能会降低蔗糖的合成、代谢及转运过程。除此之外,与不添加蔗糖的情况相比,在加入30 g·L−1蔗糖后,Col-0和kea1kea2突变体的蔗糖生物合成基因(SPS1、2、3和SPP1)和蔗糖分解基因(SUS1-6和CINV2、CWINV4、CWINV5、SnRK1.1)以及一些蔗糖转运基因(SUC2、4、7和SWEET12、13、14、15)表达水平升高(图6A~C)。同时,本研究挑选了与蔗糖信号通路相关的部分基因进行了qRT-PCR 验证,蔗糖生物合成基因(SPS2、3、4)和蔗糖代谢基因(SUS4、5、6)的表达与转录组测序结果趋势一致(图6D~I)。基于以上结果,推测KEA1 和KEA2 可能间接参与调节与蔗糖相关的信号通路。
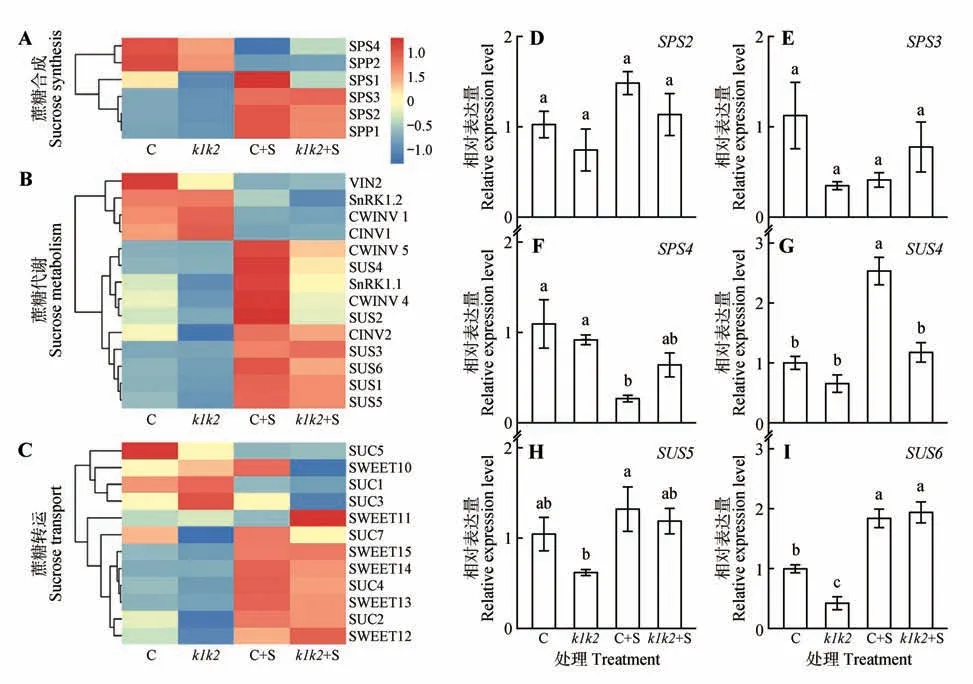
图6 蔗糖信号通路中相关基因表达的热图和qRT-PCR验证A~C.转录组测序蔗糖信号通路相关基因变化热图(颜色表示基因表达强度,红色表示高表达水平,蓝色表示低表达水平);D~I.qRT-PCR分析6个蔗糖信号通路相关基因的表达;不同小写字母表示差异显著(P<0.05)Fig.6 Heatmap and qRT-PCR test of related gene expression in sucrose signaling pathway A−C.Heatmap of the changes in genes related to sucrose signaling pathway determined through RNA-seq(The colors in the heatmap represented the intensity of the gene expression changes;Red meant high expression levels;Blue meant low expression levels);D−I.The expression of six sucrose signaling pathway related genes were analyzed through qRT-PCR;Different lowercase letters above the bars indicated significant difference(sP<0.05)
2.7 外源蔗糖对拟南芥幼苗根生长发育相关基因表达的影响
另一方面,通过对转录组测序结果分析,鉴定出与根生长发育相关的差异表达基因49 个,其中与根生长相关的有6 个,与根发育相关的有43 个。对这些差异表达基因做热图分析,结果如图7 所示,在无蔗糖的培养基中,与根生长发育相关的绝大多数基因的表达水平显著下调,而在添加30 g·L−1蔗糖处理以后,与根发育相关基因的表达普遍上调。这些结果表明,蔗糖可以明显影响拟南芥幼苗根生长的基因表达谱,并且KEA1 和KEA2 功能缺失会进一步引起与根生长相关基因的下调(图7)。

图7 根生长发育相关基因表达的热图Fig.7 Heatmap of related gene expression during root growth and development
2.8 KEA1和KEA2功能缺失使拟南芥幼苗活性氧积累增多
超氧阴离子(O·−2)是活性氧(ROS)的重要组成部分,ROS 的含量在一定的程度上能反映植物中氧化还原的稳态。NBT 染色可以用来检测植物体内O·−2的分布,笔者对是否有蔗糖处理的拟南芥叶片进行染色。如图8所示,突变体kea1kea2叶片上的NBT染色强度明显高于野生型Col-0,加30 g·L−1蔗糖处理后,野生型Col-0 和突变体kea1kea2叶片上的NBT染色强度减弱。这些结果表明,KEA1和KEA2功能缺失使活性氧积累增多,蔗糖可以适当缓解活性氧的积累。

图8 KEA1和KEA2功能缺失对叶片中O·−2 积累的影响Fig.8 Effect of KEA1 and KEA2 knock-down on O·−2 accumulation in leaves
3 讨论
此前的研究发现,拟南芥KEA1 和KEA2 蛋白定位于叶绿体的内膜[8]。在正常生长条件下,kea1kea2双功能缺失突变体的幼叶小并且呈淡绿色,光合作用的效率显著降低,生长发育迟缓[8-9,15]。本研究进一步发现,在无蔗糖的MS 培养基中,与野生型Col-0相比,kea1kea2双突变体的根长明显变短,说明KEA1 和KEA2 参与调节拟南芥幼苗根的伸长,Sánchez-McSweeney 等[16]在添加1%蔗糖的MS培养基中也观察到相似的表型。
在大多数高等植物中,蔗糖是光合作用的最终产物。蔗糖代谢通过产生糖信号分子(例如蔗糖本身、葡萄糖、果糖和海藻糖-6-磷酸),或通过代谢过程本身发挥的信号作用介导植物的生长发育。Kircher 等[17]研究表明,拟南芥幼苗将光合作用产生的糖运输到根尖是光调节根生长所必需的,说明蔗糖能促进植物生根发芽。因此,当光合作用受到破坏时,在没有蔗糖的培养基中,拟南芥的生长发育可能受到抑制。而KEA1 和KEA2 功能缺失会影响质体发育,导致叶绿体结构损伤,从而引起光合作用降低[8-9],进而影响根的生长。此外,有研究表明光合作用产物蔗糖作为细胞壁合成的能量源、碳源和细胞伸长的相容溶质,有助于根的形成[14]。在植物中,蔗糖合酶(SUS)分解蔗糖为果糖和UDP-葡萄糖,转化酶(INV)分解蔗糖为葡萄糖和果糖,这两类酶是催化蔗糖分解的关键酶[18]。已有研究发现,部分拟南芥细胞质转化酶(CINV)参与调节根的生长[19],并且一些蔗糖转运蛋白(SUC 和SWEET)也会影响根的生长[20-21]。本研究中,不添加蔗糖的培养基中,蔗糖、葡萄糖、果糖、鼠李糖含量均较低,同时,RNA-seq 结果显示降解蔗糖的细胞质转化酶基因CINV2,细胞壁转化酶基因CWINV4、5,以及蔗糖合酶基因SUS1-6表达水平均较低;而在添加30 g·L−1蔗糖后,蔗糖、葡萄糖、果糖含量增加,CINV2,CWINV4、5,以及SUS1-6表达水平也上调,这些结果表明葡萄糖和果糖含量的升高可能是由于分解蔗糖的酶表达量上升导致的结果。此外,无蔗糖条件下,与野生型Col-0 相比,kea1kea2双突变体中的SPS1、SPS2、SPS3、SPP1、SnRK1.1、SUC2、SUC4、SUC7、SWEET12等基因的表达水平相对较低,在添加30 g·L−1蔗糖后,它们的表达水平均升高。综上研究表明KEA1和KEA2可能间接影响蔗糖的合成与转运,而外源添加蔗糖可以缓解KEA1 和KEA2 对蔗糖代谢通路的影响。之前的研究表明,甜菜(Beta vulgaris)根系中SPS、SUS和INV活性与蔗糖含量呈正相关[22]。Chen 等[21]发现,干旱和脱落酸激活的SnRK2 蛋白激酶能够磷酸化SWEET11 和SWEET12 的羧基末端,这种磷酸化增强了SWEET 的蔗糖转运活性,从而提高根系中蔗糖含量,改善干旱胁迫下的根系生长,从而提高根冠比和抗旱性。此外,Last⁃drager等[23]同样发现,蔗糖能够调节TOR和SnRK1活性,从而调整了植物的生长和发育。这些结果暗示KEA1 和KEA2 可能通过影响糖信号通路介导拟南芥幼苗根的生长。
另一方面,Zhong 等[24]研究表明,缺钾可能导致细胞氧化应激,表明K+和活性氧代谢之间存在密切关系。KEA 是K+/H+反向转运蛋白,其功能缺失会影响细胞K+稳态和pH 平衡。本研究中,在无蔗糖条件下与野生型Col-0 相比,kea1kea2双突变体的叶片分布大量O·−2,在添加蔗糖之后,kea1kea2突变体的叶片中的O·−2含量相对变少。Sánchez-McSweeney 等[16]的研究也发现,与野生型相比,kea1kea2双突变体的根中O·−2显著减少,而叶片中O·−2明显增加,这与本研究结果一致。推测kea1kea2双突变体中可能由于影响钾离子稳态从而导致ROS 水平的变化,而本结果显示蔗糖可以部分缓解ROS的积累。
综上,本研究结果表明,外源蔗糖影响At⁃KEA1 和AtKEA2 参与调节拟南芥幼苗根的生长。然而,对于AtKEA1 和AtKEA2 在调控根生长中分子机制还需要进一步研究。

