外源水杨酸对盐胁迫下珙桐幼苗抗氧化系统和基因表达的影响
徐 磊 胥 晓 刘沁松
(西华师范大学生命科学学院,西南野生动植物资源保护教育部重点实验室,南充 637009)
土壤盐渍化是制约现代农林业生产的主要胁迫因子之一,盐渍土在我国分布广泛,且其面积仍在不断扩大[1]。高盐环境会对植物产生离子毒害和渗透胁迫,造成植物体内活性氧过度积累、光合效率下降、水分亏缺、蛋白质和细胞器受到损伤,导致植物生长受到抑制并加速衰老,严重影响了植物的生存[1-2]。因此,提高植物的耐盐性,有效利用盐渍荒地并发掘其巨大潜力具有重要意义。
珙桐(Davidia involucrata)是我国特有的第三纪孑遗珍稀树种,有植物界的“活化石”之称,属国家一级保护植物。此外,珙桐具有极高的观赏价值,在国际上享有“中国鸽子树”的美誉,可作为园林绿化珍贵树种[3-4]。目前关于珙桐的研究主要集中于群落学、繁殖技术、生物学特性等方面[5-7],在引种驯化方面的研究并不多。研究表明,珙桐不耐盐胁迫[8],因此土壤盐渍化制约了珙桐资源的有效保护及在园林绿化等领域中的广泛应用。
水杨酸(SA)是一种简单酚类物质,它作为植物激素信号分子在调控植物生长发育和胁迫抗性中起关键作用。近年来大量证据表明,外源SA 可缓解盐胁迫对植物造成的危害,其机制主要包括诱导逆境相关基因的表达、激活抗氧化防御系统、提高光合能力、调节离子吸收与分布及同其他激素或信号分子交互作用等[9-10]。在诱导逆境抗性方面,SA 具有高效、绿色环保和低成本等诸多优点,因此在农林业生产中具有广阔的应用前景。然而外源SA 对盐胁迫下珙桐抗逆生理及基因表达的影响目前尚未见报道。本研究以1 年生珙桐幼苗为材料,进行外源SA 和NaCl 胁迫处理,从叶片膜脂过氧化、抗氧化系统及转录组变化等角度,探讨SA 调控珙桐耐盐性的生理及分子机制,以期为珙桐作为园林绿化树种在城市盐渍化土壤中种植提供理论依据和技术支撑。
1 材料与方法
1.1 材料及处理
1年生珙桐幼苗种植于装有沙、蛭石和营养土(体积比1∶1∶1)的圆柱形塑料花盆中。前期珙桐幼苗盐胁迫预试验结果表明,150 mmol·L−1的NaCl溶液既可显著抑制珙桐幼苗生长,又不会造成幼苗死亡,故选取该浓度的NaCl 溶液用于盐胁迫处理。将2 mmol·L−1的SA 均匀喷施在珙桐叶片上、下表面,以相同剂量的蒸馏水作为对照。第1 次SA 处理结束2 d 后,开始浇施NaCl 溶液并同时进行SA喷施处理(当天为盐胁迫第1天),每2 d处理1 次。最终形成4 组试验处理:(1)CK,对照组(蒸馏水+无盐胁迫);(2)T1,SA 处理组(SA+无盐胁迫);(3)T2,NaCl 处理组(蒸馏水+盐胁迫);(4)T3,SA+NaCl 处理组(SA+盐胁迫),每组3 次重复。在盐胁迫第14 天,T2 组植株生长较差,T3 组植株生长得到缓解,T2 组与T3 组植株生长状态有明显差异,故在盐胁迫第14 天采样用于各项生理指标测定及转录组分析。
1.2 珙桐叶片生理生化指标的测定
通过打孔器打取10个叶圆片,放入试管中,加入10 mL去离子水,在室温条件下浸泡4 h,期间摇动3~5次,使用电导率仪(雷磁DDS-307A,上海)测定电导率L1。将试管在沸水浴中放置20 min,待冷却至室温后测定电导率L2。相对电导率按以下公式(L0为去离子水的电导率)进行计算:相对电导率=(L1−L0)/(L2−L0)×100%。珙桐叶片相对含水量的测定采用高俊凤的方法[11]。丙二醛(MDA)含量、超氧阴离子(O•−2)产生速率、H2O2含量、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、抗坏血酸过氧化物酶(APX)活性和谷胱甘肽(GSH)含量均采用试剂盒(苏州科铭生物技术有限公司)进行测定。
1.3 珙桐叶片的转录组测序
总RNA 的提取与检测参照Liu 等[4]的方法。由北京诺禾致源生物信息科技有限公司完成cD⁃NA 文库构建和Illumina 测序。对得到的原始测序数据(raw reads)进行质控,获得高质量有效测序数据(clean reads)。使用HiSat2软件将clean reads 比对到珙桐参考基因组上[12]。利用DESeq2 进行基因表达差异分析,将T3 组(SA+NaCl 处理组)与T2组(NaCl 处 理 组)进 行 比 较,以padj<0.05 且|log2FoldChange|>1 为阈值筛选差异表达基因(DEGs)。使用clusterProfiler 软件对获得的DEGs进行KEGG通路富集分析。
1.4 基因表达的qRT-PCR验证
以分别提取的T2 组(NaCl 处理组)和T3 组(SA+NaCl 处理组)叶片RNA 为模板,使用Prime⁃ScriptTMRT reagent Kit with gDNA Eraser 试剂盒(TaKaRa)合成cDNA。qRT-PCR 在实时荧光定量PCR 仪(Bio-Rad CFX96,USA)上进行,采用TB Green®Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒(TaKaRa)检测基因表达水平,所用引物见表1。以DiUBQ为内参基因。基因的相对表达量采用2−ΔΔCt方法计算。

表1 实时荧光定量PCR引物Table 1 Primer sequences for qRT-PCR
1.5 数据分析
图中数值为平均值±标准差。采用IBM SPSS Statistics 22 分别对各项指标进行单因素方差分析,检验盐胁迫和外源SA 处理对相对电导率、相对含水量、抗氧化酶(SOD、POD、APX)活性、GSH含量、MDA 含量和ROS(H2O2、O•−2)积累的影响。采用Duncan’s 多重比较检验不同处理间的差异(P<0.05)。
2 结果与分析
2.1 SA缓解珙桐幼苗盐胁迫的最适浓度
相对电导率是反映植物细胞膜透性的关键指标。如图1 所示,NaCl 处理导致珙桐幼苗叶片的相对电导率大幅上升,达到40.02%。不同浓度(0.5、1.0、2.0、3.0 mmol·L−1)SA 处理均显著抑制了相对电导率的升高(P<0.05),特别是SA 浓度为2.0 mmol·L−1时珙桐叶片在盐胁迫下的相对电导率最低,为33.95%。这些结果表明,喷施SA 能在盐胁迫下保护细胞膜的完整性,其中2.0 mmol·L−1SA 保护效果最佳,能诱导较高的耐盐性,因此在后续试验中使用该浓度。

图1 不同浓度的SA 对盐胁迫条件下珙桐叶片相对电导率的影响CK.喷施蒸馏水+无盐胁迫;N.喷施蒸馏水+盐胁迫;N0.5.喷施0.5 mmol·L−1 SA+盐胁迫;N1.喷施1.0 mmol·L−1 SA+盐胁迫;N2.喷施2.0 mmol·L−1 SA+盐胁迫;N3.喷施3.0 mmol·L−1 SA+盐胁迫;字母不同表示差异显著(P<0.05);下同Fig.1 Effects of SA at different concentrations on relative electrolyte leakage of D. involucrata leaves under salt stress.CK.Water with no salt;N.Water with salt;N0.5.0.5 mmol·L−1 SA with salt;N1.1.0 mmol·L−1 SA with salt;N2.2.0 mmol·L−1 SA with salt;N3.3.0 mmol·L−1 SA with salt;Different letters indicated significant difference(sP<0.05);the same as below
2.2 盐胁迫下SA 对珙桐幼苗叶片相对含水量和膜脂过氧化程度的影响
与对照(CK)相比,NaCl 处理(T2)导致珙桐幼苗叶片相对含水量减少29.00%。施用SA 提高了盐胁迫条件下珙桐幼苗叶片的相对含水量,SA+NaCl 处理(T3)下相对含水量较NaCl 处理(T2)增加17.17%(图2A)。

图2 SA 对盐胁迫条件下珙桐叶片相对含水量(A)、丙二醛质量摩尔浓度(B)、H2O2质量摩尔浓度(C)和O·−2产生速率(D)的影响Fig.2 Effects of SA on relative water content(A),MDA content(B),H2O2 content(C),and O·−2 production rate(D)of D. involucrata leaves under salt stress
MDA 是膜脂过氧化的主要产物,NaCl 处理(T2)导致珙桐幼苗叶片中MDA 含量较CK 大幅增加,是CK 的2.26 倍。SA+NaCl 处理(T3)下MDA含量比T2减少了46.56%(图2B)。喷施SA抑制了盐胁迫下活性氧(ROS)的积累,SA+NaCl 处理组(T3)中H2O2含量和超氧阴离子(O•−2)产生速率较NaCl处理组(T2)分别减少了16.67%和38.43%(图2C~D)。
2.3 盐胁迫下SA 对珙桐叶片抗氧化酶活性和抗氧化剂含量的影响
SOD、POD 和APX 是植物活性氧清除系统的重要酶类。与对照(CK)相比,SA 处理(T1)下珙桐叶片SOD 活性无显著变化,POD 和APX 活性则显著增加(图3A~C)。NaCl 处理组(T2)的SOD、POD和APX 活性比CK 分别升高了51.13%、126.88%和29.22%。SA+NaCl 处 理组(T3)中SOD、POD 和APX活性进一步升高,分别是T2的1.63倍、1.45倍和1.19倍。GSH是植物细胞重要的抗氧化剂,SA+NaCl 处理组(T3)中GSH 含量比NaCl 处理组(T2)增加了13.35%(图3D)。
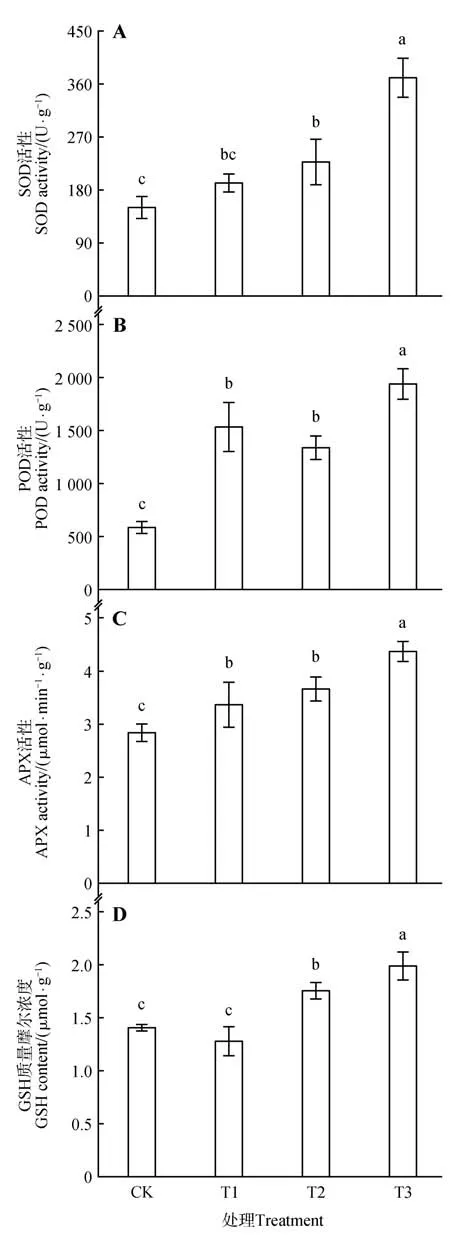
图3 SA对盐胁迫条件下珙桐叶片SOD活性(A)、POD活性(B)、APX活性(C)和GSH含量(D)的影响Fig.3 Effects of SA on SOD activity(A),POD activity(B),APX activity(C)and GSH content(D)of D.involucrata leaves under salt stress
2.4 SA诱导珙桐叶片响应盐胁迫的转录组变化
对NaCl 处理组(T2)和SA+NaCl 处理组(T3)进行转录组测序,获得了43 032 288~48 470 032的clean reads,GC 含量在43.91%~44.77%,Q30碱基比例均大于91%(表2),测序质量较高可用于基因表达分析。对转录组数据进一步分析,共筛选得到2 581 个DEGs(图4A)。与NaCl 处理组(T2)相比,SA+NaCl 处理组(T3)导致了珙桐叶片中1 516个基因上调表达,1 065 个基因下调表达(图4A)。已有研究表明,外源SA 可通过调控转录因子的表达来增强植物耐盐性[13]。因此利用qRT-PCR 对4个差异表达的转录因子DiWRKY40(Dinv11674)、DiNAC25(Dinv14675)、DiMYB4(Dinv27051)和Di⁃MYB86(Dinv38547)进行表达量检测。如图4B 所示,这4 个转录因子的表达特征与测序结果一致。

图4 差异表达基因数量和qRT-PCR验证Fig.4 Number of DEGs and verification by qRT-PCR

表2 转录组测序质量Table 2 Evaluation of transcriptome sequencing data
差异表达基因的KEGG 分析表明,苯丙烷类生物合成、氰基氨基酸代谢、二萜生物合成、α-亚麻酸代谢、苯丙氨酸代谢、油菜素甾醇生物合成、光合作用−天线蛋白、类黄酮生物合成、玉米素生物合成9 条代谢通路发生显著变化(表3)。其中,注释到苯丙烷类生物合成途径的DEGs 最多(43 个),包 括34 个 上 调DEGs 和9 个 下 调DEGs(表4)。
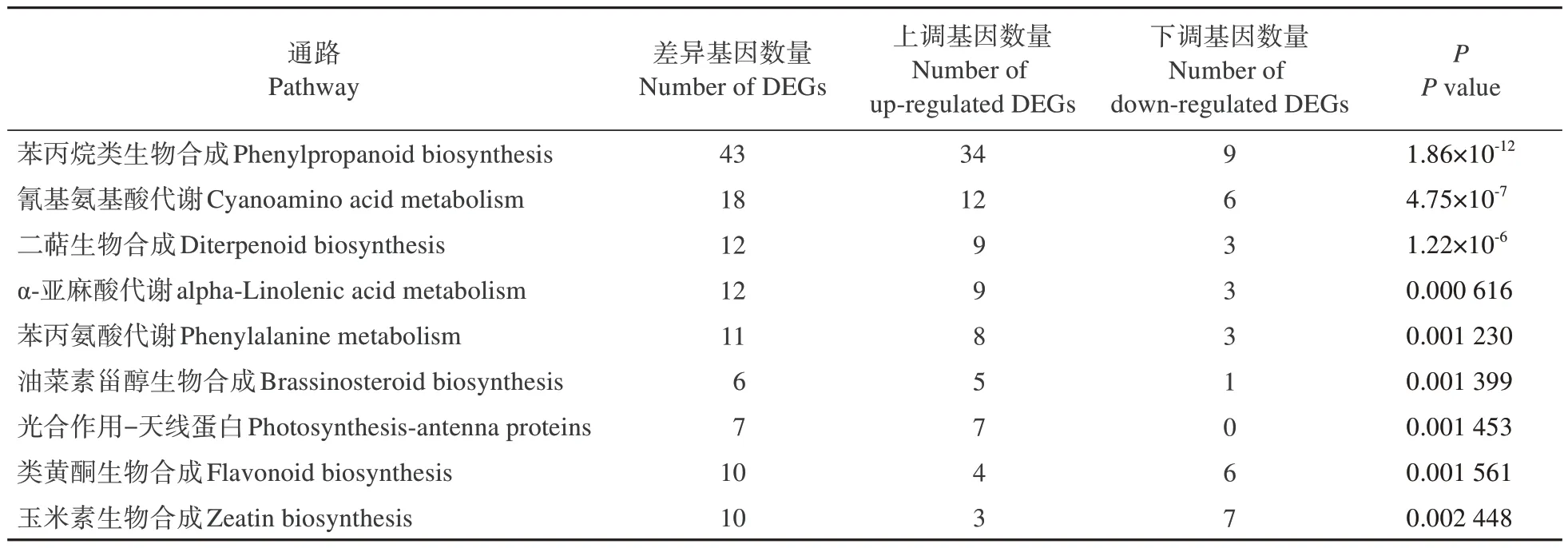
表3 差异表达基因的KEGG分析Table 3 KEGG analysis of DEGs
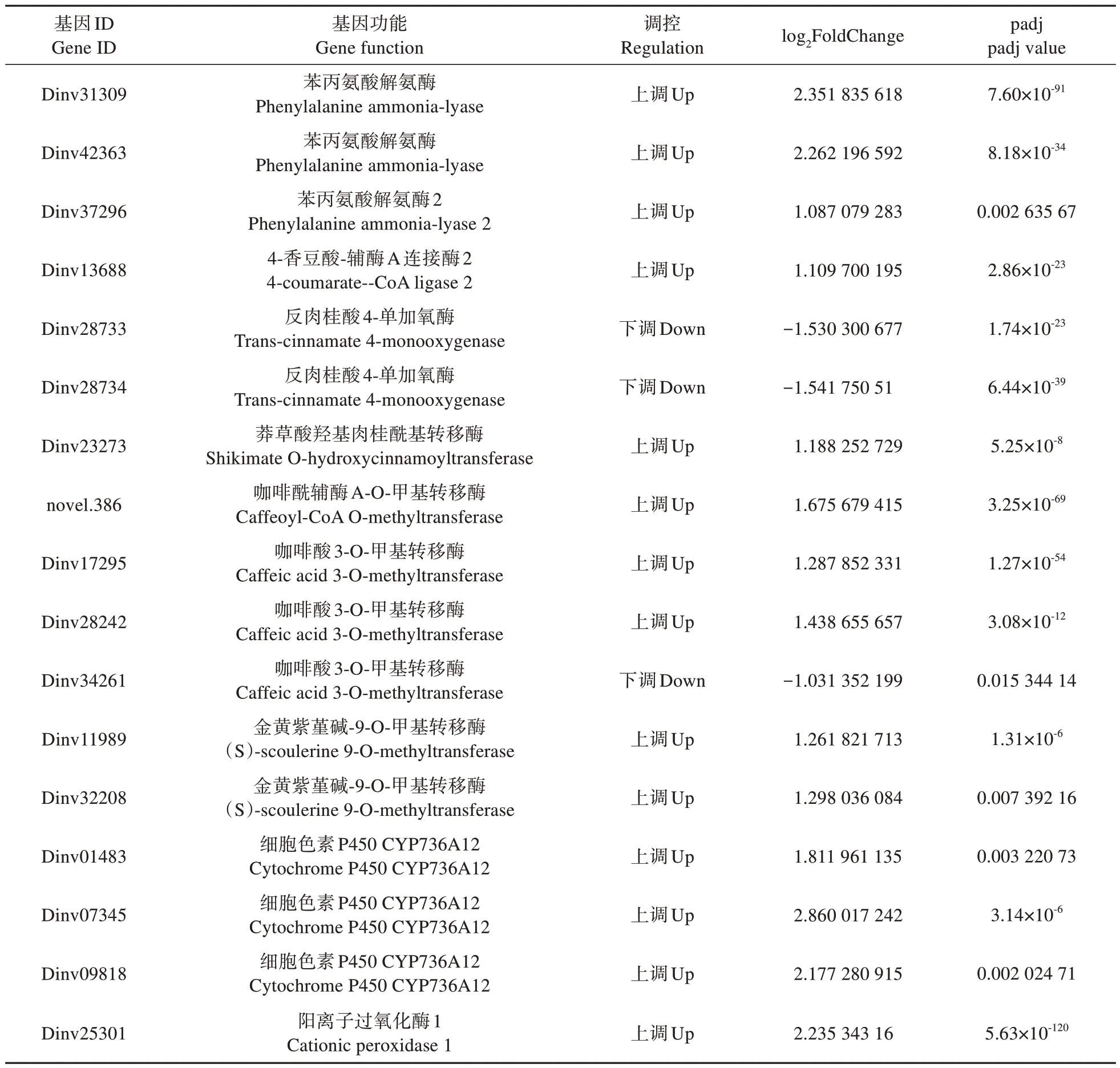
表4 注释到苯丙烷类生物合成途径的差异表达基因Table 4 DEGs annotated to phenylpropanoid biosynthetic pathways
此外,对上调和下调表达基因分别进行KEGG通路富集分析。上调基因显著富集于10条代谢通路,包括苯丙烷类生物合成、二萜生物合成、氰基氨基酸代谢、光合作用−天线蛋白、α-亚麻酸代谢、淀粉和蔗糖代谢、油菜素甾醇生物合成、苯丙氨酸代谢、角质、木栓质和蜡生物合成以及植物−病原互作(表5)。在本研究中,下调基因没有显著富集到KEGG通路。

表5 上调表达基因的KEGG分析Table 5 KEGG analysis of up-regulated DEGs
3 讨论
在植物体内,ROS 的产生和消除在正常条件下处于动态平衡状态;盐胁迫下,该平衡被打破,ROS 过量积累,引起膜脂过氧化作用,膜结构遭到破坏,导致膜内电解质外渗[14]。刘庆等[15]研究发现,NaCl 处理导致棉花(Gossypium hirsutum)幼苗叶片中O•−2产生速率和H2O2含量显著增加,外源施加SA 可有效抑制盐胁迫下ROS 的积累。与这一结果类似,本研究发现珙桐叶片中H2O2含量和O•−2产生速率在盐胁迫下大幅增加,施用SA 显著降低了盐胁迫下H2O2含量和O•−2产生速率。同时,外源SA 使盐胁迫下珙桐叶片相对电导率和MDA 含量显著降低,这一结果与付乃鑫等[16]对冬小麦(Triti⁃cum aestivum)幼苗的研究相符。这些结果表明,施用SA 能使ROS 处于相对较低的水平,并抑制膜脂过氧化,维系膜结构稳定性,进而缓解盐胁迫对珙桐幼苗的伤害。SOD 是植物抗氧化防御系统的第一道防线,可催化歧化反应使O•−2转化为H2O2和O2,而H2O2又可被POD 和APX 等酶分解为H2O 和O2[17]。除了抗氧化酶以外,植物还利用GSH 等抗氧化剂保护细胞免遭氧化损伤[14]。本试验中,盐胁迫导致SOD、POD 和APX 活性以及GSH 含量升高,推测盐胁迫下ROS 的积累诱导了这些抗氧化酶和抗氧化剂的合成。施用SA 进一步提高了盐胁迫下这3 种酶活性以及GSH 含量,使其协同作用清除ROS,从而缓解了高盐环境导致的氧化损伤。与本试验结果一致,赵宝泉等[18]研究发现喷施SA 提高了盐胁迫下杭白菊(Chrysanthemum morifolium)幼苗SOD、POD 和APX 活性,Li 等[19]研究表明在盐胁迫下外源SA 处理使小麦幼苗GSH含量增加。综上,外源SA 可通过提高珙桐幼苗抗氧化酶活性和GSH 含量,抑制MDA 和ROS 的积累,进而增强珙桐幼苗的耐盐性。
本研究进一步利用比较转录组分析了施用SA 对盐胁迫下珙桐幼苗叶片基因表达的影响,在转录水平上探讨了外源SA 的作用机制。结果表明,在盐胁迫条件下,大量珙桐基因的表达受到SA 的调控。植物转录因子在逆境信号传递中起关键调节作用,能调控一系列抗逆相关基因的表达,从而影响植物的逆境生理[20]。在本研究中,转录组测序和qRT-PCR 分析表明,外源SA 显著提高了盐胁迫下DiWRKY40、DiNAC25、DiMYB4和Di⁃MYB86等转录因子的表达。这些转录因子的同源基因已,报道可正向调控植物耐盐性:过表达金桔(Fortunella crassifolia)FcWRKY40增强了转基因烟草(Nicotiana nudicaulis)和柠檬(Citrus lemon)的耐盐性,而沉默FcWRKY40导致金桔植株对盐胁迫更敏感[21];过表达山定子(Malus baccata)MbNAC25的拟南芥(Arabidopsis thaliana)表现为更强的耐盐性[22];过表达苹果(Malus domestica)MdMYB4可提高苹果愈伤组织的耐盐性[23];过表达TaMYB86B的转基因小麦的耐盐性得到提高[24]。因此,外源SA 可能通过调控这些珙桐转录因子的表达来缓解盐胁迫。
苯丙烷代谢是植物主要的次生代谢途径之一,在植物生长发育以及抵御各种胁迫时发挥重要作用[25]。在本研究中,外源SA 激活了盐胁迫下珙桐苯丙烷类生物合成途径。与这一结果类似,施用褪黑素提高了珙桐幼苗的耐旱性,同时苯丙烷类生物合成被激活[4]。苯丙氨酸解氨酶(PAL)是苯丙烷类代谢的关键酶,在植物木质化过程和抗逆境胁迫等方面至关重要[25]。在本研究中,3个PAL基因表达量均升高。其余与木质素合成相关的基因大部分都上调表达,如4CL(4-coumarate-CoA ligase 2)、HCT(Shikimate O-hydroxycinnamoyl⁃transferase)、CCoAOMT(Caffeoyl-CoA O-methyltrans⁃ferase)、COMT(Caffeic acid 3-O-methyltransferase)和POD(Peroxidase)。已有研究表明,木质化是植物抵御盐胁迫的重要机制[26-27],因此外源SA 可能通过上调木质素合成基因的表达来促进木质素合成,从而增强珙桐幼苗的耐盐性。此外,在苯丙烷类生物合成途径中,检测到15 个BGlu(Beta-gluco⁃sidase)基因差异表达,并且大部分BGlu基因都上调表达。BGlu基因被证明能通过积累具有抗氧化活性的黄酮醇类化合物进而正向调控植物对高盐、UV-B、脱水等多个胁迫的耐受性[28],因此推测BGlu基因可能在SA 介导的耐盐性中发挥关键作用。
4 结论
施用2.0 mmol·L−1的SA 可显著降低盐胁迫下珙桐幼苗叶片的相对电导率,提高相对含水量,减小膜脂过氧化程度,抑制ROS积累,提高抗氧化酶SOD、POD、APX 活性和抗氧化剂GSH 含量;通过转录组测序,发现喷施SA 导致盐胁迫下2 581 个珙桐基因表达发生变化,其中1 516 个上调表达,1 065 个下调表达;在盐胁迫下,外源SA 能激活苯丙烷类生物合成途径,并诱导转录因子基因DiWRKY40、DiNAC25、DiMYB4和DiMYB86的表达。

