华蟾素调控HIF-1α/VEGF通路逆转结肠癌HCT15/5-FU细胞耐药的体外研究
赵秦英,吴 悦,桂仲璇,张 泉 ,叶映泉,王高翔,张 梅
结直肠癌(colorectal cancer, CRC)是世界常见恶性肿瘤之一,病死率仅次于肺癌[1-2]。5-氟尿嘧啶(5-Fluorouracil,5-FU)是结直肠癌的基石药物,但是超过50%的结直肠癌患者对5-FU产生耐药,阻断化疗进程从而导致不良预后[3]。近期研究[4]表明,上皮间充质转化(epithelial-mesenchymal transition,EMT)和血管生成诱导细胞产生耐药表型,而缺氧诱导因子(hypoxia-inducible factor-lα,HIF-1α)/血管内皮生长因子(vascular endothelial growth factor,VEGF)信号通路是EMT和血管生成进程中的主要诱导因素,目前关于HIF-1α/VEGF信号通路逆转结肠癌5-FU耐药的相关研究较少。华蟾素(cinobufagin,CINO)是中华大蟾蜍皮中提取的干燥分泌物,其抗炎、抗病毒、调节免疫应答、抗肿瘤等功效已得到有效证实[5],研究[6]结果显示,CINO能通过阻断EMT过程抑制结肠癌移植瘤小鼠的侵袭转移过程,并且通过HIF-1α/VEGF信号通路有效抑制肿瘤血管生成[7]。该研究旨在探讨 CINO对结肠癌5-FU耐药细胞的体内抑制作用及其机制,以期为中西医结合治疗结肠癌提供新的理论依据。
1 材料与方法
1.1 实验材料人结肠癌细胞株HCT15(货号:icell-h072)、人结肠癌细胞株HCT15/5-FU 耐药细胞株(货号:icell-h073)及HCT15/5-FU 人结肠癌细胞专用培养基(货号:icell-h073-001b)购自上海赛百慷生物有限公司;5-FU(货号:HY-90006)购自美国MCE 公司;华蟾素注射液购自安徽华润金蟾药业股份有限公司;MTT检测试剂盒(货号:CT0002)购自山东思科捷生物技术有限公司;ABW 基质胶(货号:0827045)购自上海诺娃医药科技有限公司;Annexin V-FITC / PI 双染细胞凋亡检测试剂盒(货号:BB-4101)购自美国BD公司;E-cadherin(货号:20874-1-AP)、N-cadherin(货号:22018-1-AP)购自美国Proteintech 公司;HIF-1α(货号:AF1009)、Snail(货号:AF6032)购自美国Affinity 公司;Vimentin(货号:R22775)、VEGF(货号:R26073)购自成都正能生物技术责任有限公司;LAUDR AQUAline AL 12型水浴锅购自德国LAUDR公司;PowerPacTMBasic Power Supply 1645050 型电泳仪购自美国BIO-RAD公司; SpectraMax iD3 型酶标仪购自美国MOLECULAR公司;CytomicsTMFC 500 型流式细胞仪购自美国 BECKMAN OULTER公司。
1.2 方法
1.2.1细胞培养 将HCT15、HCT15/5-FU细胞分别培养于完全培养基内,HCT15/5-FU细胞先是通过在完全培养基中逐渐提高5-FU的浓度(10~20 mg/L)筛选出具有抗药性的细胞,然后在含有5-FU(20 mg/L)的培养液中稳定培养以维持细胞耐药性。
1.2.2细胞活力分析 取对数生长期的HCT15或HCT15/5-FU接种到96孔板中(1×104个/孔)。细胞生长24 h后,加入5-FU(0.0、0.5、1.0、2.0、4.0、8.0、16.0、32.0 mg/L)或5-FU (12 mg/L)+CINO(0.0、0.4、0.8、1.6、3.2、6.4、12.8、25.6、51.2 mg/ml)后继续培养48 h,吸去上清液,每孔加入90 μl 新鲜培养液、10 μl MTT溶液,继续培养4 h,吸除上清液,每孔加入110 μl Formazan 溶解液,避光慢摇10~15 min 后,于酶标仪490 nm 处读取吸光度(optical density,OD)值,实验重复3 次,绘制细胞生长折线图并计算半数抑制浓度(median inhibitory concetration,IC50)值和耐药指数(resistance index,RI),抑制率=[ (OD实验组- OD空白组) /(OD对照组-OD空白组)]×100%,RI=HCT15/5-FU 细胞的IC50/HCT15细胞的IC50,逆转倍数=使用 CINO前的IC50/使用CINO 后的IC50。
1.2.3流式细胞术实验 将对数生长期HCT15/5-FU耐药细胞株(1×105个/孔)接种于6 孔板中,培养24 h后,吸弃培养液,将5-FU (12 mg/L)+CINO(0、1、2、4 mg/ml)细胞培养液作用于细胞48 h后收集各组细胞,冷PBS洗2遍后用Annexin V结合液重悬细胞至适宜浓度,再加入Annexin V-FITC 染色液避光孵育15 min 后,加PI 染料避光孵育5 min 后在流式细胞仪中检测并分析细胞凋亡率。每组设3 个复孔,重复3 次。
1.2.4划痕实验 将对数生长期的HCT15/5-FU耐药细胞株(1×105个/孔)接种于6 孔板中,培养24 h后用 p200 枪头沿直尺竖直划线,去除原培养液,将5-FU (12 mg/L)+CINO(0、1、2、4 mg/ml) 细胞培养液作用于细胞48 h 后收集各组细胞,在0 、48 h 的时间点分别拍照。每组设3 个复孔,重复3 次。
1.2.5Transwell小室迁移与侵袭实验 将200 μl 的HCT15/5-FU 细胞悬液(1×105个/ml)接种于小室的上室(侵袭实验的小室提前用60 μl 稀释的基质胶包被)。下室加入600 μl 含5-FU (12 mg/L)+CINO(0、1、2、4 mg/ml)的细胞培养液,作用细胞48 h 后,取出上室,4%多聚甲醛固定20 min,结晶紫染色10 min,每个小室随机选取5 个区域拍照、计数并分析数据。
1.2.6Western blot实验 用5-FU (12 mg/L)+CINO(0、1、2、4 mg/ml)培养48 h 后收集细胞,提取蛋白后,经电泳、转膜,10%脱脂牛奶摇床敷育2 h 后, 4 ℃ 敷育一抗过夜。次日,TBST 洗膜3 次,二抗室温孵育1 h 后,TBST 3 次,使用ECL 发光液显影。采用Image J 软件对蛋白条带进行分析,测得条带的灰度值,以各组目的蛋白与内参(GAPDH)蛋白灰度值的比值来反映目的蛋白的相对表达水平,比较各组间的差异。每组实验重复3 次。

2 结果
2.1 HCT15/5-FU细胞耐药性的鉴定及CINO对 HCT15/5-FU 细胞耐药性的影响如图1A所示,5-FU (0.0、0.5、1.0、2.0、4.0、8.0、16.0、32.0 mg/L) 作用于细胞48 h,HCT15 的IC50为(1.476±0.265 7)mg/L,HCT15/5-FU的 IC50为(12.87±0.636 4)mg/L,耐药指数RI约为8.720 倍。在5-FU各浓度作用下,HCT15/5-FU 细胞的抑制率明显低于HCT15 细胞 (F=9.692,P<0.05),说明HCT15/5-FU细胞对5-FU产生耐药性。

图1 5-FU或CINO对HCT15和HCT15/5-FU细胞生长抑制作用
如图1B显示,CINO(0.0、0.4、0.8、1.6、3.2、6.4、12.8、25.6、51.2 mg/ml)作用HCT15/5-FU细胞12、24、48、72 h,对应的IC50分别为(27.08 ±2.609)、(9.943±0.295 2) 、(3.989±0.640 6)、(6.903±0.758 7)mg/L,计算逆转倍数分别为0.475、1.294、3.226、1.857,提示CINO在48 h时,对HCT15/5-FU细胞的耐药逆转效果最好,因此,在后续实验中以48 h作用时间为标准。
2.2 CINO对HCT15/5-FU细胞凋亡能力的影响如图2结果所示,与对照组(5-FU 12 mg/L 单独作用)(3.33±0.577)%相比,5-FU (12 mg/L)+CINO(1、2、4 mg/ml)作用48 h,HCT15/5-FU细胞凋亡率分别为(8.33±0.577)%、(13.33±1.528)%、(19.00±1.000)%,提示CINO具有诱导HCT15/5-FU细胞凋亡的能力,差异有统计学意义(F=135.3,P<0.05)。
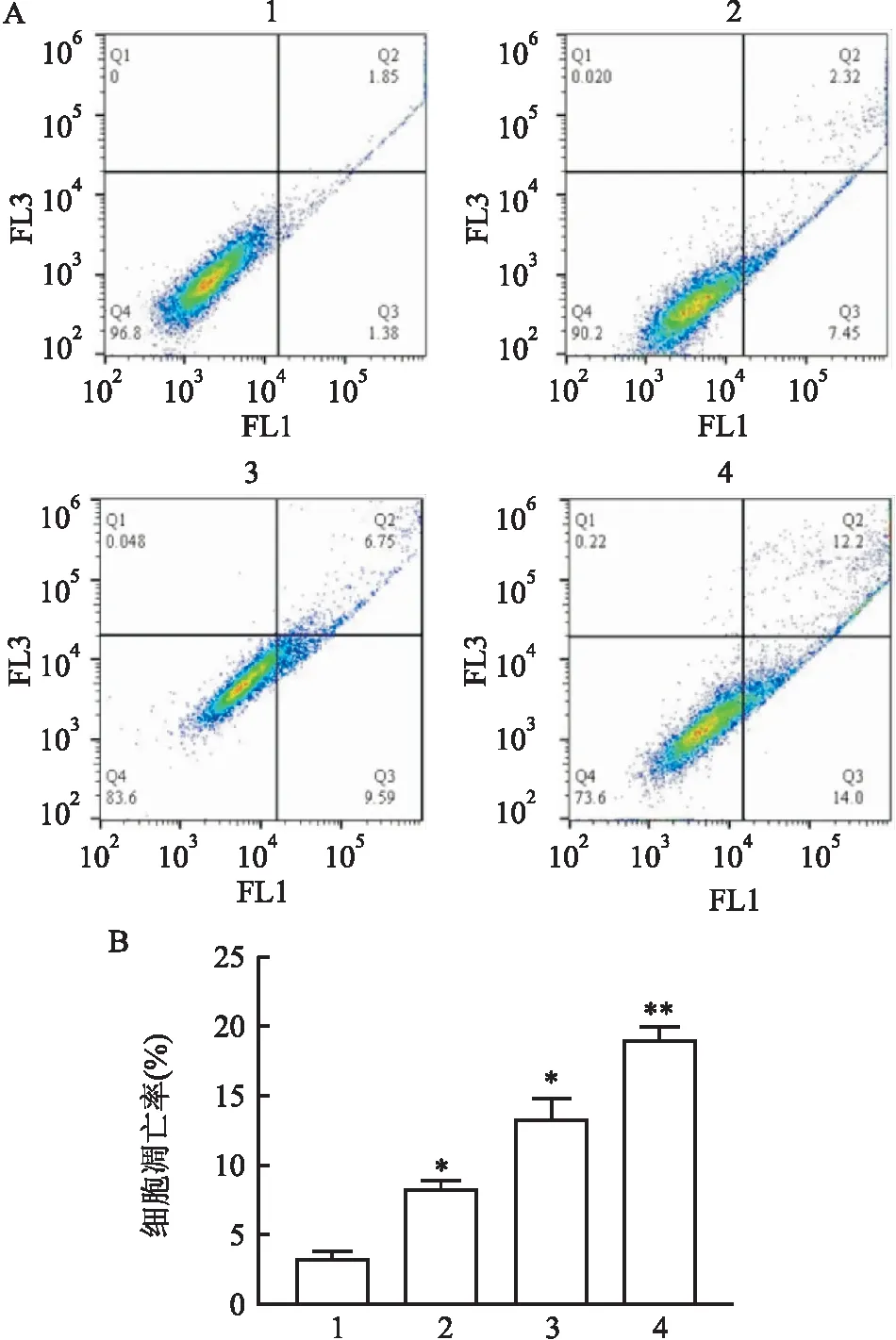
图2 CINO对HCT15/5-FU细胞凋亡率的影响
2.3 CINO对HCT15/5-FU细胞迁移和侵袭能力的影响划痕实验显示(图3A、C),与对照组(5-FU 12 mg/L 单独作用)相比,5-FU (12 mg/L)+CINO(1、2、4 mg/ml)作用48 h后,CINO显著降低细胞划痕愈合率(F=68.63,P<0.01),呈现浓度依赖性; Transwell迁移实验显示(图3B、D),与对照组(5-FU 12 mg/L 单独作用)相比,5-FU (12 mg/L)+CINO(1、2、4 mg/ml)作用48 h后,迁移细胞数目呈现浓度依赖性的减少(F=276.1,P<0.01); Transwell 侵袭实验表明(图3B、D),与对照组(5-FU 12 mg/L 单独作用)相比,5-FU (12 mg/L)+CINO(1、2、4 mg/ml)作用48 h后,侵袭细胞数目呈现浓度依赖性地减少(F=182.9,P<0.01)。
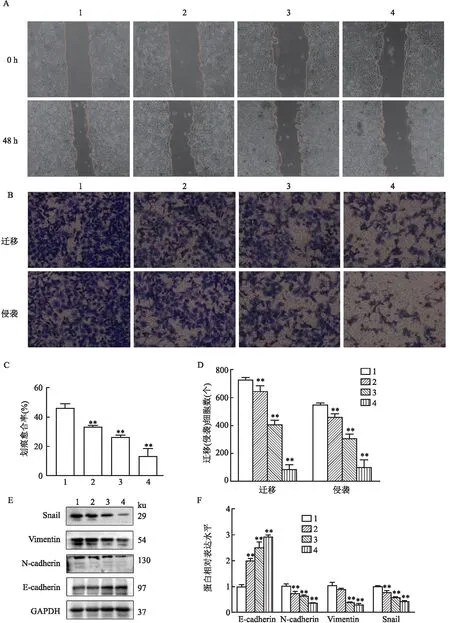
图3 CINO对HCT15/5-FU细胞侵袭、迁移能力的影响
EMT与结肠癌5-FU耐药机制具有密切关系,为了检测HCT15/5-FU细胞中EMT相关蛋白的表达,该实验通过Western blot实验对E-cadherin、N-cadherin、Vimentin和Snail进行检测。结果显示(图3E、F),CINO 明显地上调 E-cadherin 蛋白表达(F=94.31,P<0.01), 并具有浓度依赖性。对 N-cadherin 、Vimentin 、Snail 蛋白表达具有不同程度的抑制作用,与对照组(5-FU 12 mg/L 单独作用)相比,N-cadherin 、Snail 在CINO 各浓度组均显著降低(FN-cadherin=68.57,P<0.01;FSnail=131.9,P<0.01); 在CINO≥2 mg/ml 时, Vimentin 蛋白表达明显下降(F=92.45,P<0.01)。
2.4 CINO对HCT15/5-FU细胞HIF-1α/VEGF信号通路的影响HIF-1α/VEGF信号通路在结肠癌5-FU耐药机制中发挥重要作用,并与EMT、血管生成密切相关。因此,该研究对HCT15/5-FU中HIF-1α、VEGF蛋白的表达水平进行检测,如图4结果所示,在CINO≥2 mg/ml时,对结直肠癌5-FU耐药的潜在生物标志物HIF-1α蛋白表达具有抑制作用,差异有统计学意义(F=84.33,P<0.01);VEGF在CINO各浓度组均显著降低,并且差异有统计学意义(F=176,P<0.01)。说明HIF-1α/VEGF信号通路在CINO逆转结肠癌5-FU耐药中发挥功效,并呈现被抑制状态。
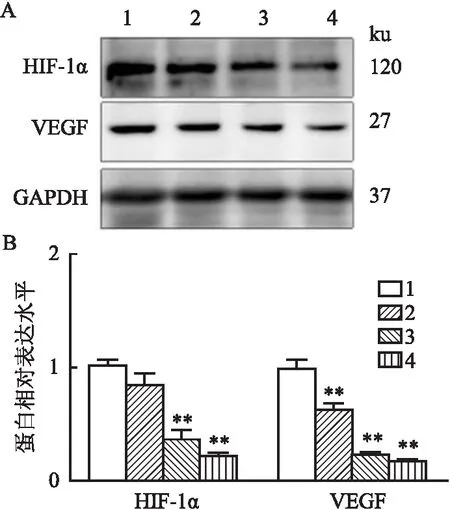
图4 Western blot检测CINO对EMT、HIF-1α/VEGF相关蛋白的影响
3 讨论
5-FU的应用提高了结直肠癌患者的生存率,但其耐药性是阻碍治疗进程的主要因素之一[8]。因此,研究结直肠癌5-FU耐药机制,对寻找克服5-FU耐药的治疗策略至关重要。血管生成在化疗耐药机制中占有重要地位[9],VEGF作为最有效的促血管生成因子,在5-FU耐药细胞的机制中主要受HIF-1α的调控,HIF-1α在低氧状态下与VEGF基因中的缺氧反应元件结合,诱导VEGF蛋白的转录和翻译,激活多药耐药蛋白(multidrug resistance protein, MDR)和乳腺癌耐药蛋白(breast cancer resistance protein, BCRP)的表达,刺激肿瘤EMT、血管生成以及化疗耐药的发生[10]。抗血管生成药物应时而生,其中的代表药物贝伐珠单抗具有结合VEGF所有结合位点、从源头上阻断血管生成的功能[11],是目前结直肠癌的一线治疗药物。虽然目前抗血管生成治疗显著改善了转移性结肠癌患者的预后,但抗血管生成治疗期间出现的不良反应限制了其治疗效果。因此,寻找毒副作用小的抗血管生成药物仍然是需要努力的目标。
中医药具有低毒有效等特点,CINO作为中华大蟾蜍皮的干燥提取物,其抗癌作用已在肝癌、胃癌、结肠癌等多种恶性肿瘤中取得有效进展[12]。研究[13]表明,通过下调糖蛋白(P-glycoprotein,P-gp)的表达,CINO能够逆转肿瘤MDR的状态;胡叶 等[14]显示,CINO具有抑制血管生成的功效,其机制与阻断VEGF和VEGFR-2的结合相关;Yang et al[15]通过网络药理学方法预测CINO具有抑制HIF-1α/VEGF信号通路的潜力。目前CINO通过调控HIF-1α/VEGF信号通路逆转结肠癌5-FU耐药的研究处于空白状态。课题组以HCT15/5-FU耐药细胞为研究对象、CINO为干预条件,研究CINO对HCT15/5-FU耐药细胞的影响及其具体机制。MTT实验结果表明CINO对5-FU治疗具有增敏作用。Western blot实验表明CINO是通过抑制结直肠癌5-FU耐药的潜在生物标志物HIF-1α蛋白的表达而发挥5-FU增敏作用,提示CINO有望成为临床治疗中的化疗增敏剂。流式细胞凋亡实验显示CINO与5-FU的联合使用显著促进耐药细胞凋亡,表现为细胞总凋亡率的增加。划痕实验、Transwell实验结果显示,CINO显著抑制耐药细胞迁移、侵袭能力,这一结果在Western blot中被验证,表现为上调EMT上皮细胞标志物E-cadherin蛋白水平,抑制间质标志物N-cadherin、细胞支架标志物Vimentin以及相关转录因子Snail蛋白的表达。Western blot评价了CINO联合5-FU对血管生成的影响,结果显示与5-FU单独使用相比,CINO与5-FU的联合使用显著抑制VEGF的表达,并且抑制效果呈显著的剂量依赖性,进一步验证了CINO通过下调HIF-1α/VEGF信号通路发挥逆转结肠癌5-FU耐药功效。
综上所述,体外研究显示CINO具有逆转结肠癌5-FU耐药的功效,其机制与HIF-1α/VEGF信号通路有关。但该研究尚且存在一定的不足之处,例如:未开展相应的动物体内实验、体外实验细胞株种类单一、对HIF-1α/VEGF信号通路的上游靶点未进行深入探索等,课题组将针对这些问题继续开展后续工作,进一步完善丰富CINO逆转结肠癌5-FU耐药的相关研究。

