小檗碱激活SIRT1/AMPK信号通路改善高糖诱导的系膜细胞异常增殖和自噬功能
杨 琳,王蓉蓉,郭小雨,唐丽琴,2,魏 伟
糖尿病肾病(diabetic nephropathy, DN)是糖尿病常见的慢性并发症之一,由于肾小球及血管病变而导致的蛋白尿排泄增多以及肾功能异常[1],病因复杂,病情反复。DN在病理上主要表现为肾小球结构肥大、细胞外基质积聚、足细胞损伤和系膜细胞(mesangial cells, MCs)异常增殖等[2]。沉默信息调节因子1(silencing regulatory factor 1,SIRT1)/腺苷酸活化蛋白激酶(adenylate activated protein kinase,AMPK)信号通路存在相互调控的关系,SIRT1是一种依赖性脱乙酰酶,可以使AMPK蛋白脱乙酰化,参与炎性反应的调节,减缓DN发生及发展[3]。已有研究[4]表明,DN的发病机制可能与系膜细胞自噬水平失调有关。小檗碱(berberine,BBR)是一种季铵类生物碱,见于许多植物中,药理作用主要有抗炎抗肿瘤、促进胰岛素分泌和保护肾脏[5]的作用等。课题组前期研究[6]表明,BBR可以通过多种途径改善DN。该课题研究了BBR能够改善高糖诱导的MCs的异常增殖、降低ECM沉积并提高自噬水平等保护作用,其机制可能与调节SIRT1/AMPK信号通路有关,以期为探寻DN治疗靶点提供新思路。
1 材料与方法
1.1 细胞肾小球系膜细胞(CL-0470)购自武汉普诺赛生命科技有限公司。
1.2 药物BBR(BWC9020-2016):分子量371.81,购自北京北方伟业计量技术研究院,通过HPLC法测定纯度≥98%。
1.3 试剂DMEM培养基购自美国Hyclone公司(货号:SH30021.01);AMPK抑制剂购自美国默克公司(CC,货号:171260);细胞爬片、一抗稀释液、胰酶购自美国Biosharp公司;胎牛血清购自加拿大Wisent公司;兔抗 Col-IV 抗体、鼠抗Sirt1抗体购自英国Abcam公司(货号:ab6586、ab110304);兔抗LC3B抗体、兔抗AMPK抗体、兔抗 p-AMPK 抗体、兔抗p65 抗体、兔抗p-p65抗体购自美国Cell Signaling Technology公司(货号:3868S、5831、2535T、8242S、3033);兔抗Beclin1抗体、兔抗p62抗体、羊抗兔荧光二抗、羊抗小鼠荧光二抗(货号:R1509-1、HA721171、HA1121、HA1125)购自杭州华安生物技术有限公司;鼠抗 FN抗体购自武汉Proteintech公司(货号:66042-1-Ig)。
1.4 仪器化学发光成像系统(型号:ImageQuant,美国GE公司);酶标仪(型号:Infinite M1000 PRO,瑞士TECAN公司);高内涵细胞成像(型号:Image Xpress Micro 4,美国Molecular Devcies 公司);正置荧光显微镜(型号:DM2500,德国莱卡公司)。
1.5 方法
1.5.1细胞培养 冻存细胞用37 ℃水浴并混匀1~2 min至完全融化,离心去上清液,加入含有10%血清、1%双抗的低糖培养液,反复吹打后放置于在37 ℃含5% CO2和95%湿空气中孵育。
1.5.2细胞增殖 将消化下来的细胞接种在96孔板中(1 000个/孔),细胞贴壁后随机分为5组,即正常组(Control组,葡萄糖浓度 11.1 mmol/L)、模型组(HG组,葡萄糖浓度 30 mmol/L)和不同浓度 BBR 给药组(30、60、90 μmol/L)。24 h后吸出废液,预冷的4%多聚甲醛固定30 min, 5% BSA封闭30 min,用锡纸包住96孔板,接着加入DAPI 20 μl染核5 min,最后用高内涵成像仪拍摄细胞,计算各组系膜细胞数量并分析。
1.5.3免疫荧光法检测ECM沉积蛋白的表达 24孔板内加入无菌盖玻片,再以1×104个/孔密度的细胞悬液加入到孔板中,分别加刺激和给药。24 h后洗去上层死细胞,依次加入预冷的4%多聚甲醛固定30 min,0.1% Triton X-100通透细胞5 min,5% BSA封闭30 min,加入比例为1 ∶100的抗体,次日用锡纸包住24孔板,随后加入相对应的荧光二抗(1 ∶100)37 ℃ 暗处孵育 2 h,DAPI染液100 μl染核10 min;最后滴加荧光淬灭剂,于488 nm 激发光观察并拍照。
1.5.4Western blot检测相关蛋白表达 将消化下来的细胞接种在6孔板中(1×108个/孔),分别加刺激和给药同1.5.2项,培养24 h后吸去废液,预冷RIPA加PMSF后,放于冰上1 h使之完全裂解,将裂解后的细胞转移至EP管并离心,定量后将蛋白进行SDS-PAGE 电泳,再分别孵育蛋白对应抗体,过夜后加入二抗(1 ∶1 000)摇床孵育2 h,最后洗膜并用显影仪上检测后保存结果。

2 结果
2.1 BBR对MCs增殖的影响高内涵实验结果显示,与对照组(Control组)(2 032.88±34.80)比较,高糖组(HG组)(7 126.33±24.29)MCs增殖能力增加(F=303,P<0.01);与高糖组比较,BBR治疗组(30、60、90 μmol/L)能明显抑制MCs异常增殖 (5 652.39±36.86,4 402.34±31.40,2 317.05±11.19)。见图1。
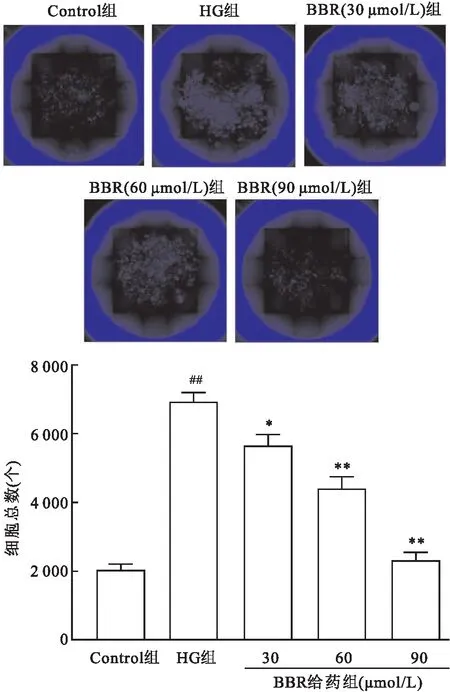
图1 BBR对MCs增殖的影响 ×200
2.2 BBR对ECM沉积蛋白表达的影响免疫荧光结果显示(图2A),与对照组比较(1.661±0.305,1.674±0.151),高糖组(5.232±0.765,3.904±0.693)MCs中FN和Col-IV的荧光强度增加(F=188.4、55.88,P<0.01);与高糖组比较,BBR 治疗组(2.001±0.235,1.872±0.09)MCs中FN和Col-IV的荧光强度降低。Western blot结果显示(图2B),与对照组比较,高糖组MCs中FN和Col-IV蛋白表达量增加(F=16.63、2.63,P<0.01);与高糖组比较,BBR治疗组(90 μmol/L)MCs中FN和Col-IV的蛋白表达量降低。
2.3 BBR对MCs上SIRT1、p-AMPK、p-p65蛋白表达的影响Western blot结果显示,与对照组比较,高糖组MCs上SIRT1、p-AMPK蛋白表达量下降(F=24.73、26.50,P<0.01),p-p65蛋白表达量上升(F=7.448,P<0.01);与高糖组比较,BBR治疗组(30、60、90 μmol/L)MCs上SIRT1、p-AMPK蛋白的表达量上升,p-p65蛋白表达量下降。见图3。
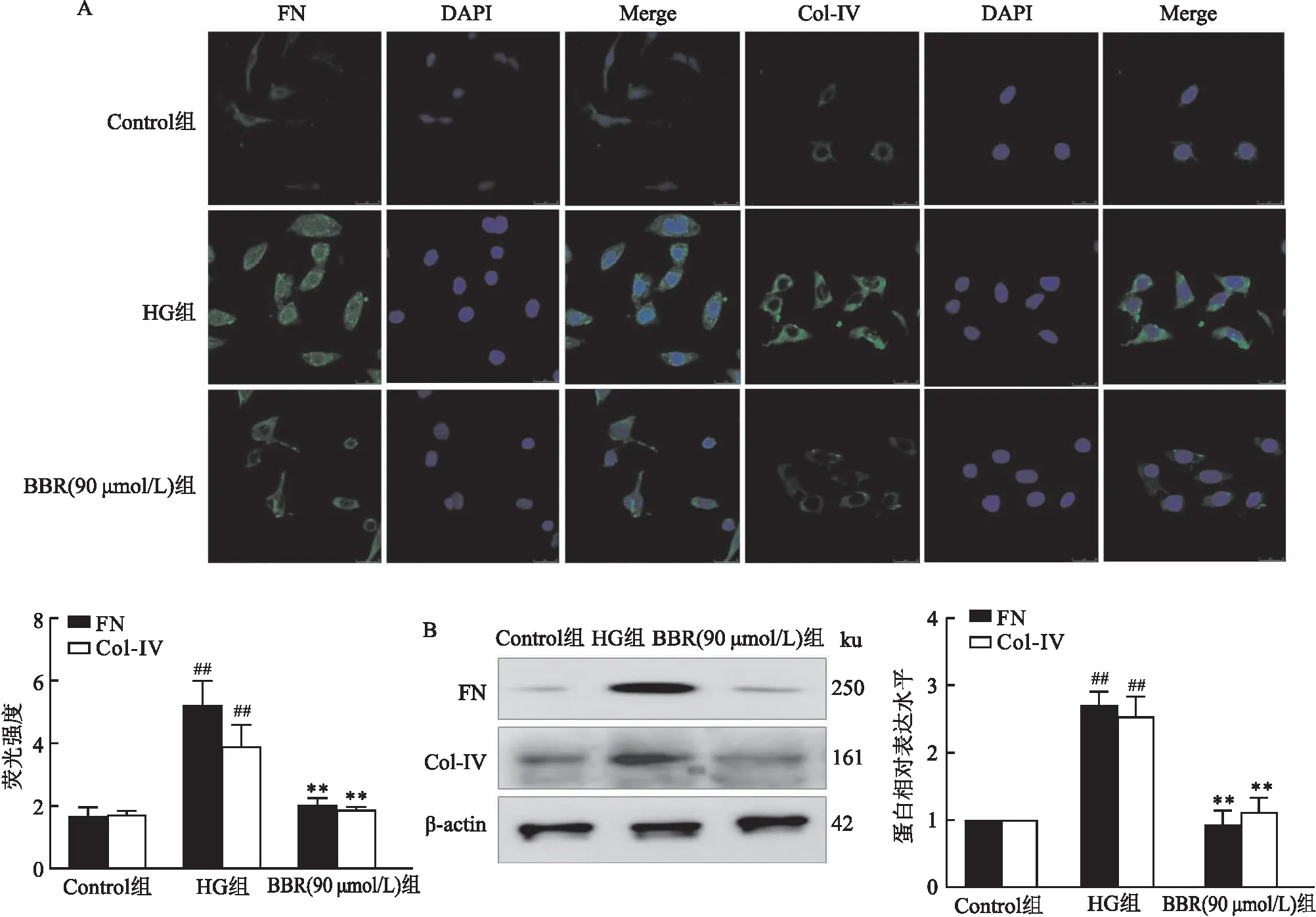
图 2 BBR对ECM沉积蛋白表达的影响
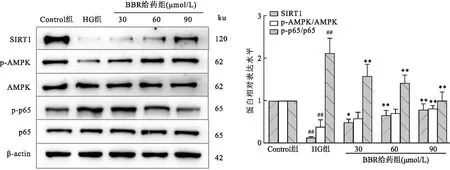
图3 BBR对SIRT1、p-AMPK、p-p65蛋白表达的影响
2.4 BBR对MCs上LC3B、Beclin-1、p62蛋白表达的影响Western blot结果显示,与对照组比较,高糖组MCs上LC3B、Beclin-1蛋白表达量下降(F=9.572、3.194,P<0.01), p62蛋白表达上升(F=3.154,P<0.01);与高糖组比较,BBR 治疗组(30、60、90 μmol/L)MCs上LC3B、Beclin-1蛋白表达量上升,p62蛋白表达量下降。见图4。
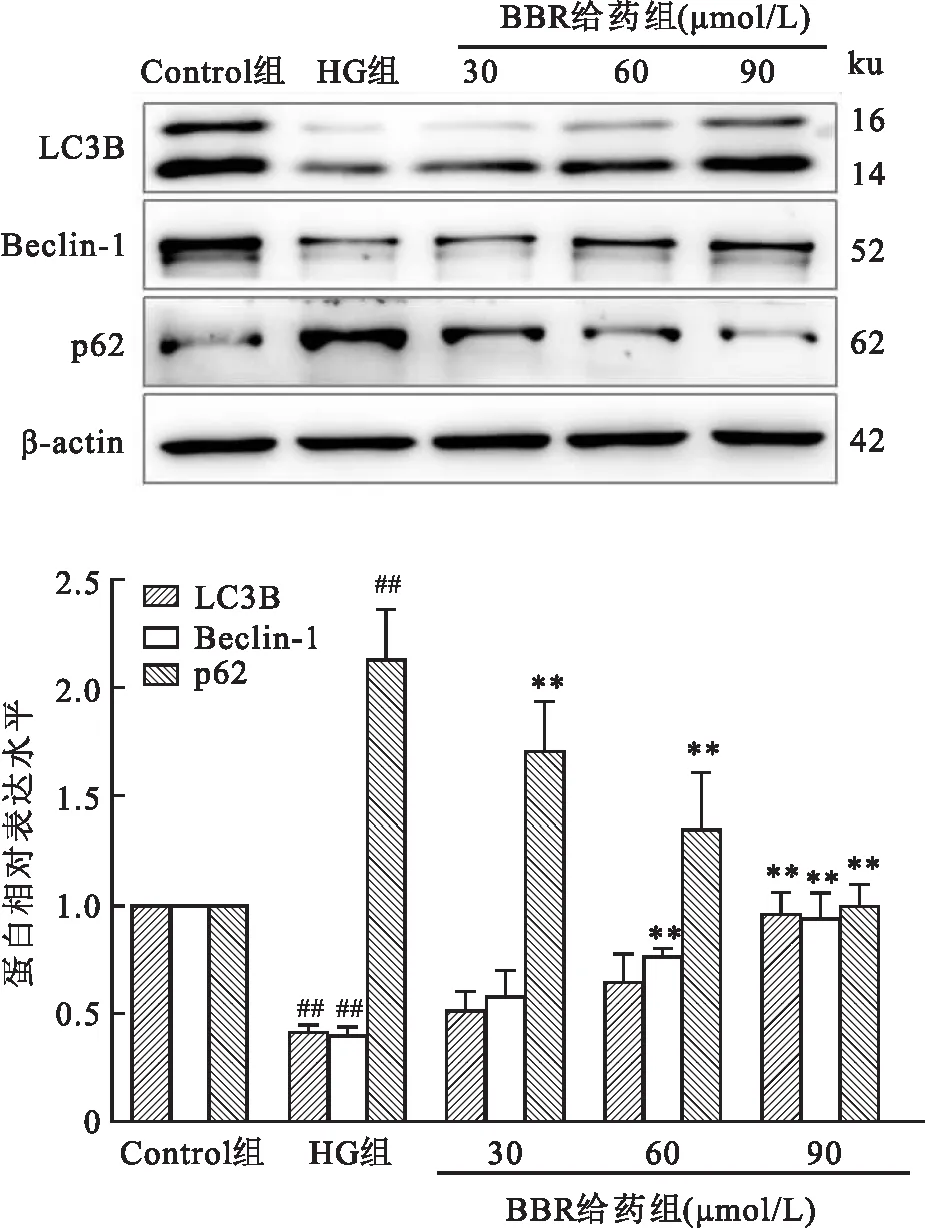
图4 BBR对LC3B、Beclin-1、p62蛋白表达的影响
2.5 BBR联合CC后对MCs增殖和自噬的影响Western blot结果显示(图5A),高糖组MCs上SIRT1、p-AMPK蛋白表达量下降(F=14.46、65.72,P<0.01);与高糖组比较,BBR治疗组(90 μmol/L)MCs上SIRT1、p-AMPK蛋白的表达量上升,与BBR治疗组(90 μmol/L)比较,BBR(90 μmol/L)+CC组MCs上SIRT1、p-AMPK蛋白的表达量下降。高内涵(图5B)和免疫荧光(图5C)结果显示,BBR治疗组(90 μmol/L)能抑制高糖诱导的系膜细胞增殖,促进系膜细胞自噬(0.922±0.055),而加入AMPK抑制剂后(0.613±0.068),这种作用被部分抵消。
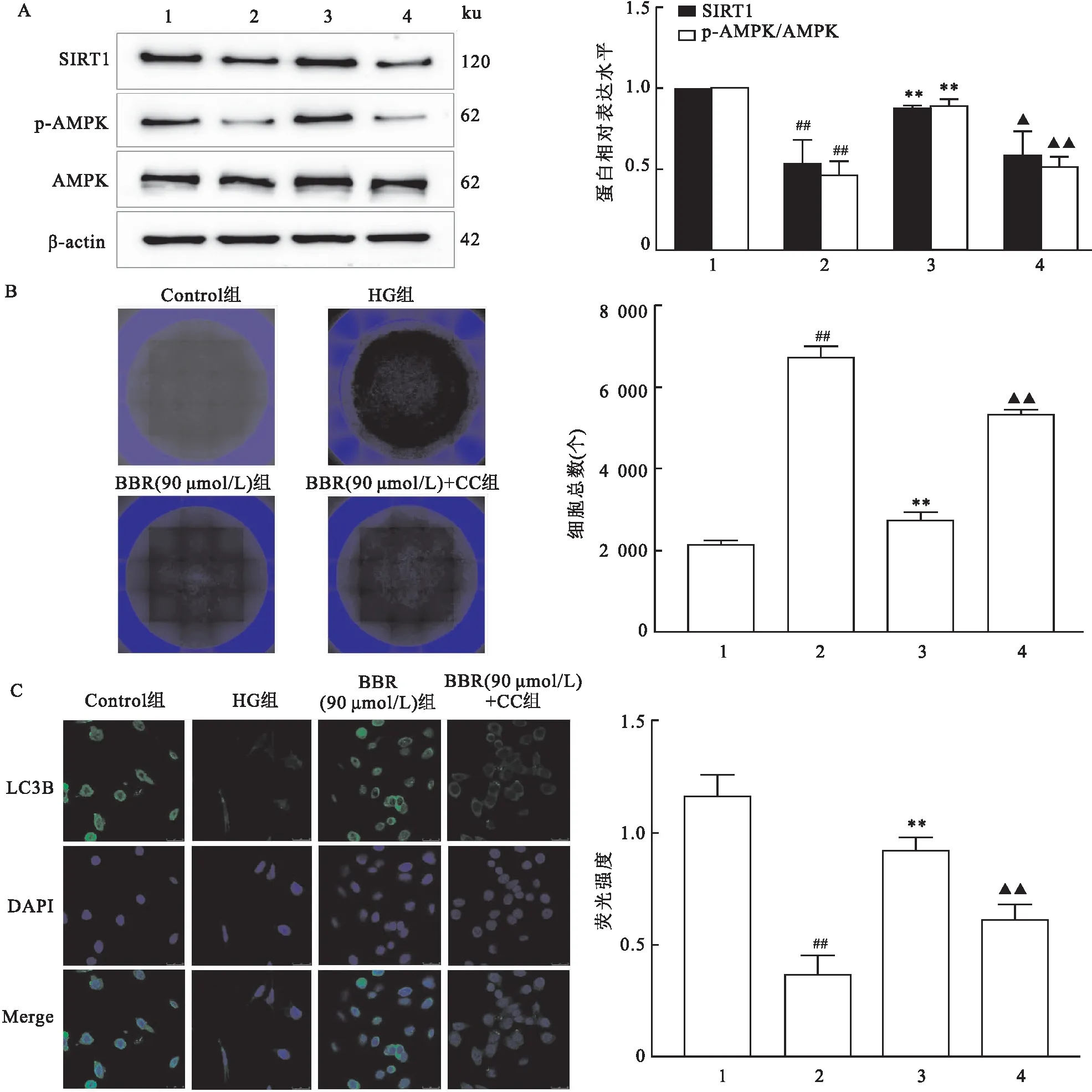
图5 BBR联合CC后对MCs增殖和自噬的影响
3 讨论
数据显示,中国糖尿病患者约1.409亿,占全球第一,30%~40%的糖尿病患者有进展为DN的高风险[7]。DN的发生受多种因素调控,如遗传因素、多元醇积聚、肾脏纤维化、炎性反应机制等[8]。肾小球系膜区包括MCs和系膜基质,MCs内有较强的收缩系统,刺激细胞内可收缩的纤维丝收缩,从而调节毛细血管表面积[9]。MCs的异常增殖及大量ECM的产生是导致肾小球纤维化主要始动因素,MCs增殖会导致邻近的毛细血管血流循环障碍,血管压力增大,滤过率下降,而细胞外基质沉积进一步压迫毛细血管,加重了肾损伤,已有研究[6,10]表明,高糖能促进细胞的增殖和细胞外基质沉积。近年来,自噬是肾脏疾病的研究热点,参与了多种肾脏疾病的过程。高糖刺激MCs会导致细胞内受损蛋白和细胞器堆积,自噬体能把受损物质包裹起来并与溶酶体融合,细胞内蛋白和细胞器被溶酶体消化代谢,自噬体减少,加重了肾纤维化[11]。本次研究结果显示,使用30 mmol/L葡萄糖刺激MCs 24 h后,检测显示MCs细胞数增多,细胞增殖明显,细胞外基质FN和Col-IV的表达水平升高,MCs上LC3B、Beclin-1自噬蛋白水平降低,p62蛋白水平升高。
SIRT1与AMPK存在相互调节的关系,SIRT1属于sirtuins蛋白质家族,它是与机体能量代谢密切相关的蛋白。AMPK是一个复杂的异源三聚体,是由α,β和γ亚基及其各自的结构域组成,α亚基包含关键的残基THr 172,它可以被上游激酶磷酸化,有研究[12]显示,小檗碱可以通过激活AMPK磷酸化位点THr172改善衰老有关疾病。SIRT1可以激活AMPK上游分子LKB1,使AMPK磷酸化,AMPK同样可以使细胞内NAD+增多反过来激活SIRT1,而SIRT1可与p65蛋白的亚基相互作用,使p65去乙酰化,p65蛋白表达降低,减少肾损伤的发生。此外,AMPK的激活可以调节代谢水平,减少ATP消耗,增加ATP的产生。研究[13]表明,人参皂苷Rb2通过激活 Sirt1和AMPK恢复自噬来缓解肝脂堆积。BBR可促进AMPK激活,增强自噬作用,抑制高糖诱导的足细胞损伤[14]。在DN模型中,CC作为AMPK抑制剂,可以阻断AMPK通路后导致MCs异常增殖和ECM沉积。以上研究表明通过激活SIRT1/AMPK信号通路,加强了自噬作用,改善了细胞异常增殖,发挥保护肾脏的作用。
BBR是生活中治疗胃肠道疾病的常用药物,其药理作用十分广泛,研究表明,BBR在抗氧化、抗菌、神经保护、糖尿病以及心血管疾病等同样具有比较好的生物效应[15]。该实验通过检测 SIRT1/AMPK信号通路的相关蛋白表明,HG 刺激MCs后,MCs发生异常增殖和细胞外基质沉积、细胞自噬水平降低及细胞SIRT1/AMPK信号通路失活,BBR 给药后MCs发生异常增殖和细胞外基质堆积现象随之减轻,细胞自噬水平增加并激活了SIRT1/AMPK信号通路,而BBR联合AMPK抑制剂CC后,细胞内SIRT1/AMPK通路蛋白减少,MCs发生异常增殖并抑制了自噬的形成。

