外生菌根真菌彩色豆马勃与麻栎幼苗共生对其抗旱性的影响
陈建妙,刘楚瑜,陈 城,吴 楚
(长江大学 园艺园林学院,湖北 荆州 434025)
干旱是一个全球性的问题,已经成为制约全球粮食生产和农业发展的最重要因素[1]。干旱胁迫影响着植物的生长发育,从而引起一系列的形态、生理生化反应。在植物外部形态上干旱胁迫具有最直观的影响,包括株高、地径、叶面积等[2]。水分的缺乏抑制光合色素的合成,影响气孔导度,限制CO2供应,进一步抑制光合作用以及净光合速率和蒸腾速率,最终造成生物量合成的降低。叶绿素荧光参数反映植物光系统对光能的吸收、传递、耗散等,也是反映干旱胁迫对光合作用影响的重要指标[3]。其次,干旱胁迫下植物细胞内的水分外渗导致原生质体收缩,严重时甚至会发生质壁分离,造成植物细胞死亡。植物通过渗透调节降低渗透势,提高细胞吸水或保水能力来适应胁迫环境。渗透调节物质主要包括无机离子和有机溶剂[4]。其中,可溶性蛋白、可溶性糖和脯氨酸等有机物质能有效地维持细胞膨压,保持膜的稳定性和细胞含水量,是重要的抗逆性生理指标[5]。再者,在干旱胁迫下植物体内会产生大量活性氧(ROS),如超氧阴离子、过氧化氢和羟基自由基等。ROS 的过度积累会引发氧化胁迫,植物通过抗氧化酶[6]和抗氧剂共同组成的抗氧化系统来清除ROS 毒害。其中抗氧化酶包括过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)等,抗氧化剂包括抗坏血酸(AsA)和谷胱甘肽(GSH)。该系统保护细胞免受氧化胁迫,从而缓解干旱胁迫带来的伤害[7]。同样,过氧化氢(H2O2)作为ROS 的一种,有着毒害和信号分子的双重作用,能反映植物受干旱胁迫的程度[8]。另外,超氧阴离子和羟基自由基这类氧自由基在植物体内的过量累积会与细胞膜中的蛋白质和酶发生膜脂过氧化反应并产生丙二醛(MDA)[9]。而MDA 含量的增加会对细胞膜造成严重损害[10],细胞膜系统破坏后导致细胞膜通透性增加,细胞液外渗,使植物的相对电导率提高。所以通过MDA 和相对电导率能反映植物细胞膜脂过氧化程度和膜系统的受损程度[11]。
外生真菌与植物建立共生关系,能增加根系的吸收面积,促进寄主植物的养分获取,改善水分状况,促进植物的生长发育,提高植物的抗旱性和适应力[12]。外生菌根真菌彩色豆马勃Pisolithus tinctorius具有分布广泛、寄生宿主广、能与多种林木形成菌根、且能在干旱等恶劣的环境中对寄主植物有益等优点,被广泛用于与森林乔木的共生[13]。栎属Quercus约有300 种,分布于世界各地,是组成阔叶林的重要树种,也是彩色豆马勃的主要宿主植物之一。其中麻栎Quercus acutissima是壳斗科Fagaceae 的落叶乔木,大部分在我国温带与亚热带地区分布[14],其根系发达,适应性强,多用于荒山瘠地造林的先锋造林树种和保持水土,而这些地方多为干旱地区。因此,研究外生菌根真菌彩色豆马勃与麻栎幼苗共生对其抗旱性的影响,以增强林木树种培育以及提高抗旱性,对干旱地区植被恢复以及水土保持具有重要意义。本试验以麻栎幼苗为研究对象,接种彩色豆马勃共生形成外生菌根,并施加一定程度的干旱胁迫,观察不同处理麻栎幼苗的生长状况以及对干旱胁迫的适应情况,为森林植物的抗旱性研究提供一定的理论依据,为菌根真菌在农林生产中的推广应用寻找新的途径。
1 材料与方法
1.1 试验材料
供试菌种彩色豆马勃Pisolithus tinctorius(Marx 270)由北纳生物公司购买(www.bnbio.com)。麻栎Quercus acutissima种子采集于恩施土家族苗族自治州建始县青里坝村。
1.2 麻栎播种
本试验在长江大学园艺园林学院农科大楼进行。2020年4月进行播种,选取颗粒饱满大小一致的麻栎种子,75%乙醇消毒5 min,蒸馏水清洗3 次,4%次氯酸钠消毒20 min。麻栎种子消毒后,进行沙藏催芽处理。播种于蓝色塑料筐(规格:55 cm×40 cm×30 cm)中播种,基质为细沙,厚度7 ~8 cm,种子横卧于细沙上,种子间隔3 cm,表面覆细沙2 cm,催芽期间喷洒蒸馏水保持细沙湿润。种子胚根突破种皮时,移栽至1 加仑塑料花盆,每盆一株,基质为园艺育苗基质,每盆基质为0.9 kg。光培养∶暗培养为15 h∶9 h,25 ℃恒温生长室培养。试验用盆提前用乙醇进行消毒,基质预先用高压蒸汽灭菌锅(博迅YXQLS-50A)121 ℃灭菌70 min。
1.3 彩色豆马勃菌液的制备
彩色豆马勃用KJA 固体培养基(50 ml/L KAGOMA 蔬菜汁+0.5 g/L CaCO3+15 g/L 琼脂粉,pH 值6.5)进行活化,25 ℃暗培养。从活化后的菌落边缘切取1 cm×1 cm 菌块,接种到装有100 mL KJA 液体培养基(50 mL/L KAGOMA 蔬菜汁+0.5 g/L CaCO3,pH 值6.5)的150 mL 三角瓶中,每瓶1 块,25 ℃,180 r/min 振荡培养。10 d 左右,待菌丝长满基质后进行接种。
1.4 试验设计
在麻栎种子长至4 片真叶时,挑选生长一致的植株,进行4 个处理。1)对照组(CK):正常水分管控;2)干旱组(D):干旱胁迫处理;3)接种彩色豆马勃组(Pt):接种彩色豆马勃的同时进行正常水分管控;4)接种彩色豆马勃+干旱组(Pt+D):接种彩色豆马勃同时干旱胁迫处理。每个处理组30 盆,共120 盆。其中Pt 和Pt+D 组进行每盆10 mL 的灌根接种,对照组采用等量灭活菌液,接种时间为2021年5月。干旱处理在2021年6月统一浇足水后,停止浇水,根据土壤墒情测定仪(型号JL-19,德国Heraeus)监控基质中水分含量的情况并进行浇水,浇水量控制在正常浇水量(对照)的20%左右。处理60 d后收集叶片,用液氮处理后置于-80 ℃超低温冰箱,用于后续各项生理指标测定。
1.5 指标测定
1.5.1 根系镜检与菌根定殖率的测定
2021年6月干旱处理前,采用台盼蓝染色法[15]对分别随机选取两个接种处理的5 株麻栎幼苗根系进行菌根镜检。使用显微镜(Nikon ECLIPSE Ci,日本尼康)进行镜检拍照。菌根定殖率根据Biermann 的方法进行计算[16]。将根段侵染程度分为0%、10%、20%、30%,…,100%,按照以下公式计算菌根定殖率:
菌根定殖率=Σ(0%×根段数+10%×根段数+20%×根段数+…+100%×根段数)/总根段数。
1.5.2 生理指标的测定
干旱处理45 d 后,采用便携式叶绿素荧光仪(Junior-PAM,德国Walz)测定叶绿素荧光相关指标。测定时,PAR 设置为190 μmol/(m2s)。每个处理随机选取5 盆,选取每株幼苗中部3 片完全展开的健康叶片,测前麻栎幼苗暗处理15 min。气体交换参数的测定选择天气晴朗的上午9:00—11:00 进行,将麻栎幼苗在阳光下直射15 min 后进行测量。每个处理植株叶片的选取方式同叶绿素荧光。采用便携式光合仪(Li-6400,美国Li-Cor)进行,使用Li-6400-02 B 红蓝光光源分别测定净光合速率(Photo)、气孔导度(Cond)、胞间CO2浓度(Ci)、蒸腾速率(Trmmol)及水汽压亏缺(VpdL)。
处理60 d 后,每个处理随机选取15 株,用卷尺和游标卡尺测量株高和地径。每个处理随机选取10 株对幼苗的第4 片真叶编号后进行形态指标测定,用游标卡尺测量叶片厚度,用彩色图像扫描仪(Epson V700)对不同处理的叶片扫描,之后70 ℃干燥箱烘干3 h,称取叶片质量,获得参数为叶片厚度、单片叶面积、单片叶干质量、特定叶面积和叶片组织密度。
光合色素含量的测定采用乙醇法[17];SOD 活性采用氮蓝四唑法测定[18];POD 活性采用愈创木酚法测定[19]。CAT 和GR 活性分别使用Solarbio 的活性检测试剂盒测定。APX 活性采用Subramanyam等[20]的方法测定。AsA 含量采用2,6-二氯酚靛酚滴定法测定[21];GSH 含量采用二硫代硝基苯甲酸法测定[22];H2O2含量采用碘化钾比色法测定[23];MDA 采用硫代巴比妥酸法测定[24];相对电导率使用浸泡法测量[25]。Pro 含量采用茚三酮显色法测定[26];可溶性糖含量采用蒽酮比色法测定[27];可溶性蛋白含量采用考马斯亮蓝G-250 法测定[28]。
1.6 数据处理
采用Excel 2019 软件进行数据的初步整理和计算,采用SPSS 20.0 软件进行方差分析,使用Duncan 检验进行多重比较,以P=0.05 为显著性检验水平,所用数据均重复3 次。运用SigmaPlot 14.0 软件进行相关图表制作。
2 结果与分析
2.1 彩色豆马勃与麻栎幼苗共生的根系镜检与菌根定殖率
干旱胁迫下的Pt+D 处理与正常浇水的Pt 处理相比菌根结构无明显差异,根系表面均被致密的菌丝覆盖。在主根、侧根、根尖以及主根侧根交界处,菌丝均有分布(图1)。其中Pt 处理的菌根定殖率为38.67%,Pt+D 处理的菌根定殖率略高于Pt 处理,为40.67%(图2)。

图1 不同处理麻栎幼苗根系切片Fig. 1 Microscopic examination of Q. acutissima roots under different treatments

图2 不同处理麻栎幼苗菌根定殖率Fig. 2 Mycorrhizal colonization rates of the Q. acutissima seedlings under different treatments
2.2 不同处理对麻栎幼苗形态指标的影响
本研究发现彩色豆马勃与麻栎幼苗共生能有效促进其生长。在株高和地径方面,与CK 相比,Pt 处理分别提高了52%和44%,而Pt+D 处理比D 处理分别提高了49%和52%(图3A—B,P<0.05)。再者,D 处理的株高和地径均低于CK 处理,但无显著性差异(P>0.05),而Pt+D 处理的株高和地径与Pt 处理无明显差异(图3A—B)。叶片形态指标方面,D 处理比CK 处理的麻栎幼苗叶片厚度、单片叶干质量和单片叶面积均减小(图3C—E),其中叶片厚度显著性减少(P<0.05)。而Pt+D 处理与Pt 处理的麻栎幼苗叶片厚度无明显变化,另外单片叶干质量和叶面积均显著减小(P<0.05)。Pt 处理的叶片厚度与CK 处理间无显著性差异(P>0.05),但单片叶干质量和单片叶面积分别显著提高了53%和55%(P<0.05)。Pt+D处理的麻栎幼苗叶片厚度、单片叶干质量和单片叶面积比D 处理均有显著性提高(P<0.05),分别为51%、54%和55%。此外,D 处理的叶片组织密度均显著高于其他3 个处理(图3G,P<0.05),而其他3 个处理间均无明显差异(P>0.05)。对于特定叶面积指标(图3F),4 个处理间均无显著性差异(P>0.05)。

图3 不同处理对麻栎幼苗形态指标的影响Fig. 3 Effects of different treatments on the morphological indexes of Quercus acutissima seedlings

续图3Continuation of Fig. 3
2.3 不同处理对麻栎幼苗光合指标的影响
2.3.1 不同处理对麻栎幼苗光合色素含量的影响
由表1 可知,4 个处理中的叶绿素a、叶绿素b 和总叶绿素含量变化模式相同,均为Pt 处理>Pt+D 处理>CK 处理>D 处理。接种彩色豆马勃能有效提高麻栎幼苗叶片的叶绿素含量,Pt 处理叶绿素b 含量比CK 处理显著高出25%(P<0.05),而叶绿素a 和总叶绿素分别提高了13%和16%。干旱胁迫下叶绿素含量在各处理间有显著性差异(P<0.05),Pt+D 处理的叶绿素a、叶绿素b 和总叶绿素含量比D 处理分别提高了98%、92%和97%,而D 处理比CK 处理均显著性减小(P<0.05)。但接种彩色豆马勃后能缓解干旱导致的叶绿素降解,Pt+D 处理比Pt 处理叶片的叶绿素含量有所下降,但均未有显著性差异(P>0.05),这说明麻栎接种彩色豆马勃后能有效抵御干旱胁迫导致的叶绿素含量降解。类胡萝卜素含量在CK 处理、Pt处理和Pt+D 处理间无显著性差异(P>0.05),但D 处理显著低于其他3 个处理(P<0.05)。

表1 不同处理对麻栎幼苗光合色素含量的影响†Table 1 Effects of different treatments on the photosynthetic pigment concentrations of Q. acutissima seedlings (mg·g-1)
2.3.2 不同处理对麻栎幼苗叶绿素荧光参数的影响
如表2 所示,光系统Ⅱ光量子产量[Y(Ⅱ)]和电子传递速率(ETR)这两个参数整体变化模式相同,数值均为CK 处理>Pt 处理>Pt+D 处理>D 处理,其中CK 处理显著高于D 处理(P<0.05),其他3 个处理间均无显著差异(P>0.05)。4 个处理间的光化学荧光淬灭系数(qP)和淬灭系数(qL)无显著性差异(P>0.05)。从其他因素引起的非荧光淬灭的光量子产量[Y(NO)]来看,干旱胁迫条件下的两个处理比对应正常浇水条件下的两个处理高,其中D 处理显著高于CK 处理(P<0.05),但其他处理间无显著性差异(P>0.05)。而光系统Ⅱ的最大光量子产量(Fv/Fm)参数中Pt处理显著高于Pt+D 处理(P<0.05),而接种彩色豆马勃的两组处理分别高于未接种的两组处理,但无显著性差异(P>0.05)。

表2 不同处理对麻栎幼苗叶绿素荧光参数的影响Table 2 Effects of different treatments on chlorophyll fluorescence parameters of Q. acutissima seedlings
2.3.3 不同处理对麻栎幼苗气体交换的影响
如表3 所示,在净光合速率(Photo)和气孔导度(Cond)方面,接种彩色豆马勃能有效提高麻栎幼苗的Photo 和Cond,4 个处理由高到低依次是Pt 处理、Pt+D 处理、CK 处理和D 处理,其中4 个处理的Photo 均呈现显著性差异(P<0.05)。胞间CO2浓度(Ci)与蒸腾速率(Trmmol)的变化趋势基本相同,接种彩色豆马勃的两组处理分别显著高于对应的两个处理(P<0.05)。而干旱胁迫下,Pt+D 处理和D 处理的Ci 和Trmmol 含量分别低于Pt 处理和CK 处理。水分亏缺(VpdL)这个参数则是Pt+D 处理显著高于其他3 个处理(P<0.05),其他3 组处理间均无显著性差异(P>0.05)。
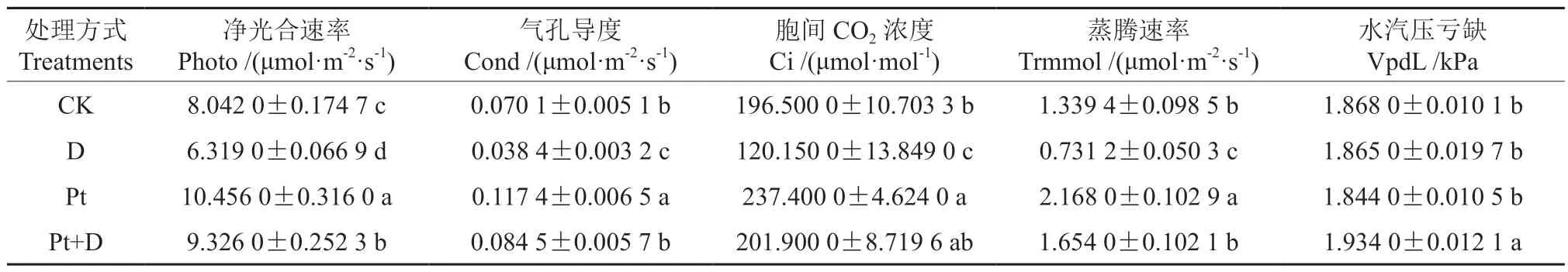
表3 不同处理对麻栎幼苗气体交换的影响Table 3 Effects of different treatments on the gas exchange of Q. acutissim seedlings
2.4 不同处理对麻栎幼苗抗氧化指标的影响
2.4.1 不同处理对麻栎幼苗抗氧化酶活性的影响
图4 表明,Pt 处理的SOD 活性显著低于CK处理(P<0.05),其他抗氧化酶活性在两个处理间均无显著性变化。在干旱胁迫下,除APX外,其他抗氧化酶的D 处理显著高于CK 处理(P<0.05),其中POD 活性最为显著;而接种彩色豆马勃的Pt+D 处理的SOD、CAT、APX 和GR 活性显著高于Pt 处理(P<0.05),而POD活性有所下降,但无显著性差异;再者,除POD活性显著低了55%外(P<0.05),其他抗氧化酶的Pt+D 处理与D 处理无显著差异。

图4 不同处理对麻栎幼苗抗氧化酶活性的影响Fig. 4 Effects of different treatments on the antioxidant enzyme activities of Q. acutissima seedlings
2.4.2 不同处理对麻栎幼苗抗坏血酸(AsA)和谷胱甘肽(GSH)含量的影响
由图5 可知,接种彩色豆马勃能提高麻栎幼苗的AsA 含量,Pt 处理AsA 含量比CK 处理显著提高了74%(P<0.05),而Pt+D 处理比D 处理则显著高了103%(P<0.05)。干旱胁迫条件下,D 处理AsA 含量比CK 处理低了30%,而接种的Pt+D 处理AsA 含量比Pt 处理只低了18%。4 个处理间AsA 含量存在显著性差异(P<0.05)。再者,无论是否干旱胁迫,接种彩色豆马勃的Pt 处理和Pt+D 处理GSH 含量分别低于未接种的CK 处理和D 处理。其中,CK 处理的GSH 含量最高,Pt+D处理的含量最低。但这4 个处理的GSH 含量数值无显著性差异(P>0.05)。

图5 不同处理对麻栎幼苗抗坏血酸(A)和谷胱甘肽含量(B)的影响Fig. 5 Effects of different treatments on the ascorbic acid concentrations (A) and glutathione concentrations (B) of Quercus acutissima seedlings
2.5 不同处理对麻栎幼苗过氧化氢(H2O2)含量、丙二醛(MDA)含量和相对电导率的影响
干旱胁迫下D 处理H2O2的含量比CK 处理显著高出68%(P<0.05),而在接种的情况下Pt+D 处理H2O2的含量比Pt 处理只高出9%,无显著性差异(图6A,P>0.05),并且D 处理H2O2的含量显著高于其他3 个处理(P<0.05)。正常浇水情况下,接种彩色豆马勃对MDA 的含量无明显影响(图6B),但干旱胁迫下,接种后Pt+D 处理MDA 的含量比D 处理显著低了30%(P<0.05),并且D 处理显著高于其他3 个处理(P<0.05)。在相对电导率方面,正常浇水情况下,CK 处理与Pt 处理的相对电导率分别为25.7%和25.5%,无显著性差异(图6C,P>0.05)。但在干旱胁迫下,D 处理的相对电导率为80.9%,显著高于Pt+D 处理和CK 处理(P<0.05)。

图6 不同处理对麻栎幼苗过氧化氢含量(A)、丙二醛含量(B)和相对电导率(C)的影响Fig. 6 Effects of different treatments on the concentrations of hydrogen peroxide (A) and malondialdehyde (B), and relative electrolyte leakage (C) of Q. acutissima seedlings
2.6 不同处理对麻栎幼苗脯氨酸、可溶性糖和可溶性蛋白含量的影响
两个干旱处理的脯氨酸(Pro)含量均显著高于正常浇水的两个处理(图7A,P<0.05),其中Pt+D 处理比Pt 处理只高出71%,而D 处理与CK 处理间相差高达188%。并且干旱胁迫下D 处理Pro 的含量显著高于Pt+D 处理(P<0.05)。而在正常浇水情况下,CK 处理与Pt 处理间却无显著性差异(P>0.05)。

图7 不同处理对麻栎幼苗脯氨酸(A)、可溶性糖(B)和可溶性蛋白含量(C)的影响Fig. 7 Effects of different treatments on the concentrations of proline (A), soluble sugar (B) and soluble proteins (C) of Q. acutissima seedlings
由图7B 所示,干旱胁迫促使麻栎可溶性糖含量升高,麻栎幼苗接种彩色豆马勃能缓解干旱胁迫对植物的影响。其中D 处理比CK 处理显著高出63%(P<0.05),而Pt+D 处理比Pt 处理只高了15%,无明显变化。在正常浇水情况下,CK处理与Pt 处理间可溶性糖含量无显著差异(P>0.05)。但干旱胁迫下,接种彩色豆马勃后能有效降低可溶性糖的含量,Pt+D 处理比D 处理低了25%,具有显著性差异(P<0.05)。可溶性蛋白的变化趋势与可溶性糖大致相同。由图7C 可知,干旱胁迫下,D 处理和Pt+D 处理可溶性蛋白的含量分别显著高于CK 处理和Pt 处理(P<0.05),其中未接种两组间相差138%,而接种彩色豆马勃两组间只差50%。在正常浇水情况下,接种彩色豆马勃的Pt 处理可溶性蛋白的含量比CK 处理有所上升,但无显著性差异(P>0.05)。但在干旱胁迫条件下Pt+D 处理可溶性蛋白的含量比D 处理低了13%,无显著性差异(P>0.05)。
3 讨 论
3.1 不同处理对麻栎幼苗生长发育的影响
外生真菌彩色豆马勃作为一种抗逆性菌,在干旱等非生物胁迫下能使宿主植物受益[26]。本研究表明无论是否干旱情况下麻栎幼苗接种彩色豆马勃后,两个处理组的株高、地径、单片叶干质量和单片叶面积分别显著高于未接种两个处理组。干旱胁迫下造成植物缺水导致叶片萎蔫,造成D处理麻栎幼苗叶片厚度显著低于CK 处理,而叶片组织密度则显著高于CK 处理。然而Pt+D 处理下未出现叶片明显萎蔫症状,且Pt+D 处理叶片厚度与叶片组织密度相较于Pt 处理均无显著性差异,这说明接种彩色豆马勃减少了干旱胁迫下麻栎幼苗的水分丧失,进而减轻了干旱导致的伤害。这与Sebastiana 等[29]接种彩色豆马勃能缓解栓皮栎干旱胁迫的危害,并且干旱胁迫下与未接种的相比地上部分生物量有显著提高的结果一致。彩色豆马勃能提高植物的抗旱性一方面是因为其形成的菌根结构,根系表面形成一层菌套,菌丝套表面延伸出大量外延菌丝,外延菌丝能扩大植物根系与土壤的接触面积,促进植物根系对水分和营养物质的吸收[30],并且菌丝套又能减少根系水分流失[31];另一方面,有研究从彩色豆马勃的次生代谢产物中分离出吲哚-3-乙酸(IAA)[32],而低质量浓度的IAA 对植物的生长具有促进作用。
3.2 不同处理对麻栎幼苗光合作用的影响
植物叶绿体吸收的光能主要通过光合作用、叶绿素荧光和热耗散三种途径消耗。光合色素含量影响着植物对光能的吸收效率,进而影响光合效率[33]。本研究发现,正常浇水情况下,接种彩色豆马勃对麻栎幼苗叶片的叶绿素a 和叶绿素b含量高于未接种,而干旱胁迫下则更明显,均呈显著性差异。这说明彩色豆马勃能有效提高麻栎幼苗叶片的叶绿素含量,缓解干旱胁迫下导致的叶绿素含量的减少。这与接种外生真菌提高槲树幼苗叶绿素含量[34]的结果一致。气孔的开合影响着CO2同化量,进而影响光合作用,干旱胁迫造成植物的净光合速率(Photo)、气孔导度(Cond)、胞间CO2浓度(Ci)和蒸腾速率(Trmmol)不同程度地降低[35],这与本研究结论基本一致,在干旱胁迫条件下麻栎幼苗的Photo、Cond、Ci 和Trmmol 均显著低于正常浇水处理的。虽然接种彩色豆马勃并未使干旱胁迫下光合参数降低的趋势发生变化,但接种彩色豆马勃麻栎幼苗的Photo、Cond、Ci 和Trmmol 均要显著高于未接种的。这表明彩色豆马勃能缓解干旱胁迫下麻栎幼苗光合作用的抑制。再者,本研究发现Photo 降低的同时伴随着Cond 的降低,这说明在干旱胁迫下,麻栎幼苗光合作用的降低主要是气孔因素造成的,这与彭思利等[36]干旱胁迫对接种外生菌根真菌的构树幼苗由气体因素导致Photo 下降的结果相似。
研究表明,在干旱胁迫和高温胁迫下光系统Ⅱ(PS Ⅱ)的最大光量子产量(Fv/Fm)参数值降低[37],本研究也同样发现干旱胁迫下麻栎幼苗的叶绿素荧光参数PS Ⅱ光量子产量[Y(Ⅱ)]、电子传递速率(ETR)和Fv/Fm均显著低于正常浇水的处理,接种彩色豆马勃之后Y(Ⅱ)和ETR 参数在干旱胁迫和正常浇水处理之间不再有显著性差异。并且接种也同时提高了Pt 处理和Pt+D 处理麻栎幼苗的Fv/Fm参数值,而Pt+D 处理的Fv/Fm值又高于D 处理,与Sebastiana 等[29]接种彩色豆马勃对栓皮栎Fv/Fm的结果一致,这揭示了彩色豆马勃能增加寄主植物的光化学潜能。
3.3 不同处理对麻栎幼苗抗氧化系统的影响
通常情况下,菌根真菌植物能通过提升抗氧化酶活性来抵御干旱导致的ROS 毒害[38]。ROS 的产生首先通过SOD 催化O2−歧化为O2和H2O2,而后H2O2又被CAT 和POD 等抗氧化酶进一步分解成O2和H2O[7]。本研究中接种彩色豆马勃的Pt+D 处理SOD 活性稍微高出D 处理,这说明麻栎幼苗接种后产生更多的H2O2。然而Pt+D 处理的CAT 和POD 活性却均低于D 处理,并且Pt+D 处理的H2O2含量却低于D 处理,说明SOD 催化产生的H2O2并未通过抗氧化酶CAT 和POD 进行催化分解,而是可能通过其他抗氧化酶降低了H2O2的含量,这说明干旱胁迫下接种彩色豆马勃能保护麻栎幼苗,提高抗旱能力。但如何诱发抗氧化酶缓解干旱对麻栎幼苗的伤害,以及究竟是何种抗氧化酶还需要进一步通过测定验证。
逆境条件下,抗坏血酸-谷胱甘肽(AsA-GSH)途径是抵御ROS 毒害和清除H2O2的主要抗氧化途径[39]。其中,APX 通过将AsA 作为底物将多余的H2O2还原成H2O,说明APX 的活性与AsA 的含量具有较强的相关性[40]。然而本研究中,接种彩色豆马勃未能提高正常浇水和干旱胁迫下麻栎幼苗的APX,而AsA 含量却显著地提升且Pt+D处理的H2O2显著低于D 处理。这表明接种彩色豆马勃诱发其他途径促进麻栎幼苗AsA 含量的合成[39]和H2O2的降解,并非通过AsA-GSH 途径。GR 将氧化型谷胱甘肽(GSSG)还原成GSH,通过GSH 来间接参与活性氧物质的清除以及维持蛋白质的稳定[41]。本研究中接种彩色豆马勃的Pt 处理比CK 处理的GR 活性稍有提升,却与GSH 含量呈现相反趋势,两者均无显著性差异。这说明接种彩色豆马勃对麻栎幼苗的GR 活性的提高并未诱导GSH 的还原,可能存在某种机制导致GSH被氧化,这需要从分子水平进一步验证。另外Pt+D 处理GR 活性却低于D 处理,这与接种彩色豆马勃Pt+D 处理的GSH 含量低于D 处理相对应。这可能是由于接种彩色豆马勃并未促进干旱胁迫下麻栎幼苗的GR 活性以及正常水分下GSH 被氧化的某种机制相关而导致,进而表明干旱胁迫下麻栎幼苗接种彩色豆马勃并未对AsA-GSH 途径造成影响。
膜脂过氧化产物丙二醛(MDA)和相对电导率能够反映干旱对植物细胞膜的破坏程度[6,11]。本研究中,Pt+D 处理的MDA 含量和相对电导率与Pt 处理和CK 处理相比均无明显变化,而Pt+D 处理的MDA 含量和相对电导率显著低于D 处理,这说明接种彩色豆马勃能有效地减少干旱对植物细胞膜的损害,受胁迫损伤也远低于未接种的D处理,这可能是由于干旱胁迫下接种彩色豆马勃能降低水分丧失,减少ROS 的过多积累,进而维护了细胞膜的稳定。
3.4 不同处理对麻栎幼苗渗透调节系统的影响
干旱胁迫下,植物通过合成渗透调节物质来提高自身抵御水分胁迫的能力。本研究发现,干旱胁迫下麻栎幼苗叶片的脯氨酸、可溶性糖和可溶性蛋白含量增加,表明无论是否接种彩色豆马勃均能在缺水的情况下增加其含量来维持渗透平衡,维持叶片水分,保持细胞的稳态[8]。然而,Pt+D 处理的脯氨酸、可溶性糖和可溶性蛋白含量低于未接种的D 处理。其中,Pt+D 处理的脯氨酸含量较低,与干旱胁迫下Manoharan 等[42]对接种菌根的金脉刺桐和张中峰等[38]对接种彩色豆马勃青冈栎的研究结果相似。这表明干旱胁迫对于接菌的麻栎幼苗植株伤害较小或是菌根共生后使植物的水分代谢能力改善从而缓解了胁迫程度[38]。在干旱胁迫下,未接种的D 处理比Pt+D处理可溶性糖含量积累得更多,这与干旱下外生真菌共生植物通过可溶性糖的积累提高渗透调节能力不一致,与Sebastiana 等[29]干旱下接种彩色豆马勃的栓皮栎比未接种的可溶性糖含量低相似。Sebastiana 等研究认为叶片中水势与可溶性糖含量之间无相关性,这说明可能麻栎幼苗叶片水势不受接种彩色豆马勃的影响,以及接菌的麻栎幼苗在水分胁迫条件下维持更好的性能相关。虽然,Pt+D 处理与D 处理可溶性蛋白的含量无显著性差异,说明在干旱胁迫下接种彩色豆马勃能够促进麻栎可溶性蛋白的增加,保护细胞膜的稳定性。但还是比D 处理低,这可能是由于菌根形成后一定程度上能保护细胞免受胁迫伤害,维持膜蛋白的稳定性[4]。
4 结 论
接种彩色豆马勃能在麻栎幼苗根部形成一层菌丝套,促进营养物质的吸收,从而促进植株的生长发育。干旱胁迫下,接种彩色豆马勃能缓解光合色素的降解,维护叶绿体结构的完整性,改善光合作用机制。而接种彩色豆马勃麻栎幼苗在干旱胁迫下除SOD 外抗氧化酶的POD、CAT、APX和GR 活性以及渗透调节物质Pro 外,可溶性糖和可溶性蛋白均低于未接种的处理,而H2O2、MDA和相对电导率却呈现相反趋势,这可能是由于接种彩色豆马勃增加了麻栎幼苗的水分吸收以及促进了植株的水分代谢能力,维持了更好的性能,缓解了干旱胁迫带来的损害,维护了细胞结构的稳定,增强了麻栎幼苗的抗旱性。上述测定的抗氧化酶和渗透调节物质导致麻栎幼苗抗旱机能提升还需进一步验证。另外,接种彩色豆马勃如何从分子机制来提高麻栎幼苗的抗旱性以及有哪些抗旱基因调控响应还需进一步研究。

