无毛青藤叶绿体基因组解析及系统发育分析
赵文植,杨琳懿,曹正英,辛 静,马路遥,王 飞,李卫英,辛培尧
(西南林业大学 a. 国家林业和草原局西南风景园林工程技术研究中心;b. 西南地区生物多样性保育国家林业和草原局重点实验室,云南 昆明 650224)
青藤属Illigera为常绿藤本植物,主要分布于亚洲热带和非洲南部地区。在我国主要分布于云南、贵州、福建等地,占据了约全球30 个种中的2/3 以上。无毛青藤产于云南西部,茎紫褐色,光滑无毛,与小花青藤十分相似[1]。青藤属植物在中国自然分布的野生资源十分丰富,这也客观上为该属的研究提供了大量的天然资源。青藤属植物大多具有止痛消肿、活血化瘀的功效[2];药效成分主要为生物碱、甾体和萜类化合物,这些化合物分别表现出细胞毒活性、抗凝血活性、抗血管肾上腺受体活性等[3]。广西壮族居民常用其治疗风湿类疾病[4]。
创新活动的分工、评价、奖励要公平、公正,才能保证创新活动有序、高效和充满活力的展开,创新活动成果才能不断涌现。这里从事业、文化和经济基础三个角度谈谈创新生态。
在农村,上大学,找个体面工作,是许多普通农家的期望,但是河南省正阳县慎水乡台天村民兵连基干民兵牛超,却选择了回乡创业。
近年来,对青藤属植物的研究主要集中于地理分布与资源调查、生态生理、植株化学成分、药理作用等方面[5-10],而对该属植物基因组方面的研究报道较少。在植物基因组中,叶绿体基因组由于结构较简单,分子量较小,且分析技术手段较完善,所以更容易对其完整的基因组进行组装。叶绿体是拥有独立稳定基因组的半自主细胞器,具有高度的保守性且进化速率较慢,在不同物种间具有更好的统一性。因此,其基因组序列可用于鉴定物种、系统发育及转基因等方面的研究[11-12]。在叶绿体基因组中,同义密码子作为重要的氨基酸信息,存在着密码子使用方面的偏好性,受较多因素的影响,对揭示物种基因组的进化关系以及转叶绿体基因有着重要意义。而叶绿体基因组中的简单重复序列(SSR)则会影响染色体的空间构象及编码序列的表达。因此,该方面的研究有利于开发新的SSR 标记用作遗传多样性分析以及物种或品种的鉴定。相关研究已在羊踯躅Rhododendron molle[12]、杧果Mangifera indica[13]、蒜头果Malania oleifera[14]、 裂叶榆Ulmus laciniata[15]等植物中有所报道,并为揭示相关植物的质体基因组结构特征提供了一定的理论基础。
目前,有关青藤属植物叶绿体基因组的研究大部分集中于使用叶绿体基因组片段和ITS 进行系统发育等分析,如Michalak 等[16]用叶绿体trnTtrnL、trnL-trnF和psbA-trnH基因间隔区重建莲叶桐科的系统发育树,结果显示青藤属、莲叶桐属Hernandia和杨樟属Hazomalania聚为一支,但出现了平行枝,不能分辨其姐妹关系。Renner 等[17]用叶绿体rbcL基因和rnL-trnF基因间隔区对包括青藤属在内的38 属58 个物种进行系统发育分析,结果显示青藤属与莲叶桐属的亲缘关系最近。目前,仅有3 个青藤属植物的完整叶绿体基因组[18-19]有所公布。基于叶绿体全基因组构建青藤属植物系统发育树的研究还未见提及,而无毛青藤叶绿体基因组方面的研究也鲜有报道。以无毛青藤I. glabra为试验材料,采用二代高通量测序技术对无毛青藤绿体基因组进行测序。将其与5 个近缘种(大花青藤I. grandiflora、红花青藤I. rhodantha、小花青藤I. parviflora、宽药青藤I. celebica和绣毛青藤I. rhodanthavar.dunniana)的叶绿体基因组进行比较基因组学和系统发育的研究,结果可为进一步探讨青藤属系统进化和遗传多样性等问题提供更多的理论支持。
1 材料与方法
1.1 试验材料
无毛青藤采自于云南省勐腊县勐仑镇(21.9170N,101.2713E;540 m),选择并采集健康的叶片在液氮中速冻,然后存于-80 ℃冰箱中,以备后用。
1.2 试验方法
1.2.1 DNA 提取及测序
1.2.4 密码子偏好性分析
使用IRscope 软件分析无毛青藤与其他5 种青藤的叶绿体基因组结构中四大分区的SC/IR 边界扩张收缩情况;通过mVISTA 软件,以无毛青藤叶绿体基因组为参照,并与另外5 种青藤植物进行比对分析。同时,对核酸变异情况利用DnaSP软件[28]进行分析,并筛选出高变区。
测序完成后得到高质量clean reads。以红花青藤(Gen-Bank 登录号:MW755975)叶绿体基因组作为参考序列,使用Jin 等[21]设计的GetOrganelle软件对无毛青藤的叶绿体基因组进行组装,利用Geneious R8.1.3 软件[22]进行基因组注释。
随着经济的发展和木材需求量的增加,杉木纯林已经不适应现代社会的发展需求。本文主要分析杉木纯林和混交林方面的内容,重点分析了林下植物多样性,得出如下结论:林下植物的多样性指数会受到多因素影响,如物种丰富度、物种数、均匀度指数、植被类型、环境和人为干扰等;本文研究的杉木纯林和混交林的林下植物多样性同样受环境因素的综合影响,某些区域出现物种优势度指数为1.000的情况,主要是因为某一物种在其中占有绝对优势,完全限制了其他物种的生长。
1.2.6 无毛青藤cpDNA 序列的比较分析
采用BEIER 等[23]提出的方法,利用在线工具MISA-web(https://webblast.ipk-gatersleben.de/misa/index.php,由perl 程序运行)对无毛青藤叶绿体基因组中的SSR 进行识别。
采用CTAB 法[20]提取总DNA,并送至天津诺禾致源生物信息科技有限公司进行测序。
在植物进化的过程中,叶绿体基因组的IR 区和LSC 区、SSC 区的边界一般会出现扩张或收缩现象,这是叶绿体基因组长度在不同被子植物中存在差异的重要原因,在植物叶绿体基因组的演化过程中具有重要作用[31-32]。经比较分析发现,6 个青藤属植物叶绿体基因组变化的大小差异为1 477 bp,而LSC、SSC 与IR 4 个区域的差异大小表现为LSC(约711 bp)>IR(789 bp)>SSC(139 bp)。所以,整体基因组长度的差异基本上是由IR 区和LSC 区造成的。红花青藤叶绿体基因组的结构与其他5 个种有较大的差异,这可能与其叶绿体基因组IR 区发生了收缩有关,同时也印证了不同植物的叶绿体基因组会由于IR 区的收缩和扩张而产生差异的说法[33]。在董溪等[34]的研究中,包括短叶黄杉Pseudotsuga brevifolia在内的16 个松科植物的trnH基因处于SSC/IRb 边界且完全位于SSC 区,但在青藤属植物中,trnH基因大部分位于LSC 区,且除红花青藤外,均刚好位于IRa/LSC 边界,这种现象可能与青藤属植物叶绿体基因组IR 区发生了收缩有关。
在无毛青藤叶绿体基因组密码子使用分析中发现,以A/U 结尾的Arg 密码子被优先使用。共检测到64 种密码子,编码20 种氨基酸(图2)。我们检测到33 个RSCU 值大于1 的简并密码子,2 个RSCU 值为1 的简并密码子,表明它们主要用于编码无毛青藤中的某些氨基酸。在64 种密码子中,使用偏好最强的是编码Arg(精氨酸)的AGA 密码子(RSCU 值为1.75),最低的是编码精氨酸的CGC 密码子(RSCU 值为0.47)。在20 种氨基酸中,Leu(亮氨酸)、Ser(丝氨酸)和Arg(精氨酸)使用了6 种密码子;其次是Val(缬氨酸)、Pro(脯氨酸)、Thr(苏氨酸)、Ala(丙氨酸)和Gly(甘氨酸)各使用了4 种密码子;Ile(异亮氨酸)和终止子使用了3 种密码子;在20 种氨基酸中有9 种氨基酸仅使用2 种密码子,分别为Phe(苯丙氨酸)、Tyr(酪氨酸)、His(组氨酸)、Gln(谷氨酰胺)Asn(天冬酰胺)、Lys(赖氨酸)、Asp(天冬氨酸)、Glu(谷氨酸)和Cys(半胱氨酸);而 Trp(色氨酸)和Met(甲硫氨酸)仅使用1 种密码子。除了蛋氨酸和色氨酸的密码子外,所有的首选密码子都以A/U 结尾,说明无毛青藤叶绿体基因组密码子偏好使用A 或U 结尾的密码子。
从NCBI 数据库下载已公布的莲叶桐科Hernandiaceae 莲叶桐属Hernandia莲叶桐Hernandia nymphaeifolia(MG838431)完整的叶绿体基因组序列作为外类群,使用青藤属5 个种及一个变种的叶绿体DNA 建立系统发育树,利用MAFFT 软件[25]进行序列比对,利用iqtree 软件[26]对经人工检查后的矩阵用ML 法进行系统进化树构建及分析,选择最佳模型TVM+F+I+G4,自展值Bootstrap 设为1 000[27]。
1.2.3 SSR 位点识别
3.A 提示:氨水的主要成分NH3·H2O是弱电解质,氢氧化钠是强电解质,前者部分电离,后者完全电离,故通过室温下测定等浓度氨水和NaOH溶液的pH,可比较氨水和NaOH碱性强弱,A项正确。由于NH3·H2O是弱碱,Al(OH)3不能溶于氨水中,故无法验证Al(OH)3的酸性,B项错误。浓硫酸无挥发性,无法观察到白烟,C项错误。NH4Cl受热也会分解,故不可采用加热法除杂,D项错误。
1.2.2 叶绿体全基因组的组装、注释
2 结果与分析
2.1 基因组基本特征
测序得到的无毛青藤叶绿体基因组全长为156 513 bp,GC 含量为39.1%。结构为典型的环状双链四分体结构,包括1 对反向重复区(IRs,26 254 bp)、1 个大单拷贝区(LSC,85 225 bp)和1 个小单拷贝区(SSC,18 779 bp)。4 个区段中,IR 区的GC 含量最高(43.3%),LSC 区GC 含量为37.7%,SSC 区最低。注释无毛青藤叶绿体基因组共获得131 个基因。其中,84 个位于LSC 区,SSC 区13 个,两个IR 区各17 个,包括86 个编码蛋白质基因,37 个tRNA 基因及8 个rRNA。在IRs 区域有18 个基因被重复一次。有45 个编码蛋白质基因与光合作用相关;除rRNA 基因和tRNA基因外,自我复制相关以及其他基因共计34 个(图1)。
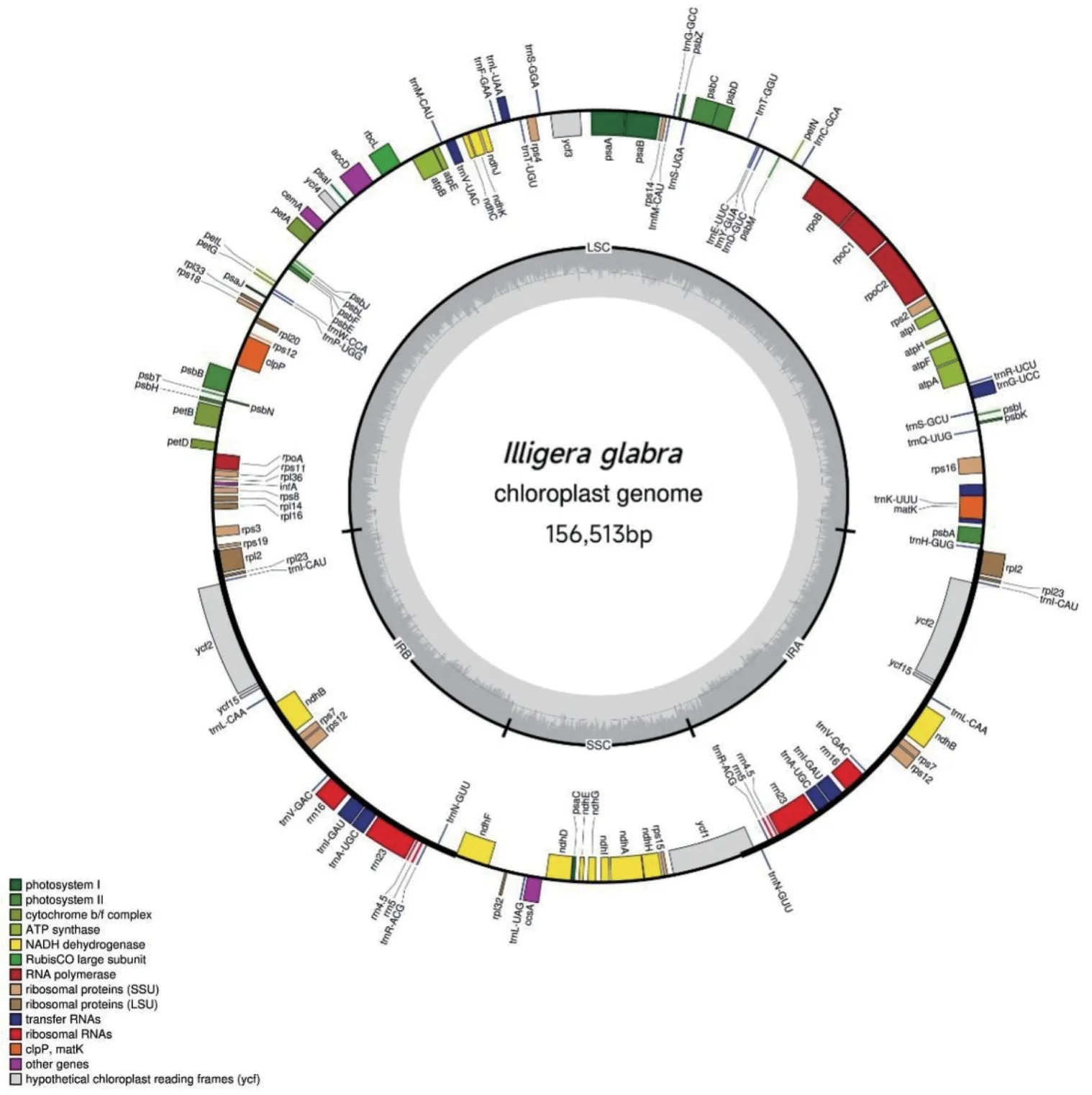
图1 无毛青藤叶绿体基因组结构Fig. 1 Structure of the chloroplast genome of I. glabra
2.2 SSR 分析
无毛青藤叶绿体基因组中共获得61 个SSR 位点(表1),其中,最多的是单核苷酸重复(44 个),其中43 个为A/T 重复,1 个C/G 重复;二核苷酸重复位点3 个,包括1 个AC/GT 重复和2 个AT/AT 重复;三核苷酸位点2 个,均为AAT/ATT;具四核苷酸的SSR 共计11 个,包括7 种类型基序;五核苷酸SSR 仅有1 个,为AAAGT/ACTTT。在所获得的SSR 中A/T 重复最多,共有43 个,占所有SSR 的70.49%,表明无毛青藤的叶绿体SSR 有使用A 和T 碱基的偏好性。

表1 无毛青藤叶绿体基因组SSR 信息统计Table 1 SSR in the chloroplast genome of I. glabra
2.3 密码子使用偏好性分析
1.2.5 系统发育分析
用平板凝集试验对474头份被检血清进行检测,从中可以看出,感染羊布鲁式杆菌的羊有七成左右,从中可以看出受到感染的羊群较多,故此,加强对羊群的检疫是其中的重点和关键。

图2 无毛青藤叶绿体基因组密码子使用情况Fig. 2 Codon usage in the chloroplast genome of I. glabra
2.4 叶绿体基因组系统进化分析
对包含无毛青藤在内的6 个青藤属物种叶绿体基因组序列进行多重比对,并构建系统发育树(图3)。结果表明青藤属6 个种分为两支,其中宽药青藤和小花青藤为一支,其余4 种为一支。无毛青藤与大花青藤亲缘关系较近,无毛青藤与大花青藤首先聚为一支,支持率达到100%(1 000次检验水平);而后又和红花青藤聚为一个分支,支持率为99%;最后才与锈毛青藤聚为一类。

图3 6 种青藤属植物叶绿体基因组的系统进化树Fig. 3 The phylogenetic tree constructed by using the chloroplast genomes of 6 Illigera species
2.5 SC/IR 边界分析
对无毛青藤等5 种青藤属植物叶绿体基因组四分体结构的SC/IR 边界收缩扩张进行分析,结果如图4 所示。结果(图4)表明:6 种青藤属植物的JLB(LSC/IRb)边界较为保守,除红花青藤JLB 边界位于rpl2基因的编码区外,其余均位于rpl2和rps19基因编码区之间;6 种青藤叶绿体基因组的JSB(IRb/SSC)区边界都位于ndhF基因的编码区内; JSA(SSC/IRa)区边界则均位于ycf1基因的编码区以内;JLA(IRa/LSC)边界方面,除红花青藤外,其余均位于trnH基因编码区之内。

图4 6 种青藤叶绿体基因组的IR/SC 边界收缩扩张情况Fig. 4 IR/SC boundary expansion and contraction of the chloroplast genomes of 6 Illigera species
2.6 叶绿体基因组的比较分析
将无毛青藤叶绿体基因组与宽药青藤、大花青藤、小花青藤、红花青藤和锈毛青藤叶绿体基因组进行对比分析,其结果如图5 所示。图5 结果显示:6 种青藤叶绿体基因组的基因构成和顺序较为保守,与SSC 和LSC 区相比,IR 区更为保守。大多数变异存在于相邻基因间隔区内,如rps16-psbK、psbM-trnD-GUC、petA-psbJ等。

图5 6 种青藤叶绿体基因组全长序列对比Fig. 5 Global alignment of the chloroplast genomes of 6 Illigera species
对6 种青藤叶绿体基因组的高变异区进行分析发现,6 种青藤叶绿体基因组的变异主要发生在SSC 和LSC 区,而IR 区大多数序列变异程度并不高,与序列对比分析结果一致;结合mVISTA 图谱确定rpl32-trnL-UAG(114 948 ~116 065 bp)和petA-psbJ(64 154 ~65 290 bp)为变异度最高的两个间隔区位置(图6)。
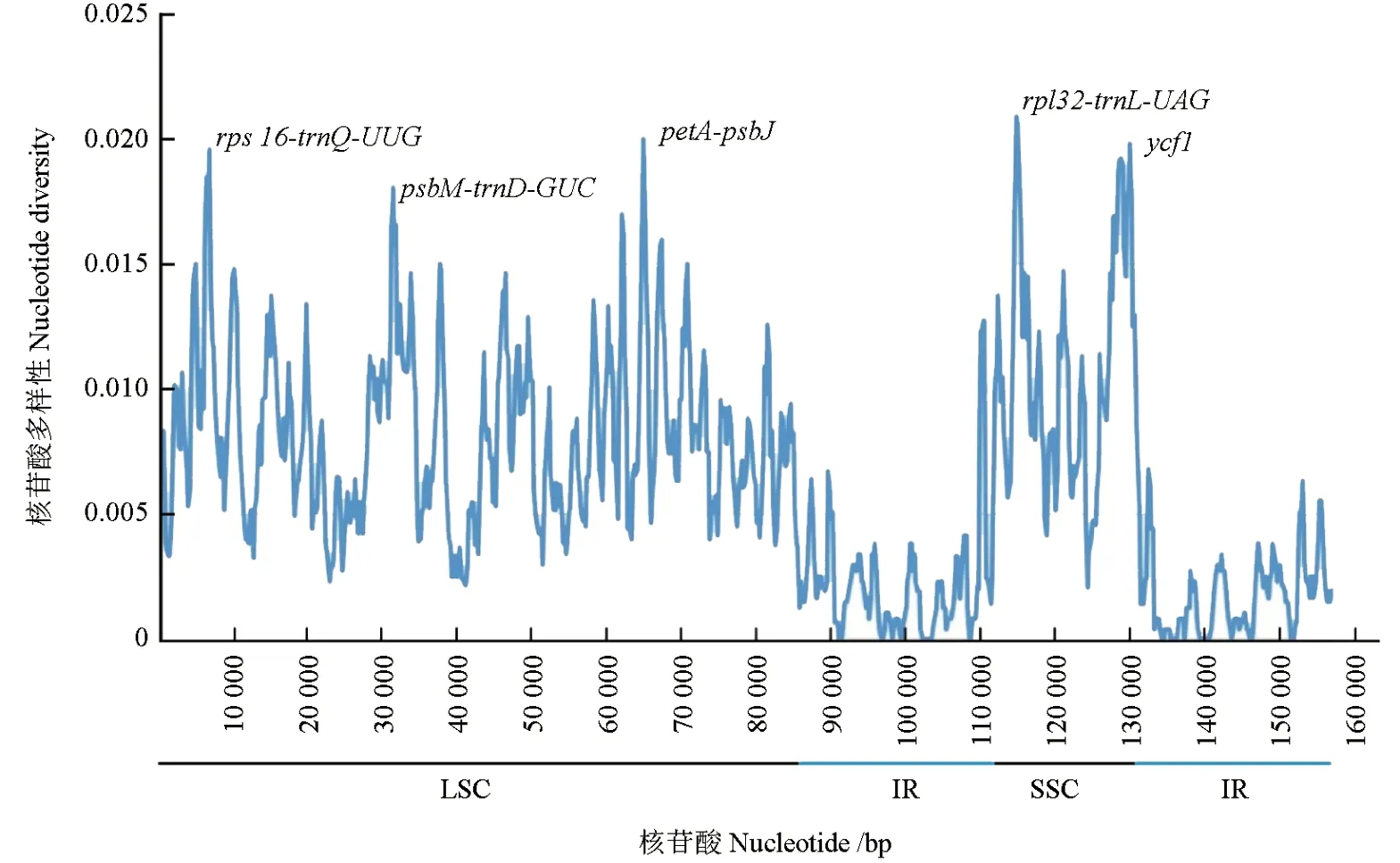
图6 6 种青藤匹配区域核酸变异性Fig. 6 Nucleic acid variation information in the matching areas of the chloroplast genomes of 6 Illigera species
3 讨论与结论
3.1 讨 论
和大多数被子植物一样,无毛青藤的叶绿体基因组也是四段式结构[29-30]。研究发现,无毛青藤叶绿体全基因组序列全长为153 294 bp,与已公布的大花青藤(156 138 bp)、宽药青藤(156 123 bp)和红花青藤(156 658 bp)相比并无太大差异。青藤属叶绿体基因组序列整体较相似,但也存在较明显的差异,同时非编码区的变异远高于编码区,在5 个Pi 值较高的区域中,4 个位于基因间区,一个位于基因区(ycf1)。梁凤萍等[11]则发现菊科植物中所有高变区均位于基因间隔区。而这些高变区的存在,可提供较为丰富的候选DNA 条形码,可在青藤属植物的种质鉴定以及系统进化研究等方面提供一定的信息。
采用WRIGHT 等[24]提出的方法,利用CodonW软件(http://codonw.sourceforge.net)计算同义密码子相对使用度(RSCU)。
因此,不同种类的润滑剂对气缸的工作性能都同时有着正面与反面的影响。要做好气缸的润滑优化,必须在选择润滑剂时综合考虑各类润滑剂。要选用含有不饱和成分较少的型号,同时还要添加如合成油聚α烯烃等成分,以更好地提高气缸的工作性能。
通过对无毛青藤叶绿体全基因序列的SSR 进行研究,发现SSR 位点中出现频率最高的为A/T,与杧果Mangifera indica[13]、蒜头果Malania oleifera[14]、朱蕉Cordyline fruticosa[35]、光叶子花Bougainvillea glabra[36]在相关研究中的结果相一致,且主要位于非编码区。Niu 等[37]和McCoy 等[38]认为碱基偏好性的产生与能量消耗有关,与A/T 碱基相比,G/C 碱基含有更多的氮原子,因此A/T 富集的碱基在突变时能量耗损会更少。而碱基的使用偏性在影响SSR 位点类型和密码子选择的同时,还对叶绿体基因组各个分区的稳定性产生了影响[39]。目前对青藤属叶绿体全基因序列SSR 的研究还较少,检索无毛青藤叶绿体基因组SSR 位点,继而结合分子生物学实验进行遗传变异分析、分子标记开发等研究,可为进一步开发青藤属其他植物的SSR 位点提供理论参考。
虽然叶绿体基因组的进化速率较慢,但也能提供用于鉴定物种的变异位点,如matK和trnLtrnF等片段[40]。随着现代测序技术的不断进步,叶绿体基因组的获取变得更为方便,可利用该基因组对青藤属不同物种的鉴定提供参考。目前,莲叶桐科植物系统发育关系还有许多不确定之处,莲叶桐科共5 个属,分别为青藤属、莲叶桐属、旋翼果属Gyrocarpus、杨樟属和九节桂属Sparattanthelium,在Michalak 等[16]的研究中,莲叶桐科分为两支,其中一支由莲叶桐属、杨樟属和青藤属组成,但该研究对青藤属内植物的物种亲缘关系并未进行很好的澄清。目前仅有3 个青藤属植物的叶绿体基因组被公布。因此,想要更清楚地阐明该属植物系统的发育关系,需要有更多相关的叶绿体基因组数据进一步佐证。
系统发育分析结果显示,无毛青藤与大花青藤的亲缘关系最近,其次为红花青藤和锈毛青藤,与宽药青藤和小花青藤关系最远,这与Michalak等[16]的相关研究结果相一致,他们也认为宽药青藤与无毛青藤关系相距较远;但他们却指出,宽药青藤和红花青藤关系最近,这与本研究结果不一致。在他们的研究中,并未使用小花青藤等分布于中国的物种,而本研究中仅用了5 个分布于中国的种。造成分歧的原因可能是使用的样本较少且采样地存在较大差异造成的。
所以,新农村综合自助服务区让移动化、碎片化的农户消费观成为现实,将效率提升到极致。在对数字化改造的今天,新农村综合自助服务区作为无人售卖领域的新尝试,飞入寻常百姓家或许只差一股春风。
㊳[日]一瀬智司:《公企業会計と公経営会計——公会計の公明化》,《会計検査研究》1号(創刊号)1989年第8期。
3.2 结 论
无毛青藤的叶绿体基因组序列全长为153 294 bp,GC 含量为39.1%。其结构包括大单拷贝区(LSC,85 225 bp)、小单拷贝区(SSC,18 779 bp)以及反向重复序列(IRs,26 254 bp)。共注释得到131 个基因,其中,84 个位于LSC 区,SSC 区13 个,两个IR 区各17 个。密码子偏好使用A 或U 结尾,SSR 组成以A 和T 碱基为主。区别于其他物种,其基因组相对较大,并与大花青藤具有较近的亲缘关系。研究结果可为无毛青藤及其近缘种的叶绿体基因组系统进化分析、物种鉴定和基因工程等相关研究提供重要的理论参考。

