失血性休克患者外周血自噬标志基因表达水平与合并脏器损伤的相关性
林雪容,王 佳,张志斌,朱丽娟
(河北北方学院附属第一医院急诊科,河北 张家口 075000)
失血性休克是快速大量失血后发生的全身性缺血缺氧性病理损害,是创伤后出现的严重并发症之一、也是创伤导致死亡的主要原因之一。失血性休克的特征是有效循环血量迅速减少后出现全身微循环障碍、脏器血流灌注不足,严重者会导致多个脏器功能损害、增加病死率[1-2]。因此,深入认识失血性休克发生发展过程中脏器损伤的特点及相关分子生物学机制,有助于发现保护脏器功能、提高失血性休克及救治成功率的分子靶点。细胞自噬是机体在缺血、缺氧、应激、炎症等病理刺激下维持内环境稳态的重要生物学机制,在进化上高度保守,其特征是细胞通过降解自身细胞器及大分子来对抗各种病理损伤条件、维持细胞内环境稳定[3-4]。在脓毒症诱导脏器损伤的模型中自噬显著激活、多种自噬标志基因表达增加,激活自噬显著减轻脓毒症模型中脏器损伤的程度[5-6]。本研究将在失血性休克患者中观察自噬的变化情况,具体分析失血性休克患者外周血自噬标志基因表达水平与合并脏器损伤的相关性。报告如下。
1 资料与方法
1.1一般资料 选择2020年6月—2022年8月我院收治的失血性休克患者128例作为失血性休克组,纳入标准:①符合《创伤失血性休克诊治中国急诊专家共识》[7]中相关的诊断标准;②入院后留取外周血标本用于自噬标志基因表达水平的检测;③研究所需的临床资料完整;④取得患者或家属的知情同意。排除标准:①合并原发性心脏、肝脏、肾脏疾病;②失血性休克的原发病因合并有肝脏损伤、肾脏损伤。选择同期收治的创伤出血且未合并休克的患者54例作为创伤出血对照组,体检的健康志愿者150例作为健康对照组。失血性休克组中男性71例、女性57例,年龄 27~72岁,平均(47.69±9.23)岁,体重指数22.83±5.42 ,接受手术治疗95例,合并高血压22例、糖尿病13例、高脂血症18例;创伤出血对照组中男性28例、女性26例,年龄29~68岁,平均(45.69±6.54)岁,体重指数22.62±5.51,合并高血压9例、糖尿病4例、高脂血症8例;健康对照组中男性84例、女性66例,年龄 28~68岁,平均(46.81±8.59)岁,体重指数23.12±6.23,合并高血压17例、糖尿病11例、高脂血症14例。3组一般资料比较差异无统计学意义(P>0.05),具有可比性。
本研究经医院伦理委员会批准通过。
1.2外周血自噬标志基因表达水平的检测 所有受试者抽取外周静脉血5 mL,采用淋巴细胞分离液(上海碧云天公司)分离外周静脉血中的淋巴细胞,加入裂解液(上海碧云天公司)对细胞进行超声破碎,提取细胞中的蛋白,采用BCA试剂盒(上海碧云天公司)检测蛋白浓度后将含有30 μg蛋白的样本加入SDS-聚丙烯酰胺凝胶,在凝胶中电泳分离蛋白,将蛋白从凝胶电转移至硝酸纤维素膜。将膜放入5%脱脂牛奶中、室温孵育1 h,洗膜3次后将膜放入1∶1 000稀释的Beclin-1、自噬相关蛋白5(Autophagy protein 5,Atg5)一抗(Abcam公司)或1∶2 500稀释的β-actin一抗(Sigma公司)中、4 ℃孵育过夜。次日,洗膜3次后将膜放入1∶2 000稀释的二抗中室温孵育1h,最后在凝胶成像仪(Bio-rad公司)中显影得到蛋白条带,根据条带灰度值、以β-actin为内参计算Beclin-1、Atg5的表达水平。
1.3失血性休克病情严重程度的评估 参照指南[8],根据入院时的伤情评价损伤严重度评分(injury severity score,ISS);根据失血性休克患者入院后24 h内各项指标的最差值计算急性生理和慢性健康评分Ⅱ(acute physiologyand chronic health evaluation Ⅱ,APACHEⅡ)评分以及序贯器官衰竭(sequentital organ failure assessment,SOFA)评分。APACHE Ⅱ及SOFA得分越高,失血性休克病情越严重。
1.4失血性休克患者脏器损伤的评估 入院后24 h内进行脏器损伤的评估。根据《中国急性心力衰竭急诊临床实践指南(2017)》[9]评价失血性休克入院后是否发生急性心力衰竭,标准如下:肺部湿啰音或哮鸣音,颈静脉充盈或肝颈静脉反流、下肢水肿,N末端B型利钠肽原(N-terminal pro B type natriuretic peptide,NT-proBNP)升高,胸片及超声心动图可见心脏扩大、胸腔积液;根据KDIGO标准[10]评价失血性休克入院后是否发生急性肾损伤,标准如下:入院后48 h内血肌酐(serum creatine,SCr)升高≥26.5 μmol/L或SCr较基础值升高1.5倍以上。根据《肝衰竭诊治指南(2018年版)》[11]评价失血性休克入院后是否发生急性肝损伤,标准如下:血清总胆红素≥34.2 μmol/L,血清丙氨酸转氨酶(alanineaminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)与正常值比较高出超过2倍。
1.5脏器损害相关辅助检查 入院后抽取失血性休克组患者的外周静脉血,采用全自动生化分析仪检测NT-proBNP、TBIL、ALT、AST、SCr、血尿素氮(blood urea nitrogen,BUN),进行心脏彩色多普勒超声检查,测定左心室射血分数(left ventricular ejection fraction,LVEF)。
1.6观察指标 ①比较3组外周血Beclin-1、自噬相关蛋白5(autophagy protein 5,Atg5)蛋白表达水平。②比较是否发生急性心力衰竭、急性肝损伤、急性肾损伤的失血性休克患者Beclin-1、Atg5蛋白表达水平。③分析失血性休克患者Beclin-1、Atg5蛋白与损伤严重度评分、急性生理和慢性健康评分Ⅱ、序贯器官衰竭评分的相关性。④分析Beclin-1、Atg5蛋白与NNT-proBNP、TBIL、ALT、AST、SCr、BUN、LVEF的相关性。
1.7统计学方法 应用SPSS 21.0统计软件和Prism 6.0软件处理数据。计量资料比较采用独立样本t检验、单因素方差分析和SNK-q检验,相关性分析采用Pearson检验。P<0.05为差异有统计学意义。
2 结 果
2.13组外周血自噬标志基因表达比较 失血性休克组患者入院时外周血中自噬标志基因Beclin-1、Atg5蛋白表达水平高于创伤出血对照组和健康对照组,差异有统计学意义(P<0.05);创伤出血对照组和健康对照组外周血中自噬标志基因Beclin-1、Atg5蛋白表达水平差异无统计学意义(P>0.05)。见图1、见表1。
表1 3组外周血自噬标志基因Beclin-1、Atg5表达比较Table 1 Comparison of the expression of autophagy marker genes Beclin-1 and Atg5 in peripheral blood in three groups

表1 3组外周血自噬标志基因Beclin-1、Atg5表达比较Table 1 Comparison of the expression of autophagy marker genes Beclin-1 and Atg5 in peripheral blood in three groups
组别例数Beclin-1/β-actinAtg5/β-actin失血性休克组1280.83±0.140.89±0.16创伤出血对照组540.53±0.07*0.36±0.06*健康对照组1500.49±0.08*0.32±0.06* F值36.29955.437 P值<0.001<0.001
*P值<0.05与失血性休克组比较(SNK-q检验)
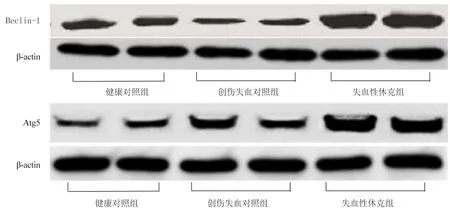
图1 3组外周血自噬标志基因Beclin-1、Atg5的蛋白条带
2.2是否发生脏器损害失血性休克组患者外周血自噬标志基因表达比较 发生心力衰竭、肾损伤、肝损伤的失血性休克患者入院时外周血中自噬标志基因Beclin-1、Atg5的蛋白表达水平低于未发生心力衰竭、肾损伤、肝损伤的患者,差异有统计学意义(P<0.05)。见表2。
表2 失血性休克组患者外周血自噬标志基因表达与发生脏器损害的关系Table 2 Relationship between autophagy marker gene expression in peripheral blood and organ injury in hemorrhagic shock group
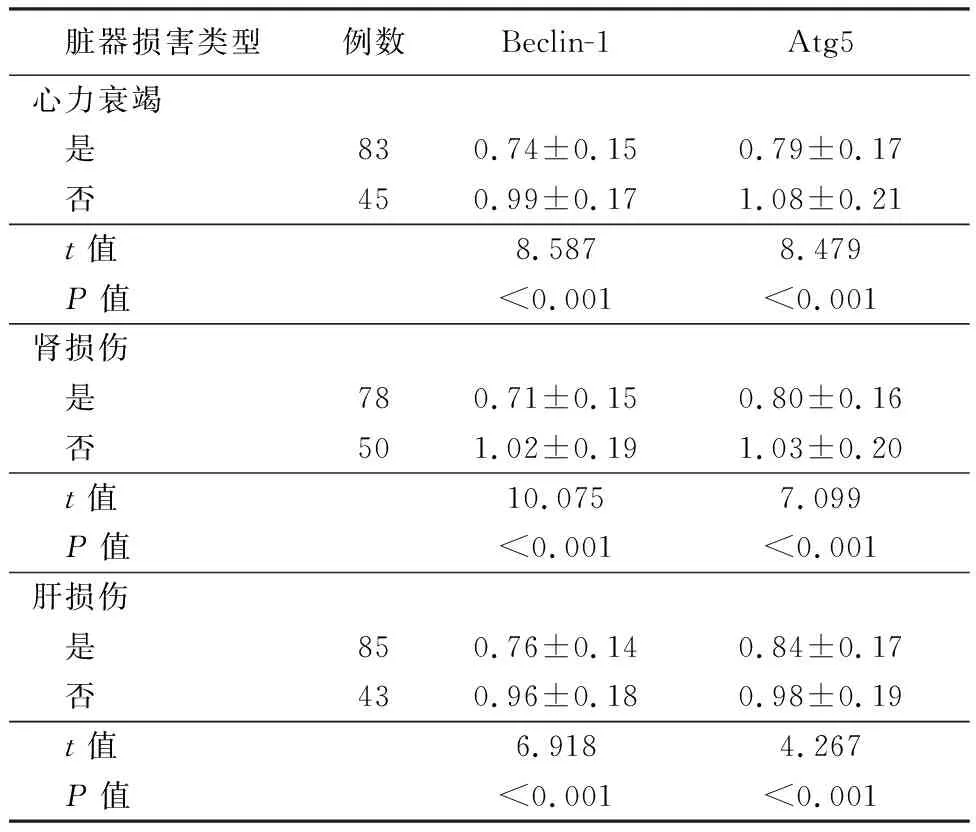
表2 失血性休克组患者外周血自噬标志基因表达与发生脏器损害的关系Table 2 Relationship between autophagy marker gene expression in peripheral blood and organ injury in hemorrhagic shock group
脏器损害类型例数Beclin-1Atg5心力衰竭 是830.74±0.150.79±0.17 否450.99±0.171.08±0.21 t值8.5878.479 P值<0.001<0.001肾损伤 是780.71±0.150.80±0.16 否501.02±0.191.03±0.20 t值10.0757.099 P值<0.001<0.001肝损伤 是850.76±0.140.84±0.17 否430.96±0.180.98±0.19 t值6.9184.267 P值<0.001<0.001
2.3失血性休克组患者外周血自噬标志基因表达与病情严重程度的相关性 失血性休克组患者入院时外周血中自噬标志基因Beclin-1、Atg5的蛋白表达水平与ISS评分、APACHE Ⅱ评分、SOFA评分呈负相关(P<0.05)。见表3。

表3 失血性休克组患者外周血自噬标志基因表达与病情严重程度的关系Table 3 Relationship between autophagy marker gene expression in peripheral blood and severity of disease in hemorrhagic shock patients
2.4失血性休克组患者外周血自噬标志基因表达与脏器损害相关辅助检查指标的相关性 失血性休克组患者入院时外周血中自噬标志基因Beclin-1、Atg5的蛋白表达水平与NT-proBNP、SCr、BUN、TBIL、ALT、AST呈负相关,与LVEF呈正相关(P<0.05)。见表4。
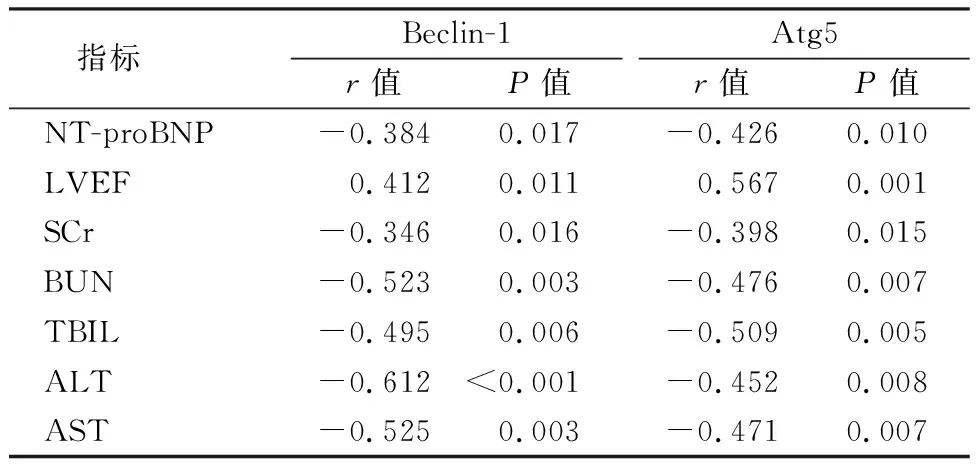
表4 失血性休克组患者外周血自噬标志基因表达与脏器损害相关辅助检查指标的关系Table 4 Relationship between autophagy marker gene expression in peripheral blood and auxiliary examination indexes related to organ injury in hemorrhagic shock group
3 讨 论
创伤是全球范围内仅次于心血管疾病和恶性肿瘤的第三位死亡因素,创伤导致的失血性休克是导致死亡的首要原因。创伤患者发生失血性休克后会出现脏器灌注不足及缺血缺氧、导致脏器功能损伤,严重者会发展为多器官功能障碍、显著增加疾病的救治难度及患者的死亡风险。因此,深入认识缺血性休克病情进展过程中脏器功能损伤的特点及相关的分子生物学机制对指导临床治疗具有重要的意义。
细胞自噬是一种高度保守的细胞分解代谢过程,受损或过剩的细胞成分、蛋白质和细胞器被隔离在双膜自噬体中,而后转移到溶酶体中形成自噬溶酶体并在各种生理和病理过程中进行降解和再循环。在缺血缺氧、炎症打击、应激刺激等病理条件下,自噬激活有利于维持细胞内环境稳定、增强想对抗各种病理条件的能力。多项基础研究证实,失血性休克动物模型中细胞自噬被激活,多种改善失血性休克的干预手段通过激活自噬发挥作用[12-13]。基于上述基础研究的结果,本研究观察了失血性休克患者体内自噬标志基因表示水平的变化。外周血Beclin-1、Atg5表达水平是目前国内外临床研究评价患者自噬的常用标志基因[14-15]。本研究结果显示,失血性休克患者外周血中Beclin-1、Atg5的表达水平高于创伤出血对照组和健康对照组,与失血性休克动物模型中自噬被激活的结果吻合;进一步分析自噬水平与失血性休克的病情可知:外周血Beclin-1、Atg5的表达水平与APACHE Ⅱ评分、SOFA评分呈负相关,表明失血性休克患者自噬激活越明显、休克病情越轻,与基础研究中自噬激活改善失血性休克病情的结果吻合。
失血性休克导致的脏器损伤主要累积心脏、肝脏和肾脏,表现为急性心力衰竭、急性肝损伤、急性肾损伤[16-17]。近些年关于自噬相关的研究证实,自噬在急性心力衰竭、急性肝损伤、急性肾损伤中发挥保护作用,激活自噬能够促进炎症因子、活性氧等损伤介质的清除,进而减轻脏器损伤[18]。本研究对失血性休克发病过程中自噬激活与脏器损伤的关系进行分析,入院时,失血性休克患者外周血中Beclin-1、Atg5的表达水平与心功能、肝功能、肾功能损伤呈负相关;入院后治疗过程中发生心力衰竭、肝损伤、肾损伤的失血性休克患者外周血中Beclin-1、Atg5的表达水平低于未发生心力衰竭、肝损伤、肾损伤的失血性休克患者。表明失血性休克发病过程中自噬激活对心脏、肝脏和肾脏具有保护作用,自噬激活越显著,发病时及发病后的治疗过程中心力衰竭、肝损伤、肾损伤的发生风险越低。
综上所述,失血性休克患者外周血中自噬标志基因表达增加能够起到代偿性的保护作用,与病情加重、脏器损伤程度均呈负相关。表明细胞自噬在失血性休克发生发展过程中起到脏器保护作用,减轻心脏、肝脏、肾脏损伤,降低心力衰竭、肝损伤、肾损伤的发生风险,这为今后发现失血性休克救治过程中保护脏器功能、降低病死率的分子靶点提供了依据。

