早期高脂肠内营养对脓毒症患者细胞免疫作用的临床研究
张丽骞 张立民 张玉平
严重脓毒症是危重患者最重要的死亡原因,其发病机制除失控性免疫功能紊乱外,严重的能量代谢障碍一直贯穿于整个疾病发展进程[1]。体内营养不足和负氮平衡与血源性感染密切相关,同时也与失控性炎性反应有复杂的相互关系[2,3]。临床营养支持在脓毒症的治疗过程中越来越受到重视。研究证实,脓毒症患者通过早期营养支持可显著减少机械通气的使用,降低住院时间和病死率[4,5]。并且,从并发症的产生、住院时间和费用、生活质量及生存率来看,早期肠内营养支持的效果显著优于肠外营养[6]。但是,目前在脓毒症患者肠内营养的成分和配比的选择上,仍不统一。动物研究发现,高脂肠内营养引起肠促胰酶肽(CCK)的分泌,进而通过CCK受体依赖方式活化迷走神经启动的胆碱能抗炎通路,重建肠道免疫平衡,保护失血性休克大鼠肠屏障功能,减少肠源性损伤因子入血[7]。Tihista等[8]证实,高脂肠内营养可显著降低ICU烧伤患者脓毒症、脓毒性休克和肠道损伤的发生率。此外,肠内配方高脂营养可通过改变患病机体内促炎性脂质和抑炎性脂质平衡,调节机体的免疫状态[8]。本研究从肠道内营养物质对机体免疫功能调控的角度,探讨高脂肠内营养对脓毒症患者干预作用的可能机制,为完善脓毒症患者的营养治疗提供资料。
1 资料与方法
1.1 一般资料 选取河北北方学院附属第一医院2018至2019年住院脓毒症患者60例和同期体检健康志愿者30例作为研究对象。脓毒症患者根据肠内营养方案的不同分为:常规肠内营养组和高脂肠内营养组,每组30例。常规肠内营养组男11例,女19例;年龄24~86岁,平均(65.22±14.24)岁;平均病程(25.39±14.53)d。高脂肠内营养组中,男13例,女17例;年龄33~88岁,平均(67.17±16.43)岁;平均病程(18.61±11.73) d。2组性别比、年龄比较差异无统计学意义(P>0.05)。
1.2 纳入标准 (1)体温>38.3℃或<36℃、心率>90/min、呼吸急促、意识改变;(2)白细胞计数>12 000/mm3或<4 000/mm3、白细胞计数正常但未成熟细胞>10%;(3)低血压:收缩压(SBP)<90 mm Hg,平均动脉压(MAP)<70 mm Hg;(4)动脉低氧血症、急性少尿、凝血功能异常、肠梗阻、血小板减少、高胆红素血症;(5)高乳酸血症、毛细血管充盈受损或皮肤花斑;(6)在内科监护室或外科监护室住院2~3 d;(7)同时伴有≥1个以上器官功能障碍者。
1.3 早期肠内营养支持方案 重症患者急性应激期应根据“允许性低热量喂养”原则进行营养支持[9],目标热量为83.7~104.6 kJ·kg-1·d-1;应激与代谢状态稳定后可增加至125.5~146.4 kJ·kg-1·d-1。本研究2组患者肠内营养的目标热卡和氮量相同,热量为104.6 kJ·kg-1·d-1,氮量为1.2 g·kg-1·d-1。
1.3.1 常规肠内营养组:在确诊脓毒症后24~48 h内置入鼻空肠营养管,并确定其位置准确,在血流动力学稳定后启动肠内营养。营养制剂采用24 h泵入。若患者胃肠道耐受性尚可,逐渐增加热量,7~10 d达目标热卡。营养液的脂肪含量50 g/L。
1.3.2 高脂肠内营养组:高脂肠内营养的实施方案与常规肠内营养组一致。但采用ω3鱼油脂肪乳(ω3多不饱和脂肪酸)将肠内营养液的脂肪含量提高到90 g/L,其中,ω6∶ω3脂肪酸的比值调整到2∶1、二十碳五烯酸含量>4 g/L、二十二碳六烯酸含量>2 g/L。脓毒症患者在治疗前及营养支持14 d后收集血液标本,以备后续检测。
1.4 观察指标 (1)细胞因子检测:酶联免疫吸附法(ELISA)试剂盒(R&D Systems)进行单核细胞源性细胞因子肿瘤坏死因子-α(TNF-α)、白介素-1(IL-1)、IL-6、转化生长因子β1(TGF-β1)和前列腺素E2(PGE2)以及淋巴细胞源性细胞因子IL-2、γ干扰素(IFNγ)、IL-4和IL-10检测。(2)单核细胞人白细胞抗原DR(HLA-DR)和淋巴细胞功能检测:用流式细胞法进行单核细胞数量和功能、淋巴细胞数量和淋巴细胞亚型分布检测。
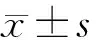
2 结果
2.1 单核细胞功能检测 常规肠内营养组治疗14 d HLA-DR水平高于治疗0 d,高脂肠内营养组14 d HLA-DR水平高于治疗0 d,差异均有统计学意义(P<0.05)。2组治疗14 dHLA-DR水平比较,差异无统计学意义(P>0.05)。见表1。

表1 高脂肠内营养对脓毒症患者单核细胞HLA-DR表达的影响 n=30,
2.2 淋巴细胞数量和亚型检测 高脂肠内营养支持组CD4+T淋巴细胞和CD4+/CD8+在治疗14 d后显著高于常规营养支持组(P<0.05)。见表2。

表2 高脂肠内营养对脓毒症患者总T淋巴细胞、CD4+T淋巴细胞、CD8+T淋巴细胞以及CD4+/CD8+的影响 n=30,
2.3 细胞因子检测 高脂肠营养支持组患者血清TNF-α、IL-6、PGE2、IFNγ、IL-10表达水平显著低于常规营养支持组,差异有统计学意义(P<0.05)。见图1,表3。

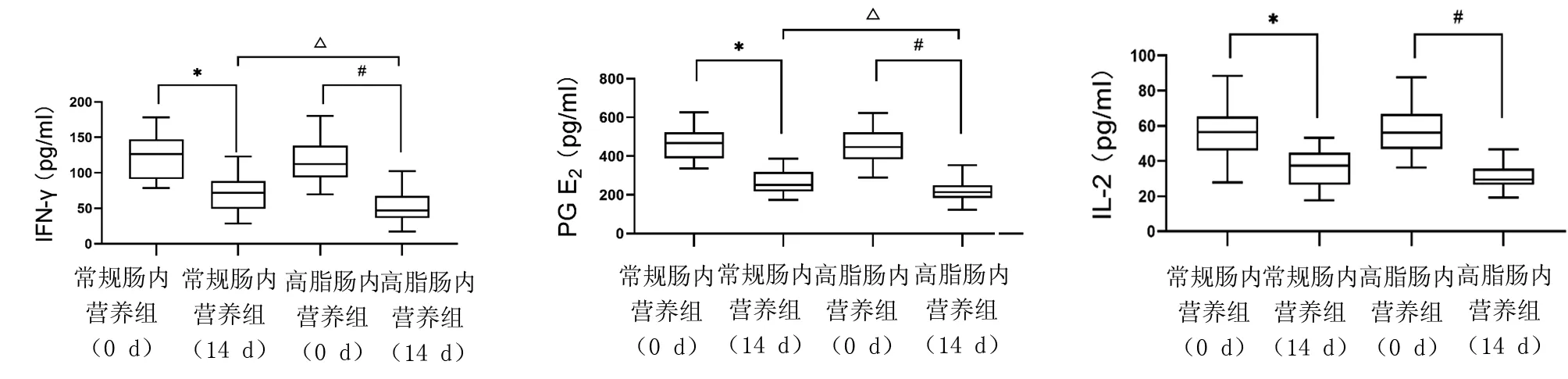

图1 高脂肠内营养对脓毒症患者血浆细胞因子的影响

表3 高脂肠内营养对脓毒症患者血浆细胞因子的影响n=30,pg/ml,
3 讨论
危重病患者普遍存在营养不良,会增加患者的病死率,而且使严重并发症发生率、住院时间、医疗支出显著增加。研究表明,脓毒症患者早期肠内营养支持可显著缩短住院时间,改善预后,提高患者的生存质量[10]。但是对脓毒症患者早期肠内营养支持的时间选择、成分配比等仍有争议。本研究发现,脓毒症早期肠内营养支持显著减轻患者体内的炎性反应水平,并且高脂肠内营养显著优于常规肠内营养。
脓毒症可以认为是一种宿主对感染强烈反应相关的严重临床综合征。脓毒症的严重程度与自我放大、失控的细胞因子风暴密切相关[11]。细胞因子是机体免疫功能调节的重要效应因子,在机体的生长发育、组织修复和免疫调节中发挥重要作用。根据来源通常可以将体内的细胞因子分为2大类:单核细胞源性细胞因子和淋巴细胞源性细胞因子[12]。这些细胞因子通过相应的受体发挥包括免疫调理、细胞杀伤、清除坏死组织等多样性的生物学效应,但是过度产生的细胞因子可以引起机体的自我损伤。本研究发现高脂肠内营养支持组TNF-α、IL-6、PGE2、IFNγ、IL-10显著低于常规肠内营养组(P<0.05)。这些结果表明,与常规的肠内营养支持比较,高脂肠内营养支持可显著抑制脓毒症患者体内过度活化的炎性反应。验证本研究分别检测了单核细胞的功能和淋巴细胞的亚型。本研究结果显示无论高脂肠内营养还是常规肠内营养支持治疗都可使其逐渐回升,但高脂肠内营养组CD4+T淋巴细胞和CD4+/CD8+淋巴细胞比值在治疗14 d后显著高于常规肠内营养支持组。这些结果表明,高脂肠内营养支持较常规营养支持具有更好的免疫调理作用,对于抑制脓毒症患者的失控的全身炎性反应具有显著的益处,其机制有待阐明。
大量的基础和临床研究表明,刺激迷走神经活化胆碱能抗炎通路具有显著的抗炎效应[13,14]。肠道内营养物质与自主神经的相互作用在机体的消化、免疫和代谢功能调节中具有非常重要的作用[15]。Lubbers等[16]进行的动物实验表明,富含脂质饮食可显著抑制失血性休克大鼠体内的TNF-α和IL-10水平,减轻肠屏障功能的破坏和细菌内毒素移位;这些效应可被迷走神经传入纤维阻滞和CCK-1受体拮抗剂所阻断。脓毒症患者早期高脂肠内营养支持是否也是由胆碱能抗炎效应实现的,有待进一步证实。
综上所述,脓毒症早期肠内营养支持显著减轻患者体内的炎性反应水平,并且高脂肠内营养显著优于常规肠内营养。本研究为脓毒症的治疗提供一种除药物治疗以外的新选择,此外也为完善脓毒症患者的营养支持提供了新的实验证据。

