菸花苷对快速上浮脱险致减压病的预防作用
刘程 方以群 李志勇 张珊珊 王楠 许骥 郭美丽
减压病(decompression sickness,DCS)是机体暴露在高压环境下后,由于环境压力突然降低造成溶解在组织内的惰性气体逸出形成气泡导致的一系列病理反应的疾病。DCS主要临床表现为皮肤瘙痒、大理石斑纹、关节肌肉疼痛、头晕头痛、胸闷气短、呼吸困难,严重时可发生偏瘫、截瘫甚至昏迷[1]。DCS是潜水员常见的一种职业性疾病,也会发生在潜艇部队人员和从事于航空航天、水下隧道施工、高压舱等高压暴露环境的工作人员中。近年来,快速上浮脱险技术由于脱险深度大、操作简单、安全性高等优势被广泛应用于世界各国潜艇脱险逃生中,然而一旦发生操作或调压不当,高压暴露时间过长,则会发生严重的DCS。目前,DCS的主要治疗方式是再加压吸氧治疗[2],但对于DCS的预防措施并没有明确的方案,预吸氧、运动、潜水习服等措施,都在一定程度上可以降低DCS的发病率[3]。然而,由于操作不便、环境条件要求高、预防效果不稳定等原因,这些措施并不适宜用于在水下作业的潜艇部队。使用药物预防DCS操作简便,无需特殊设备,是潜艇部队人员预防DCS的最优选择。因此,研究发现更多效果显著的DCS预防药物,已是当务之急。中医药对于多系统、多因素损伤疾病有着天然的优势。菸花苷(Nicotiflorin,Nic)是我国传统活血化瘀中药红花(Flos Carthami)中的黄酮类化合物,是红花的重要药效活性成分之一。研究发现,菸花苷具有抗炎、镇痛、保肝、抗动脉粥样硬化、抗肿瘤等多种药理作用[4-7]。课题组自主研发的菸花苷注射液作为治疗急性缺血性脑卒中的中药Ⅰ类新药,目前已完成Ⅰ期临床试验阶段。本研究主要探讨菸花苷对快速上浮脱险致DCS的预防作用,以期为DCS预防用药提供依据。
1 材料与方法
1.1 实验动物 使用雄性Sprague-Dawley(SD)大鼠(体重250~270 g)157只,购买自上海市计划生育科学研究所实验动物经营部,在清洁级动物房适应性饲养1周左右,室温22~25℃,湿度45%~60%,自由进食水,人工照明自动模拟昼夜。本研究所有内容得到了伦理委员会的允许和支持。
1.2 仪器设备 实验动物快速上浮脱险模拟舱(烟台宏远氧业有限公司);752N型紫外可见分光光度计(上海精密科学仪器有限公司);DHG9146-A电热恒温鼓风干燥箱(上海精宏实验仪器);Water 1525型高效液相色谱仪(美国Waters公司);Bio-Gen PRO200型精密匀浆器(美国 Pro Scientific公司);多功能酶标仪(美国 Thermo Fisher Scientific);荧光定量PCR仪(美国 Thermo Fisher Scientific)。
1.3 实验试剂 大鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白介素1β(interleukin-1β,IL-1β)、白介素6(interleukin-6,IL-6)、细胞间黏附因子-1(intercellular cell adhesion molecule-1,ICAM-1)酶联免疫反应(Elisa)试剂盒(杭州联科生物技术股份有限公司);RIPA裂解液(上海碧云天生物技术有限公司);UNIQ-10 柱式Trizol总RNA抽提试剂盒(上海生工生物工程有限公司);cDNA合成试剂盒(北京全式金生物技术股份有限公司);Green qPCR SuperMix试剂盒(北京全式金生物技术股份有限公司)。
1.4 药品准备 菸花苷使用注射液制剂(菸花苷含量为10 mg/ml),由江苏苏中药业集团股份有限公司生产提供(产品批号:20200409)。
1.5 方法
1.5.1 实验分组:将SD大鼠分为5组,分别为常压对照组(n=10只)、DCS组(n=30只)、菸花苷高剂量组(n=40只),中剂量组(n=40只),低剂量组(n=37只)。菸花苷注射液规格为10 mg/ml(苏中药业集团股份有限公司),给药组大鼠尾静脉分别注射菸花苷注射液5 mg/kg、10 mg/kg和20 mg/kg,其中5 mg/kg和10 mg/kg给药时使用0.9%氯化钠溶液稀释药物,使各菸花苷给药组给药体积相等;DCS组大鼠按照2 ml/kg剂量尾静脉注射0.9%氯化钠溶液。
1.5.2 减压造模方案:DCS模型选用快速上浮脱险致DCS动物模型。动物放在使用铁网封闭的鼠笼中,DCS模型组和菸花苷给药组同时放入高压舱内(宏远,烟台,中国),通过计算机程序自动进行加压-减压过程。28 s内加压至1.5 MPa后保持242 s,然后以3 m/s的速度减压至正常大气压,减压时间共50 s。空白对照组大鼠放入高压舱内,停留320 s后取出,不做加压、减压处理。见图1。
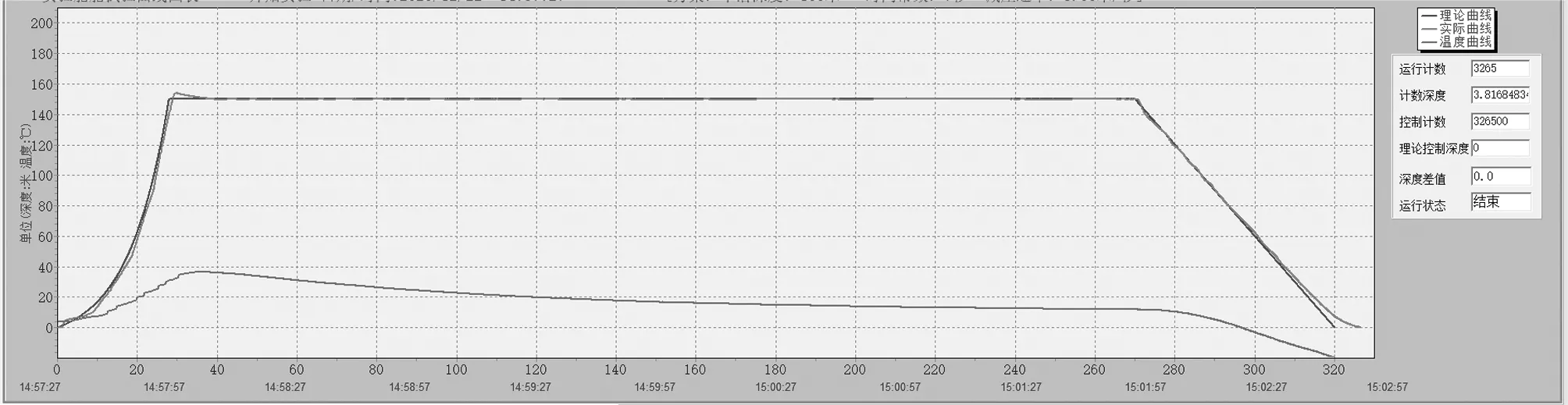
图1 快速上浮脱险模拟舱计算机自动加减压曲线
1.5.3 DCS行为学研究:大鼠出舱30 min内,观察DCS的发病情况,包括以下症状:行动障碍、前/后肢瘫痪、抽搐/痉厥、死亡。并根据进行评分,对上述症状分别赋予1、2、3、4,出现多种症状时,得分相加[8]。
1.5.4 组织学检查:每组取10只大鼠,腹腔注射戊巴比妥麻醉后脱颈开胸(死亡大鼠直接开胸),取右肺中叶,0.9%氯化钠溶液冲洗表面残留血液,滤纸吸干,放置于10%多聚甲醛中固定24 h后,脱水,石蜡包埋,切片成4 μm,放在载玻片上,切片放入Harris苏木素染3~8 min,自来水洗,1%的盐酸酒精分化5 s,自来水冲洗,0.6%氨水返蓝,流水冲洗,放入伊红染液中染色1~3 min。显微镜下检查,进行常规组织学分析。每个切片随机选取10个×200倍视野区域,每个区域根据间质细胞增生、水肿、充血、炎性细胞浸润程度进行评分[9]:0分,肺血管、间质、肺泡及支气管正常; 1分,间质及肺泡出血水肿范围<25%; 2分,间质增宽,肺泡腔出血水肿范围 25%~50%; 3分,间质明显增宽,肺泡腔出血水肿范围 50%~75%; 4分,间质明显增宽,肺泡腔出血水肿范围>75%。
1.5.5 肺组织湿干比测定:高压暴露结束后,每组取7只大鼠,剪取大鼠右肺后叶,0.9%氯化钠溶液冲洗表面血液,然后在滤纸上吸干组织表面水分,称重后确定右肺后叶湿;放入真空干燥箱,80℃烘干48 h,取出再次称重,确定干重。最后计算肺组织湿干重量比(wet/dry weight ratio,W/D)。
1.5.6 促炎细胞因子定量分析:常压对照组、DCS模型组和菸花苷高剂量组每组取大鼠剩余肺组织,每个样本剪取合适大小后剪碎,使用x1 PBS溶液冲洗表面残留血液,吸干表面水分,按重量:体积=1∶9的比例加入RIPA,匀浆,4℃ 12 000/min离心15 min,取上清液。使用Elisa试剂盒(联科,中国杭州),按照使用说明书,在预被板中加入标准品及肺组织样品,37℃ 孵育1.5 h;加入生物素抗体,37℃孵育1 h;洗板4次,加入HRP,37℃孵育0.5 h;洗板4次,加入TMB显色液,37℃孵育20 min,加入终止液;酶标仪450 nm测定OD值。通过标准品制作标准曲线,计算各样本浓度。
1.5.7 RT-PCR检测炎性因子mRNA水平表达:使用Trizol试剂(UNIQ-10 柱式Trizol总RNA抽提试剂盒,生工,中国上海)从大鼠肺组织中提取总RNA,使用逆转录第一链cDNA合成试剂盒(全式金,中国北京)将提取的肺组织总RNA逆转录成cDNA。采用RT-PCR检测肺组织中TNF-α、IL-1β、IL-6、ICAM-1的mRNA表达水平(相对表达量)。使用NCBI Primer Design(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计用于RT-PCR检测的基因引物序列,由生生物工程(上海)股份有限公司合成。见表1。

表1 SD大鼠TNF-α、IL-1β、IL-6和ICAM-1的基因引物序列
2 结果
2.1 菸花苷降低减压病的严重程度和死亡率 大鼠出舱后均出现伏地、活动减少和聚集蜷缩的状态,说明大鼠发生了减压病。当强迫大鼠活动时,部分大鼠出现行动障碍、前肢或后肢瘫痪、全身瘫痪或痉厥抽搐、原地翻滚等症状,根据行为学评分可发现,菸花苷组大鼠评分明显低于DCS模型组大鼠,可以显著降低大鼠死亡率,且呈现量效关系(P<0.05)。见表2,图2。

表2 5组大鼠死亡率和行为学比较
2.2 菸花苷缓解DCS致肺组织损伤 大鼠肺组织病理分析结果显示,相对于空白组大鼠肺组织,DCS模型组肺组织水肿严重,肺间质细胞出现显著水肿、增生,肺泡结构紊乱、融合,肺泡腔可见红细胞浸润。菸花苷给药组肺组织间质细胞水肿较轻,肺泡腔及肺间质红细胞浸润减少,肺组织结构基本完整,且损伤程度呈现量效关系。肺组织病理学评分,说明菸花苷降低了大鼠肺组织损伤程度。与常压对照组比较,DCS模型组大鼠肺组织W/D、肺组织病理学评分明显升高,而菸花苷高、中剂量组肺组织W/D、肺组织病理学评分明显低于DCS组,差异均有统计学意义(P<0.05)。见图3,表3。
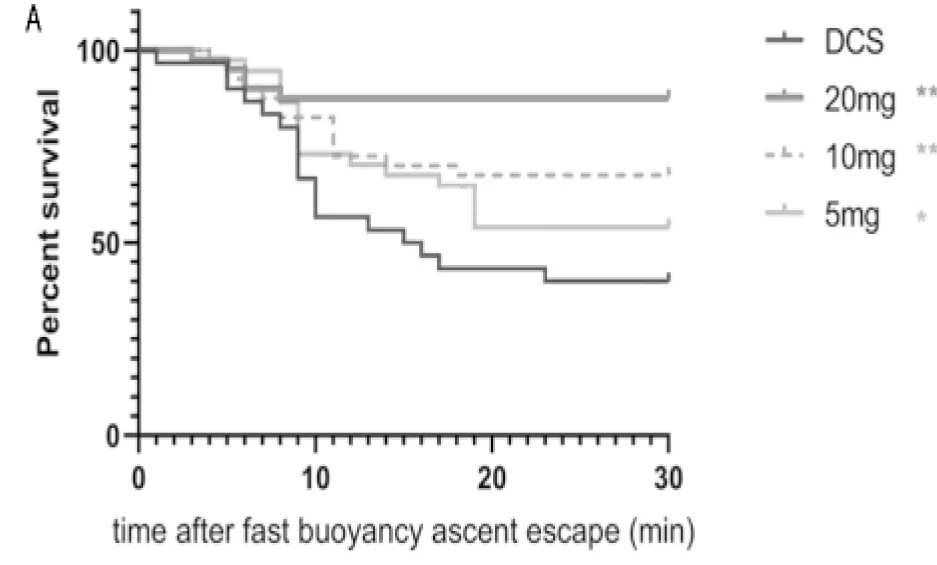
图2 5组大鼠出舱后30 min生存情况

常压对照组(HE×200) DCS组(HE×200) DCS组(HE×400)

菸花苷高剂量组(HE×200) 菸花苷中剂量组(HE×200) 菸花苷低剂量组(HE×400)

表3 5组大鼠肺湿干比和肺组织病理学评分
2.3 大鼠肺组织炎性因子水平和细胞黏附因子的含量变化 DCS组TNF-α、IL-1β、IL-6、ICAM-1水平高于常压对照组和菸花苷组,差异均有统计学意义(P<0.05)。菸花苷组TNF-α、IL-6、ICAM-1水平低于常压对照组,IL-1β高于常压对照组,差异均有统计学意义(P<0.05)。见表4。

表4 3组大鼠肺组织TNF-α、IL-1β、IL-6和ICAM-1含量 pg/ml,
2.4 大鼠肺组织炎性因子和细胞黏附因子的mRNA水平变化 与常压对照组相比,DCS组大鼠肺组织中TNF-α、IL-1β、IL-6、ICAM-1在mRNA水平的表达显著提高,菸花苷预防给药后,DCS大鼠肺组织中TNF-α、ICAM-1和IL-6的mRNA水平显著降低,IL-1的mRNA水平也表现出下降趋势。见表5。

表5 3组大鼠TNF-α、IL-1β、IL-6和ICAM-1 mRNA水平变化
3 讨论
DCS的发病原因是当气压快速降低时,溶解在机体内的惰性气体逸出形成气泡,存在于血液、脂肪和各组织器官中,尤其是在静脉系统中会产生大量气泡。气泡作为外源性物质,其介导的血小板激活凝集、白细胞活化、TNF-α等炎性因子释放、补体和黏附因子激活、细胞凋亡信号上调等,导致机体一系列免疫、炎性和凝血反应[10],对呼吸系统、循环系统和神经系统等造成损伤[11]。与常规潜水致DCS模型相比,快速上浮脱险致DCS模型由于机体在高压环境下暴露时间较短,气泡主要集中在静脉血液中,可随血液流动,并可通过吸收不断溢出的惰性气体或气泡间相互融合而扩大,随循环系统经下腔静脉到达右心房、右心室、肺动脉进入肺组织,最后经肺泡气体交换排出体外。因此,快速上浮脱险致DCS模型神经系统损伤较小[12],机体损伤主要涉及循环系统和呼吸系统。在排出气泡的过程中,大量的气泡对肺泡、肺动脉造成直接机械刺激,肺是快速上浮脱险致DCS的主要靶器官[9]。当减压病发生时,不安全减压在体内产生的大量气泡,对肺泡、血管内皮细胞等组织可以造成直接的机械系损伤,增加血管通透性,并激活炎性反应系统,促进大量前炎性因子(TNF-α、IL-1β、IL-6等)释放[13]。正常情况下,ICAM-1在内皮细胞表明表达量较低,由于TNF-α的刺激,激活肺内皮细胞、上皮细胞等细胞的NF-κB通路,上调ICAM-1的表达[14],血管内皮细胞表面的ICAM-1水平可出现明显增高。ICAM-1与白细胞表面的LFA-1受体相结合,介导白细胞与内皮细胞的黏附作用,释放炎性介质,引起组织水肿,加重肺组织损伤[15]。由此可推断,气泡导致的严重炎性反应在重症DCS发病过程中,尤其是对加重肺损伤起到了重要作用[16]。因此,急性肺损伤导致大鼠呼吸异常、缺氧、窒息可能是快速上浮脱险致DCS大鼠死亡的主要原因。
红花是我国传统中药,具有活血化瘀、活络通经等功效。现代药理研究表明,红花具有优秀的抗炎作用,对肺部炎性反应可以产生抑制作用[17]。以往研究发现,红花和以红花为主要成分的中药、中成药对减压病有着一定的防治作用,可以改善脊髓型DCS严重程度[18],减轻DCS肺损伤[19]。菸花苷是红花中的重要单体活性成分之一,具有抗炎、镇痛、抗氧化损伤、保护神经、抗缺血性脑卒中等作用[20,21],可以通过增强内皮细胞内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)活性,上调eNOS的mRNA和蛋白表达,改善缺血缺氧导致的内皮细胞损伤[22]。
在本项结果表明菸花苷在减轻大鼠肺组织炎性反应的同时具有改善了肺组织内皮细胞损伤,这也说明损伤在短时间内(<30 min)已经引起了肺组织细胞mRNA水平的变化。因此,DCS大鼠早期肺损伤可能并非单纯因为气泡对于肺组织的机械作用损伤,炎性因子的大量释放和内皮细胞功能的下降,也是肺组织损伤的重要因素。结合前期研究结果[2],可以推断,出舱后的短期内大鼠行动障碍、抽搐痉厥等症状,不是单纯的神经系统损伤所造成,更可能是肺组织损伤引起的急性缺氧所导致。菸花苷对减压病的预防作用,主要是菸花苷对于通过抑制炎性反应,减轻内皮细胞损伤对肺组织起到保护作用。但是,菸花苷对于肺组织内皮细胞的保护作用,是通过减轻炎性反应或是增加内皮细胞eNOS的活性和表达等其他途径实现,尚不明确。
综上所述,菸花苷可以对快速上浮脱险致DCS的大鼠具有预防作用,可以降低大鼠肺组织炎性因子水平,减轻内皮细胞损伤,对DCS大鼠肺组织起到保护作用,可以作为一种具有应用前景的DCS预防药物做进一步研究。

