丙泊酚调控cAMP/PKA-CREB-BDNF通路对大鼠神经元凋亡、坐骨神经阻滞效果的影响
吴帮林 朱荣誉 吴述轩 朱贤林
临床中的全身麻醉以及于超声引导下的区域神经阻滞进行结合,能够有效对手术中的麻醉药物使用剂量进行降低,以此来减少因麻醉使用过多而产生的不良反应[1]。而局部麻醉对于区域神经阻滞中产生的作用相对较短,并且使用较高剂量极易发生神经毒性[2]。而中枢神经系统内的神经元凋亡过程与手术、麻醉等过程具有紧密关联,其中麻醉药物能够对神经元凋亡产生影响[3]。丙泊酚为临床广泛使用的全麻药物,属于静脉麻醉注射的一种[4]。对于神经元凋亡均有相关报道[5]。因此,本研究分析丙泊酚调控cAMP/PKA-CREB-BDNF通路对大鼠神经元凋亡、坐骨神经阻滞效果的影响,为丙泊酚在麻醉手术中的应用提供重要参考。
1 材料与方法
1.1 材料
1.1.1 研究动物:选取40只SPF级Wistar雄性大鼠,体重213~260 g,平均体重(236.50±19.97) g,由山西省疾病预防控制中心提供,动物许可证:SYXK(晋)2020-0005。实验动物处置严格遵守实验动物管理与保护的有关规定,饲养环境恒温(21.14±2.06)℃,相对湿度15%左右,摄食及饮水保持自由状态,连续12 h的循环光照,维持基础状态。本试验操作均参照动物试验伦理要求的相关规定。
1.1.2 主要试剂:丙泊酚(上海源叶生物科技有限公司);SOD检测试剂盒(北京伊塔生物科技有限公司);MDA检测试剂盒(武汉益普生物科技有限公司);HE染色试剂(北京博尔西科技有限公司);cAMP、PKA(深圳市健竹科技有限公司);CREB、BDNF(天津本生健康科技有限公司);GAPDH(北京义翘神州科技股份有限公司);Annexin V-FITC/PI 细胞凋亡检测试剂盒(上海翌圣生物科技股份有限公司)。
1.1.3 主要仪器:智能热板测痛仪(上海软隆科技发展有限公司);光学显微镜(上海光学仪器一厂;型号:9J-PC)。
1.2 分组与建模 选取40只健康SD大鼠,随机分为空白组、假手术组、低剂量组、高剂量组,每组10只,均禁食、禁水12 h,空白组不予任何处理,另外3组按照文献[6]构建大鼠坐骨神经阻滞模型。3%戊巴比妥麻醉,大鼠仰卧位固定,于股骨偏下0.5 cm处切开皮肤,钝性分离各层肌肉组织,暴露股二头肌,充分将坐骨神经暴露。假手术组只行0.9%氯化钠溶液 10 ml/kg注射。低剂量组注射丙泊酚10 mg/kg,高剂量组注射丙泊酚30 mg/kg。注射完毕后逐层缝合,抗生素消毒伤口,操作过程约10 min。术毕放入饲养笼,分别于大鼠复位反射恢复后按时间点进行指标观察。
1.3 观察指标
1.3.1 免疫组化染色:取海马体神经组织1 cm石蜡包埋切片,厚度为3 μm。脱蜡后用纯净水洗涤,于PBS缓冲液中95℃微波修复10 min。标本中的内源性过氧化物酶用过氧化物酶封闭液予以封闭,分别滴加抗神经元细胞及一抗200 μl,室温孵育2 h。加入二抗,室温反应30 min,DAB显色,常规脱水透明,封片。由我院3名病理科相关高资历医师通过双盲法以电子显微镜(青岛菲优特检测有限公司,型号:JEM-2100)×400下随机选取3个视野观察神经元凋亡情况。
1.3.2 SOD、MDA水平检测:①取4组大鼠冷冻血清,解冻后,采用黄嘌呤氧化酶法测定SOD水平,通过取用聚苯乙烯试管,将其分为测量管、对照管。在上清中加入多于上清10倍的蒸馏水,进行稀释。加入1.0 ml试剂及50 μl样品至测量管,再加50 μl的蒸馏水至对照管,摇匀,恒温水浴箱30 min保存。显色:在两管内分别加入2 ml显色剂,室温放置10 min。比色应在波长550 nm,1 cm光径条件下,计算SOD水平。②硫代巴比妥酸法测定MDA水平。4个聚苯乙烯试管分别进行标准、标准空白、测量及测量空白管分类,随后将10 nmol/L四乙氧基丙烷以及试剂盒试剂加入至标准管内,将0.2 ml无水乙醇以及试剂盒试剂加入至标准空白管内,将0.1 ml肌肉组织匀浆以及试剂盒试剂分别加入试管,摇匀。接着将3 ml的硫代巴比妥酸加入至标准管、标准空白管、测量管3管内,再加入1 ml双蒸水,而测量空白管内加入将3 ml硫代巴比妥酸以及1 ml的50%冰醋酸。随后摇匀,后使用保鲜膜将其管口进行包裹、扎紧。随后将4管置于85℃进行水浴40 min。后用冷水进行冷却,并离心10 min,使用蒸馏水凋零分光光度,计算MDA水平。
1.3.3 海马神经元凋亡率:将胰蛋白酶-EDTA处理液消化细胞加入至流式细胞仪中,1 500 r/min的速度离心5 min,收集细胞;再用PBS缓冲液洗涤2次,1 500 r/min的离心5 min后行细胞收集。其次将PBS缓冲液吸去,加入110 μl的Bingding Buffer缓冲液对细胞进行重悬。接着将 Annexin V-FITC及PI Staining Solution试剂盒溶液加入5 μl和10 μl,后摇匀,于37℃的避光室温中反应15 min,后加入Bingding Buffer缓冲液350 μl,摇匀,检测海马神经元凋亡率。
1.3.4 各时间点MPE、EPT测量:①MPE测量:采用智能热板测痛仪于大鼠阻滞后的10、20、30、60、120、180、240、300、360 min时间段内,对大鼠右后肢进行热踏板试验,热踏板温度为55℃,依照从走至右的先后顺序来对后足热刺激缩足反应潜伏期(paw withdrawal thermal latency,PWTL)进行测定,一后肢进行重复3次的测定,每次之间间隔5 min进行下一次测定,然后其平均值。将监测时间设置为10 s,以此避免对其组织造成损伤。如超过10 s后,大鼠仍未出现缩足反应,则需将刺激进行停止,将其时间记为10 s,来计算MPE,以此来对阻滞程度进行反应。MPE(%)=[(给药后PWTL-基础PWTL)/(10-基础PWTL)]×100%。②EPT测量:将大鼠保持直立状态进行上提,使其后肢处于伸展状态,并让远端足来支撑体重,随机放置于电子秤上方位置,大鼠后肢在进行伸展后所显示出的数值就是EPT值。
1.3.5 cAMP/PKA-CREB-BDNF通路蛋白表达量:Western blot检测对大鼠肺组织中的cAMP/PKA-CREB-BDNF蛋白相对表达量,取4组大鼠冷冻肺组织,冰上溶解25 min,制作组织匀浆,离心处理,BCA试剂盒对cAMP/PKA-CREB-BDNF蛋白含量进行检测,提取等量蛋白质,100℃中变性5 min,采用凝胶电泳进行分离,加入一抗,4℃下孵育过夜,漂洗,15 min/次,3次,加二抗,孵育110 min,漂洗,13 min/次,3次,以GAPDH为内参,定量分析蛋白表达情况。试验重复3次。
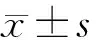
2 结果
2.1 4组神经元SOD活性及MDA含量比较 与空白组相比,假手术、低剂量组、高剂量组SOD活性降低,MDA含量升高,差异有统计学意义(P<0.05);与假手术组相比,低剂量组、高剂量组SOD活性升高,MDA含量降低,差异有统计学意义(P<0.05);与低剂量组相比,高剂量组SOD活性升高,MDA含量降低,差异有统计学意义(P<0.05)。见表1。

表1 4组神经元SOD活性及MDA含量比较 n=10,
2.2 4组海马神经元凋亡率对比 与空白组相比,假手术、低剂量组、高剂量组海马神经元凋亡率升高,差异有统计学意义(P<0.05);与假手术组相比,低剂量组、高剂量组海马神经元凋亡率降低,差异有统计学意义(P<0.05);与低剂量组相比,高剂量组海马神经元凋亡率降低(P<0.05)。见表2,图1。
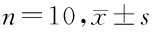
表2 4组海马神经元凋亡率比较

图1 神经元凋亡比较(HE染色×200)
2.3 4组大鼠各时间点MPE比较 与空白组相比,阻滞后假手术、低剂量组、高剂量组各时间点MPE均升高,差异有统计学意义(P<0.05);与假手术组相比,低剂量组、高剂量组各时间点MPE均升高(P<0.05);与低剂量组相比,高剂量组各时间点MPE均升高,差异有统计学意义(P<0.05)。见表3。
2.4 4组大鼠各时间点EPT比较 与空白组相比,其余3组各时间点MPE均升高,差异有统计学意义(P<0.05);与假手术组相比,低剂量组、高剂量组10、20、30、60、90、120 min时间点EPT均升高;150、180 min时间点EPT均降低(P<0.05);与低剂量组相比,高剂量组10、20、30、60、90、120 min时间点EPT均降低,差异有统计学意义(P<0.05)。150、180 min时间点EPT均升高,差异无统计学意义(P>0.05)。见表4。
2.5 4组大鼠cAMP/PKA-CREB-BDNF信号通路分析 与空白组相比,假手术、低剂量组、高剂量组cAMP、PKA、CREB、BDNF表达均降低,差异有统计学意义(P<0.05);与假手术组相比,低剂量组、高剂量组cAMP、PKA、CREB、BDNF表达均降低,差异有统计学意义(P<0.05);与低剂量组相比,高剂量组cAMP、PKA、CREB、BDNF表达均降低,差异有统计学意义(P<0.05)。见表5,图2。

表3 4组大鼠各时间点MPE比较 n=10,
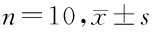
表4 4组大鼠各时间点EPT比较

表5 4组大鼠cAMP/PKA-CREB-BDNF信号通路分析 n=10,

图2 cAMP/PKA-CREB-BDNF信号通路蛋白Western blot图
3 讨论
丙泊酚作为一种新型麻醉药物,在临床手术中得到广泛应用[7]。研究证实,丙泊酚在对于颅脑损伤等患者中,自身具有较为可靠且安全的麻醉效果,并且在进行输注后,能够被机体进行快速吸收,并且进行持续性的输注也不会产生蓄积情况,苏醒完全[8]。但也有研究指出,丙泊酚可能会导致患者长是其学习、行为以及记忆等功能出现异常情况,以此造成患者中枢神经出现一定损伤,使其脑损伤情况出现[9]。
SOD为抗氧化酶,MDA为脂质氧化产物,对过量氧自由基进行清除,保护神经元,二者能够指示氧化应激反应[10,11]。本研究结果提示,丙泊酚能够提升海马神经元的抗氧化能力,而高剂量的丙泊酚能够更好的进行提升[12]。相关研究指出,在心肌缺血再灌注大鼠中,其丙泊酚的使用能够对大鼠心肌细胞产生保护作用,并且还能显著提升SOD活性,降低MDA含量,从而显著清楚氧自由基[13]。该研究与本文研究保持一致,表明使用丙泊酚能够对海马体神经元的抗氧化能力进行显著提升,提升氧化应激反应,保护神经元。
本研究结果显示,高剂量30 mg/kg的丙泊酚能够发挥出抗神经元凋亡的最佳作用,由此得出,高剂量的丙泊酚能够抑制海马神经元凋亡情况,从而对神经元起到保护作用[14]。研究证实,丙泊酚能够对海马神经元产生一定的保护作用,对于持续性的癫痫大鼠具有显著的治疗功效,并且减弱机体内相关细胞的凋亡,对细胞自噬产生缓解作用[15]。该研究与本文研究保持一致。
cAMP自身浓度的改变会对多种信号通路产生直接影响,从而对基因和蛋白的表达进行调控,并且能够直接对PKA蛋白产生影响,并对阻滞效果产生影响[16]。本研究结果显示,相比于空白组、假手术组和低剂量组,高剂量组各时间点MPE均升高;而10、20、30、60、90、120 min时间点EPT均降低,由此说明,在进行丙泊酚麻醉后,高剂量组成功对坐骨神经的传导功能进行阻断。而在神经元间进行信息交流过程中,其突出为其交流的结构基础,而PKA能够对下游CREB蛋白进行磷酸化,并且PKA介导的信号通路与突出的形成、信号传递起到关键作用,起到调节神经的作用[17]。而活化后的CREB能够对下游BNDF蛋白表达情况进行调控,从而对神经元存活及分化程度进行维持和促进,对神经进行保护[18]。本研究结果显示,与空白组相比,假手术组、低、高剂量组cAMP、PKA、CREB、BDNF表达均降低,与假手术组相比,低、高剂量组cAMP、PKA、CREB、BDNF表达均降低,与低剂量组相比,高剂量组cAMP、PKA、CREB、BDNF表达均降低。相关研究证实,cAMP/PKA-CREB-BDNF信号通路参与多种脑部损伤中对神经元产生保护作用的调控[19]。还有研究证实,丙泊酚能够对BDNF蛋白的表达进行降低,从而改善神经病理性疼痛以及神经元损伤,从而降低神经元凋亡,提升阻滞效果[20],这与本研究结果一致。表明丙泊酚能够加速对cAMP/PKA-CREB-BDNF信号通路的抑制,提示cAMP/PKA-CREB-BDNF信号通路可能参与丙泊酚延长阻滞效果的机制。
综上所述,丙泊酚能够对海马神经元产生一定保护作用,降低神经元凋亡率,减轻对神经的损伤程度。并且还能够对大鼠坐骨神经组织效果进行延长,该保护作用以及组织效果延长情况可能与丙泊酚调控cAMP/PKA-CREB-BDNF信号通路有关。

