MiR-27a靶向调节PPARγ/SIRT1/NF-κB信号通路对溃疡性结肠炎幼年小鼠肠道损伤的影响
岳万勇 农国旺 潘光泽 田文梅 张学亮 陈光健 张飞 喻国丹
炎症性肠病(inflammatory bowel disease,IBD)是一种慢性非特异性肠道炎症性疾病,如溃疡性结肠炎(ulcerative colitis,UC)或克罗恩病。其中,与成人患者相比,UC儿科患者的疾病范围、严重程度和进展情况明显更大、更广[1,2]。尽管目前针对成人UC的外科治疗已经得到充分的研究,但并不完全适用于儿童[3]。因此,为了治愈儿童UC,探究其发病机制至关重要。miRN通过与目标mRNA中的互补序列配对并干扰其稳定性和翻译来调节基因表达,在包括UC在内的多种自身免疫性疾病的发病机制中发挥重要作用[4]。据报道,miR-27a在肿瘤的发生发展中具有重要作用,是一种新型的生物标志物和潜在的肿瘤治疗靶点[5]。此外,有研究证实,miR-27a参与UC的发生发展[6]。然而,对于miR-27a在UC中的调控、作用和靶点的理解仍然有限。在本研究中,假设miR-27a在肠道炎症中具有重要作用,使用2,4,6-三硝基苯磺酸(2,4,6- trinitro picrylsulfonic acid,TNBS)诱导实验小鼠UC模型[7]。本研究探索miR-27a在TNBS诱导的UC中的作用,并研究miR-27介导的肠道炎症的潜在机制,为从实验室到临床识别和治疗UC提供证据。
1 材料与方法
1.1 材料 (1)小鼠:SPF级幼年雄性C57BL/6小鼠(4周龄,16~20g)购自昆明医科大学,许可证号:SCXK(滇)K2020-0006。本研究符合《实验动物护理和使用指南》。所有涉及动物的实验程序均经昆明医科大学伦理委员会批准。(2)主要试剂:TNBS由Sigma-Aldrich提供,货号:P2297;苏木精-伊红染色试剂盒由武汉赛维尔提供,货号:G1001-500;TUNEL FITC凋亡检测试剂盒(绿色荧光)由碧云天提供,货号:C1098;TRIzol试剂由美国Invitrogen提供,货号:15596-026;髓过氧化物酶(Myeloperoxidase,MPO)活性检测试剂盒由Abcam提供,货号:ab155458;Reverse Transcription试剂盒由vazyme提供,货号:R323-02;SYBR Green PCR Master Mix由vazyme提供,货号:Q511-03;肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白介素1β(interleukin-1β,IL-1β)、细胞间黏附分子1(Intercellular Adhesion Moleclar-1,ICAM-1)和单核细胞趋化蛋白1(monocyte chemotactic protein-1,MCP-1)ELISA试剂盒由Abcam提供,货号:ab46105、ab197742、ab252355、ab208979;PPARγ、SIRT1、NF-κB p65(acetyl K310)和β-actin一抗由英国Abcam提供,货号依次为:ab207297、ab272718、ab189494、ab19870;RIPA裂解缓冲液裂由BOSTER提供,货号:AR0102-100;BCA蛋白浓度测定试剂盒由博士德生物提供,货号:AR0197;ECL化学发光检测试剂盒由新赛美生物提供,货号:P10300;Dual-Glo Luciferase Assay System由美国Promega提供,货号:E2920。(3)主要仪器:ELX-800酶标仪由美国BIOTEK提供;DP73光学显微镜由日本LLYMPUS提供;ABI 7500 Fasts实时荧光定量PCR系统由杭州博日科技有限公司提供;GelDoc Go凝胶成像系统由上海天能提供。
1.2 方法
1.2.1 TBST诱导UC动物模型的建立及分组处理:小鼠经适应性喂养1周,处理前首先禁食18 h。随后,将小鼠分为4组(每组10只):假手术对照(Control)组、模型(Model)组、miR-27a抑制剂阴性对照(miR-NC antagomir)组和miR-27a抑制剂(miR-27a antagomir)组。小鼠均使用10%水合氯醛进行腹膜内麻醉,并将由凡士林润滑的硅胶管(直径2 mm)通过肛门插入结肠(约8 cm)。除Control组外的其他3组小鼠注射TNBS溶液(3 mg/kg,含50%乙醇)[7],灌肠后,慢慢拔出硅胶管,用棉签堵住小鼠肛门,将尾部提起,直至自然苏醒;Control组注射等体积的0.9%氯化钠溶液。随后,miR-NC antagomir组和miR-27a antagomir组小鼠分别尾静脉注射miR-NC antagomir、miR-27a antagomir(200 nmol/d),Control组和Model组尾部静脉注射等量的0.9%氯化钠溶液,连续3 d。然后,将各组小鼠10%水合氯醛麻醉处死,收集结肠组织和血液用于进一步的实验研究。
1.2.2 结肠组织学染色与评分:结肠组织经10%甲醛固定、石蜡包埋后,制备为4 μm切片。将切片在二甲苯中脱蜡,并在梯度浓度的乙醇中水化。使用苏木精染色5 min后进入1%酸性乙醇(70%乙醇中添加1% HCl)中3 s,后添加伊红染色3 min。使用梯度乙醇脱水,并在二甲苯中透明。经光学显微镜拍照观察。根据以下标准对结肠组织学损伤进行评分[8]:0分,黏膜、黏膜下层、固有肌层、浆膜结构正常,无炎性细胞;1分,黏膜和黏膜下层有炎性细胞;2分,透壁急性炎症;3分,小溃疡,透壁急性炎症;4分,多处大溃疡和透壁炎症;5分,广泛溃疡、部分坏死和硬膜内炎症。
1.2.3 TUNEL染色检测结肠组织中细胞凋亡:将结肠组织切片在二甲苯中脱蜡,并在梯度浓度的酒精中水化后使用20 μg/ml蛋白酶K室温下孵育15~30 min,后添加50 μl TUNEL溶液在37℃下避光孵育1 h。使用PBS漂洗后添加DAPI染核,再次漂洗,添加一滴防褪色固化剂孵育5 min,通过荧光显微镜观察并拍照。细胞凋亡率(%)=TUNEL阳性细胞数量/DAPI阳性细胞数量×100%。
1.2.4 结肠组织中MPO活性检测:首先使用预冷的裂解缓冲液裂解结肠组织,离心20 min(1 000 r/min),之后按照严格遵循试剂盒说明书检测。
1.2.5 ELISA检测血清中炎性因子含量:将收集到的血液,室温静置凝固后离心收集血清,根据ELISA试剂盒方法检测TNF-α、IL-1β、ICAM-1和MCP-1含量。
1.2.6 qRT-PCR检测结肠组织中miR-27a表达:使用TRIzol试剂从结肠组织中提取总RNA,并使用反转录试剂盒合成cDNA。接着使用SYBR Green PCR Master Mix和实时荧光定量PCR系统进行qRT-PCR测定。U6作为内部对照。通过2-ΔΔCT(ΔCTsample-ΔCTcontrol)来评估miR-27a的相对表达水平。本研究使用的引物序列如下:miR-27a:5’-TGCGCTTCACAGTGGCTAAGT-3’(正向),5’-CCAGTGCAGGGTCCGAGGTATT-3’(反向);U6:5’-CGCTTCGGCAGCACATATAC-3’(正向),5’-AAATATGGAAACGCTTCACGA-3’(反向)。
1.2.7 蛋白质印迹测定结肠组织中PPARγ/SIRT1/NF-κB信号通路相关蛋白表达:使用含PMSF蛋白酶体抑制剂的RIPA裂解缓冲液裂解结肠组织,低温离心后收集上清液作为完整蛋白质。蛋白质样品的浓度按照BCA蛋白浓度测定试剂盒说明书测定。每个样品中20 μg蛋白质通过12% SDS-PAGE电泳分离并转移到PVDF膜上,使用5%牛血清白蛋白封闭1 h,然后使用TBST洗涤膜。并在4℃下用以下一抗孵育过夜:PPARγ、SIRT1、NF-κB p65和β-actin(内参)。然后将膜与HRP标记的二抗室温孵育1 h。使用TBST洗涤膜后添加ECL显影液对蛋白质条带显影。使用凝胶成像系统和Image J软件对蛋白印迹进行分析,计算。目的蛋白相对表达水平=目的蛋白灰度值/内参蛋白的灰度值。
1.2.8 双荧光素酶报告基因实验检测miR-27a和PPARγ靶向关系:Starbase网站(https://starbase.sysu.edu.cn)预测了PPARγ的3’-UTR含有miR-27a的假定结合位点。将PPARγ 3’-UTR的野生型或突变型质粒插入到pmirGLO质粒中,构建WT-PPARγ和MUT-PPARγ质粒。将miR-NC mimics或miR-27a mimics与WT-PPARγ或MUT-PPARγ瞬时共转染到293T细胞中,转染48 h后收集细胞,用于荧光素酶报告基因检测。荧光素酶活性=萤火虫荧光值/海肾荧光值。
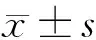
2 结果
2.1 4组小鼠结肠组织学损伤情况 (1)Control组小鼠结肠黏膜光滑完整,无炎性细胞浸润和溃疡,上皮细胞排列整齐;Model组和miR-NC antagomir组小鼠结肠黏膜溃疡和糜烂,大量炎性细胞浸润,上皮细胞排列混乱且部分损坏、脱落;miR-27a antagomir处理后小鼠结肠黏膜溃疡和糜烂减轻,炎性细胞浸润减少,上皮细胞排列较整齐且脱落减少。(2)对结肠组织微观损伤进行评分,结果显示:与Control组相比,Model组评分明显升高(P<0.05);与miR-NC antagomir组相比,miR-27a antagomir组评分明显降低(P<0.05);miR-NC antagomir组和Model组评分变化比较,差异无统计学意义(P>0.05)。见图1,表1。

图1 4组小鼠结肠组织学损伤(苏木精-伊红染色×200)

表1 4组小鼠结肠炎评分 n=10,分,
2.2 4组小鼠结肠组织细胞凋亡情况 与Control组相比,Model组小鼠结肠组织中细胞凋亡率明显增高,差异有统计学意义(P<0.05);与miR-NC antagomir组相比,miR-27a antagomir组小鼠结肠组织中细胞凋亡率明显降低,差异有统计学意义(P<0.05);miR-NC antagomir组和Model组细胞凋亡率变化比较,差异无统计学意义(P>0.05)。见图2,表2。

图2 4组小鼠结肠组织中细胞凋亡情况(TUNEL染色×200)

表2 4组小鼠结肠组织中细胞凋亡率 n=10,%,
2.3 4组小鼠结肠组织中MPO活性 与Control组相比,Model组小鼠结肠组织中MPO活性明显增高(P<0.05);与miR-NC antagomir组相比,miR-27a antagomir组小鼠结肠组织中MPO活性明显降低(P<0.05);miR-NC antagomir组和Model组MPO活性变化比较,差异无统计学意义(P>0.05)。见表3。
2.4 4组小鼠血清中炎性因子含量 与Control组相

表3 4组小鼠结肠组织中MPO活性 n=10,pg/mg tissue,
比,Model组小鼠血清中TNF-α、IL-1β、ICAM-1和MCP-1含量明显增高(P<0.05);与miR-NC antagomir组相比,miR-27a antagomir组小鼠血清中TNF-α、IL-1β、ICAM-1和MCP-1含量明显降低(P<0.05);miR-NC antagomir组和Model组以上炎性因子含量变化无统计学意义(P>0.05)。见表4。

表4 4组小鼠血清中TNF-α、IL-1β、ICAM-1和MCP-1含量 n=10,pg/ml,
2.5 4组小鼠结肠组织中miR-27a和PPARγ/SIRT1/NF-κB通路相关蛋白表达水平 与Control组相比,Model组小鼠结肠组织中miR-27a表达水平和乙酰化NF-κB p65蛋白水平明显增高(P<0.05),PPARγ和SIRT1蛋白水平明显降低(P<0.05);与miR-NC antagomir组相比,miR-27a antagomir组小鼠结肠组织中miR-27a表达水平和乙酰化NF-κB p65蛋白水平显著降低(P<0.05),PPARγ和SIRT1蛋白水平明显增高(P<0.05);miR-NC antagomir组和Model组以上指标变化差异无统计学意义(P>0.05)。见图3,表5。

图3 Western blot检测4组小鼠结肠组织中PPARγ、SIRT1和NF-κB p65蛋白水平

表5 4组小鼠结肠组织中miR-27a、PPARγ、SIRT1和NF-κB p65表达水平 n=10,
2.6 双荧光素酶分析miR-27a与PPARγ靶向关系 经生物信息学分析,PPARγ和miR-27a可能的结合位点如图所示。应用双荧光素酶报告基因检测以确认miR-27a和PPARγ的3’-UTR之间的结合位点,结果表明,与miR-NC mimics组相比较,miR-27a mimics组转染WT-PPARγ细胞中荧光素酶活性显著降低,差异有统计学意义(P<0.05),而转染MUT-PPARγ细胞中荧光素酶活性变化比较差异无统计学意义(P>0.05)。见图4,表6。

图4 PPARγ和miR-27a结合位点图

表6 双荧光素酶报告基因检测共转染293T细胞中的荧光素酶活性n=3,
3 讨论
MPO是一种溶酶体蛋白,主要在中性粒细胞中表达,其活性是中性粒细胞浸润和急性炎症的重要生物标志物之一[9]。本研究结果表明,TNBS诱导后小鼠结肠炎评分和MPO活性显著上调,小鼠结肠组织有明显的溃疡和糜烂,且大量炎性细胞浸润,表明TNBS诱导的UC小鼠模型成功建立。同时,本研究结果证明,在TNBS诱导的UC小鼠中,结肠组织中miR-27a的表达被显著上调。而以往研究显示,miR-27a在硫酸葡聚糖钠诱导的小鼠UC模型中显著下调[10],与本研究结果不同,这可能是因为miR-27a在不同UC模型构建方法或不同周期的小鼠中的作用机制不同。
炎性分子被认为是通过影响肠道通透性和细菌易位参与UC进展的重要因素。TNF-α触发结肠上皮细胞中其他炎性细胞因子和黏附分子表达;IL-1β通过作用于终末细胞、巨噬细胞和中性粒细胞来调节免疫和非免疫细胞的功能,其水平与UC的疾病严重程度呈正相关[11];另外,ICAM-1和MCP-1等炎性细胞因子被视为结肠炎炎症的生物标志物[12,13]。本研究结果表明,表明miR-27a抑制肠黏膜炎症。此外,本研究还发现,TNBS诱导后,小鼠结肠组织中细胞凋亡率升高,而抑制miR-27a表达可降低细胞凋亡率。据以往研究发现,适应性的升高细胞凋亡水平可在一定程度上清除堆积的炎性因子[14]。结合本研究结果,推测抑制miR-27a表达减轻了炎性反应,而凋亡反应下调可能是为了适应炎性反应的程度,此结果也间接证实了miR-27a对炎症的调节作用。
据报道,PPARγ/SIRT1/NF-κB信号通路参与治疗硫酸葡聚糖钠诱导的小鼠UC过程[15]。PPARγ是过氧化物酶体增殖物激活受体的一员,在UC患者结肠上皮中的表达低于对照,且可显著抑制巨噬细胞的激活和TNF-α、IL-1β在内的多个炎性因子的产生[16]。SIRT1作为长寿蛋白SIR2的哺乳动物同源物,在UC小鼠结肠组织中可通过在赖氨酸310处脱乙酰化RelA/p65来调节细胞功能,从而减少NF-κB活化,从而减少促炎细胞因子的产生[17]。本研究结果显示,TNBS诱导后,小鼠结肠组织中PPARγ和SIRT1蛋白水平降低,乙酰化NF-κB p65蛋白水平增高,而抑制miR-27a表达可明显逆转TNBS诱导对PPARγ、SIRT1、NF-κB表达的影响。另外,生物信息学分析显示,miR-27a靶向调节PPARγ/SIRT1/NF-κB信号通路参与调控TNBS诱导的UC小鼠肠道损伤过程。
综上所述,miR-27a靶向调控PPARγ/SIRT1/NF-κB信号通路在UC发病过程中的炎症调节中发挥重要作用。抑制miR-27a表达可以减轻TNBS诱导的UC小鼠肠道损伤并抑制炎性因子的表达。

