环状RNA circLRP6介导的miR-5590-5p改善肝衰竭机制研究
陈 玲 李 楠 杨建乐
肝衰竭是由诸多因素引起的肝细胞广泛性坏死,以黄疸、凝血功能障碍为主要表现的一组临床综合征[1]。肝衰竭常伴有肝外器官衰竭,28天病死率为50%~90%[2]。目前,对于肝衰竭患者,往往采用保守支持治疗手段来缓解症状并保护肝功能。肝移植可能是其他治疗手段效果不佳时的唯一治疗方法[3]。而调控miRNA表达能够有效减轻肝细胞损伤进而改善肝衰竭[4]。因此,寻找miRNA作为肝衰竭新的治疗靶点具有重要意义。
本研究发现,改变miR-5590-5p的表达水平能够调控D-半乳糖胺和脂多糖(D-galactosamine and LPS,D-GalN/LPS)诱导的细胞损伤。本研究进一步通过流式细胞术、实时定量PCR、Western blot法、双荧光素酶报告基因实验和RNA免疫共沉淀等检测手段深入探究miR-5590-5p在肝衰竭中的调控机制,为肝衰竭患者提供新的治疗靶点。
材料与方法
1.实验材料:L02细胞(人正常肝细胞系)购自中国科学院细胞库(上海);RPMI-1640培养基、胎牛血清购自美国Gibco公司;D-半乳糖胺(D-GalN)和脂多糖(LPS)购自美国Sigma公司;胰蛋白酶、裂解液、BCA蛋白浓度检测试剂盒、双荧光素酶报告基因实验检测试剂盒和Trizol试剂等均购自上海碧云天生物技术有限公司;pmirGLO载体购自美国Promega公司;miRNA-NC、miR-5590-5p模拟物、环状RNA circLRP6、sh-circLRP6、OE-C5aR1和慢病毒包装质粒来源于上海GenePharma公司;C5aR1、β-actin、Ago-2抗体和IgG抗体等购自美国Invitrogen公司;RNA免疫共沉淀试剂盒购自德国Merck KgaA公司;环状RNA反转录试剂盒(PrimeScriptTMRT Master Mix)购自北京索莱宝科技有限公司;miRNA反转录试剂盒和荧光定量PCR试剂盒购自生工生物工程(上海)股份有限公司。
2.细胞模型构建及药物干预分组:L02细胞在RPMI-1640培养基(含10%胎牛血清)中培养,并置于37℃、5% CO2的培养箱中培养。L02细胞在44μg/ml D-半乳糖胺(D-GalN)和100ng/ml脂多糖(LPS)中处理24h后获得肝衰竭细胞模型。对照组为正常培养的L02细胞;D-GalN/LPS组为D-GalN/LPS诱导的L02细胞。D-GalN/LPS+miRNA-NC组为慢病毒在D-GalN/LPS诱导的L02细胞中转染miRNA-NC质粒;D-GalN/LPS+miR-5590-5p模拟物组为慢病毒在D-GalN/LPS诱导的L02细胞中转染miR-5590-5p模拟物质粒。IgG组为阴性对照抗体组;Ago2组为Argonaute 2抗体组。D-GalN/LPS+shRNA组为慢病毒在D-GalN/LPS诱导的L02细胞中转染shRNA质粒;D-GalN/LPS+sh-circLRP6组为慢病毒在D-GalN/LPS诱导L02细胞中转染sh-circLRP6质粒;D-GalN/LPS+sh-circLRP6+OE-NC组为慢病毒在D-GalN/LPS诱导L02细胞中转染sh-circLRP6+OE-NC质粒;D-GalN/LPS+sh-circLRP6+OE-C5aR1组为慢病毒在D-GalN/LPS诱导L02细胞中转染sh-circLRP6+OE-C5aR1质粒。
3.流式细胞术检测:根据Annexin V-FITC/PI检测试剂盒使用说明,取L02细胞加入5μl Annexin V-/FITC避光反应20min后,再加入5μl PI避光反应20min,采用流式细胞仪检测染色细胞凋亡。
4.实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)检测:首先使用Trizol试剂收集L02细胞的总RNA,然后采用RNA反转录试剂盒(PrimeScript RT Master Mix)和miRNA反转录试剂盒分别合成cDNA,然后利用实时荧光定量PCR试剂盒进行RT-qPCR,分别以GAPDH和U6为内参,使用2-ΔΔCT法计算基因circLRP6和miR-5590-5p相对表达水平。引物交由生工生物工程(上海)股份有限公司合成。引物序列:circLRP6上游引物:5′-CACCAAAGGCACTTACTTCCCT-3′,下游引物:5′-AACTGATCAATTAAACAAAGCACTGT-3′;miR-5590-5p上游引物:5′-GCTGCGTTGCCATACATAGAC-3′,下游引物:5′-AGTGCAGGGTCCGAGGTATT-3′;GAPDH上游引物:5′-GCATCCTGGGCTACACTG-3′,下游引物:5′-TGGTCGTTGAGGGCAAT-3′;U6上游引物:5′-CGCTTCGGCAGCACATATACTAAAATTGGAAC-3′,下游引物:5′-GCTTCACGAATTTGCGTGTCATCCTTGC-3′。
5.Western blot法检测:L02细胞用RIPA裂解液提取总蛋白质,采用BCA试剂盒测定蛋白浓度,经凝胶电泳分离,然后转移至PDVF膜上,用5%脱脂牛奶封闭1h后与一抗(C5aR1,1∶1000,β-actin,1∶1000)在4℃反应过夜,后与二抗(IgG/HRP,1∶2000)反应1h,最后收集ECL显影的蛋白条带。
6.双荧光素酶报告基因实验检测:将C5aR1基因3′UTR序列(WT-C5aR1),C5aR1基因3′UTR序列的突变型(MT-C5aR1),野生型质粒circLRP6(WT-circLRP6)以及突变型质粒circLRP6(MT-circLRP6)克隆到基因载体pmirGLO中,构建野生型和突变型的双荧光素酶报告质粒载体。根据双荧光素酶报告基因实验检测试剂盒的使用方法检测L02细胞的miRNA-NC和miR-5590-5p模拟物对WT-C5aR1、MT-C5aR1以及WT-circLRP6和MT-circLRP6荧光素酶活性的影响,利用萤火虫荧光素酶活性与海肾荧光素酶活性的比值计算荧光素酶活性。
7.RNA免疫共沉淀检测:使用RNA免疫共沉淀试剂盒检测L02细胞中circLRP6、miR-5590-5p与Ago-2抗体的结合情况。用裂解缓冲液裂解L02细胞后离心30min,取上清液与Ago-2抗体和IgG抗体的磁珠一同孵育。然后,将他们在4℃下孵育4h后,用缓冲液洗涤3次后获得磁珠。最后,从磁珠中提取RNA利用RT-qPCR测定circLRP6和miR-5590-5p的相对表达水平。
8.统计学方法:实验所有数据均采用GraphPad Prism 9.0软件进行统计分析,两组间数据采用t检验且多组间数据采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1.构建体外细胞模型:本研究通过D-GalN/LPS诱导人肝细胞L02构建体外肝衰竭细胞模型。流式细胞仪检测细胞凋亡率,结果发现,D-GalN/LPS处理后,肝衰竭细胞模型L02细胞凋亡率显著上升,肝衰竭细胞模型构建成功(图1A)。此外,RT-qPCR检测发现,与对照组比较,D-GalN/LPS组circLRP6表达上调,而miR-5590-5p表达下调(图1B,P<0.05)。Western blot法检测表明,与对照组比较,D-GalN/LPS组的C5aR1蛋白表达上调(图1C)。
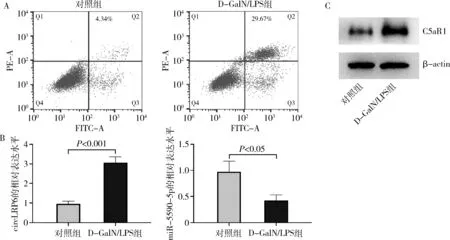
图1 构建体外细胞模型A.流式细胞仪检测L02细胞凋亡;B.RT-qPCR检测L02细胞中circLRP6和miR-5590-5p的表达;C.Western blot法检测L02细胞中C5aR1蛋白的表达
2.miR-5590-5p改善肝细胞损伤:RT-qPCR检测显示,与D-GalN/LPS+miRNA-NC组比较,D-GalN/LPS+miR-5590-5p模拟物组的miR-5590-5p表达水平显著升高(图2A,P<0.05)。同时,流式细胞仪检测L02细胞凋亡发现,与D-GalN/LPS+miRNA-NC组比较,D-GalN/LPS+miR-5590-5p模拟物组L02细胞凋亡率显著下降(图2B)。

图2 miR-5590-5p改善肝细胞损伤A.RT-qPCR检测miR-5590-5p的表达;B.流式细胞仪检测L02细胞凋亡
3.circLRP6直接结合miR-5590-5p:通过circBank数据库分析发现circLRP6与miR-5590-5p存在结合位点(图3A)。然后,本研究通过RNA免疫共沉淀实验发现,与IgG组比较,Ago2组的circLRP6和miR-5590-5p的表达水平显著升高(图3B)。此外,进一步双荧光素酶报告基因实验表明,与miRNA-NC组比较,miR-5590-5p模拟物组显著降低了WT-circLRP6荧光素酶活性,而MT-circLRP6荧光素酶活性不变(图3C),表明circLRP6可直接结合miR-5590-5p。
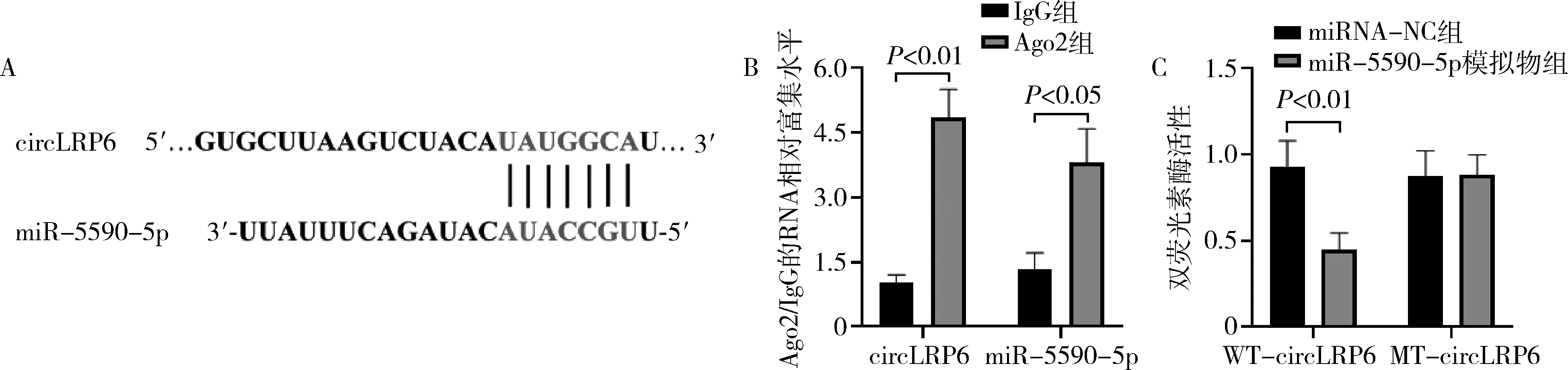
图3 circLRP6直接结合miR-5590-5pA.circLRP6和miR-5590-5p的结合位点;B.circLRP6和miR-5590-5p的表达水平;C.双荧光素酶报告基因实验检测WT-circLRP6和MT-circLRP6的荧光素酶活性
4.miR-5590-5p直接调控C5aR1:TargetScan数据库分析结果发现miR-5590-5p与C5aR1存在结合位点(图4A),同时,RT-qPCR检测显示,与miRNA-NC比较,miR-5590-5p模拟物组的miR-5590-5p表达升高而miR-5590-5p拮抗剂组的miR-5590-5p表达降低(图4B,P<0.05)。此外,双荧光素酶报告基因实验检测发现,与miRNA-NC比较,miR-5590-5p模拟物组显著降低了WT-C5aR1荧光素酶活性,而MT-C5aR1荧光素酶活性不变(图4C,P<0.01)。Western blot法检测发现,与miRNA-NC组比较,miR-5590-5p模拟物组的C5aR1蛋白表达降低而miR-5590-5p拮抗剂组的C5aR1蛋白表达升高(图4D)。
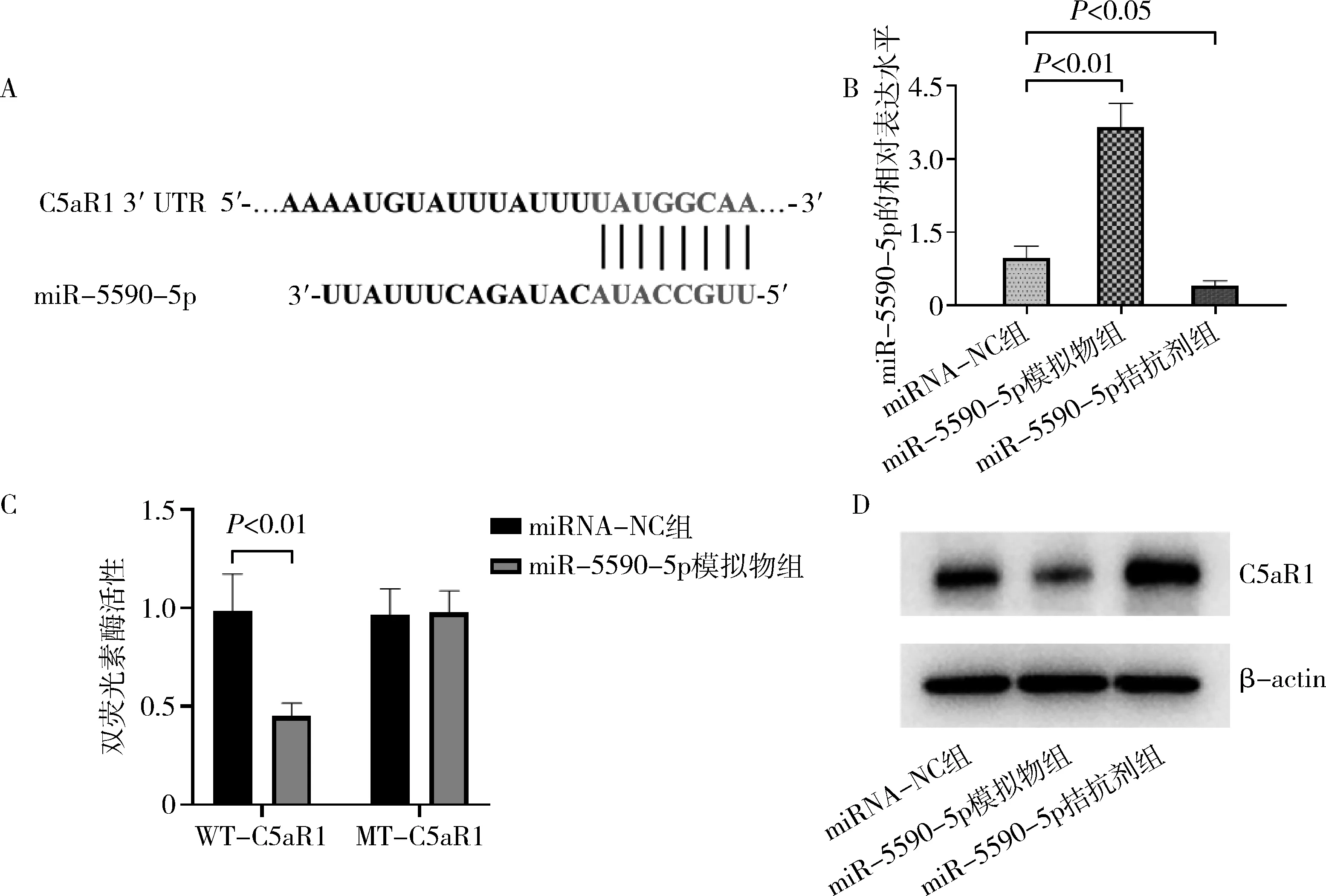
图4miR-5590-5p直接调控C5aR1A.C5aR1和miR-5590-5p的结合位点;B.RT-qPCR检测L02细胞中miR-5590-5p的表达;C.双荧光素酶报告基因实验检测WT-C5aR1和MT-C5aR1的荧光素酶活性;D.Western blot法检测L02细胞中C5aR1的蛋白表达
5.circLRP6介导miR-5590-5p靶向C5aR1改善肝细胞损伤:深入分析circLRP6、miR-5590-5p和C5aR1三者在D-GalN/LPS诱导L02细胞中的调控机制。RT-qPCR和Western blot法结果显示,与D-GalN/LPS+shRNA组比较,D-GalN/LPS+sh-circLRP6组circLRP基因和C5aR1蛋白表达下调;同时,与D-GalN/LPS+sh-circLRP6+OE-NC组比较,D-GalN/LPS+sh-circLRP6+OE-C5aR1组C5aR1蛋白表达显著上调(图5中A、B,P<0.05)。流式细胞仪检测发现,与D-GalN/LPS+shRNA组比较,D-GalN/LPS+sh-circLRP6组的L02细胞凋亡率显著下降;而与D-GalN/LPS+sh-circLRP6+OE-NC组比较,D-GalN/LPS+sh-circLRP6+OE-C5aR1组的L02细胞凋亡率上升(图5C)。
讨 论
肝衰竭的病理表现为肝脏大量炎性细胞浸润、肝细胞凋亡和坏死,病情进展迅速,进而可导致多器官衰竭[5]。目前,D-GalN/LPS被广泛用于构建体外肝衰竭细胞模型,且用于评价药物对肝衰竭的保护作用[6]。本研究证明了上调miR-5590-5p的表达能够改善D-GalN/LPS诱导的肝细胞损伤。
肝衰竭具有复杂的病理调控机制,其中肝细胞凋亡是肝衰竭早期的重要病理表现[7]。研究表明细胞凋亡是一种常见的细胞死亡形式,其参与多种肝脏疾病的病情发展[8]。四氯化碳诱导的肝纤维化老鼠模型显示促凋亡蛋白Bax和cleaved caspase-3表达上调而抗凋亡蛋白Bcl-2表达下调,进而引起肝细胞的凋亡[9]。因此,细胞凋亡通路在肝衰竭中发挥重要作用,研究肝细胞凋亡在肝衰竭中具有重要意义。本研究首先构建了体外肝衰竭细胞模型,流式细胞术检测发现,D-GalN/LPS诱导L02细胞的大规模凋亡。同时,上调miR-5590-5p的表达水平能够降低D-GalN/LPS诱导L02细胞凋亡,进而改善D-GalN/LPS诱导的肝细胞损伤。这些结果表明,miR-5590-5p能够改善D-GalN/LPS诱导的肝细胞损伤。
miR-5590-5p在肝衰竭中表现出积极的作用。近年来研究表明,miR-5590能够抑制淋巴瘤的进展和免疫逃避,也可抑制三阴性乳腺癌细胞的增殖和迁移,促进其凋亡[10,11]。然而,miR-5590-5p在肝衰竭中的作用尚不清楚。因此本研究主要探究miR-5590-5p在肝衰竭中的作用机制。本研究通过生物信息学分析发现,circLRP6与miR-5590-5p存在结合作用,并通过RNA免疫共沉淀和双荧光素酶报告基因实验分析证实circLRP6能够直接与miR-5590-5p结合。越来越多的证据表明,环状RNA广泛参与细胞的增殖、凋亡和转移等生物学过程,且circLRP6能够调控癌细胞的增殖和侵袭[12]。
本研究通过生物信息学分析发现,miR-5590-5p与C5aR1存在结合作用。C5aR1在补体激活过程中发挥重要作用,在D-GalN/LPS诱导的小鼠肝衰竭模型中,C5aR表达上调,使用C5aR拮抗剂能够减轻D-GalN/LPS诱导的小鼠肝组织损伤和提高小鼠存活率[13]。本研究发现,miR-5590-5p可以直接调控C5aR1。同时,深入分析circLRP6、miR-5590-5p和C5aR1在D-GalN/LPS诱导肝细胞中的调控机制。circLRP6介导miR-5590-5p靶向C5aR1来降低L02细胞凋亡率。综上所述,circLRP6可能通过介导miR-5590-5p靶向C5aR1来改善D-GalN/LPS诱导的肝细胞损伤。
综上所述,本研究证明了miR-5590-5p可有效降低D-GalN/LPS诱导的肝细胞凋亡。本研究发现,circLRP6可以结合miR-5590-5p,且miR-5590-5p可以直接调控C5aR1来保护肝细胞免受损伤。同时,进一步研究发现,miR-5590-5p通过靶向C5aR1来降低L02细胞凋亡率。因此,笔者认为circLRP6介导的miR-5590-5p靶向C5aR1来降低L02细胞凋亡从而改善D-GalN/LPS诱导的肝细胞损伤。本研究结果将为miR-5590-5p作为肝衰竭新的治疗靶点提供理论依据。

