信迪利单抗联合安罗替尼治疗Ⅳ期驱动基因阴性肺腺癌1例并文献复习
马玉媛,付静娅,李 晨,肖海娟*,杨 林
(1陕西中医药大学肿瘤学教研室,咸阳 712000;2陕西中医药大学附属医院肿瘤医院三病区;3咸阳市中心医院肝胆外科;*通讯作者,E-mail:daisytcm@hotmail.com)
肺癌是最常见的恶性肿瘤之一,死亡率居全球首位[1]。根据病理分型,肺癌分为小细胞肺癌和非小细胞肺癌(non-small cell lung cancer, NSCLC),其中NSCLC患者占85%[2]。80%的患者在确诊时已处于晚期,故患者5年生存率不超过20%[3],特别是Ⅳ期患者5年存活率仅为5.3%[4]。根据CSCO诊疗指南,含铂双药化疗仍是NSCLC一线治疗方案,但中位无进展生存期(progression-free survival,PFS)仅为5个月,2年生存率小于30%[5],且毒副反应明显。因此,探求有效、合适的二线疗法是治疗NSCLC的迫切需求。
基于抗血管生成和免疫治疗协同抗肿瘤的理论基础,目前国内外已开展Impower150[6]等多项临床试验,以评估此联合疗法在NSCLC中的实际疗效,结果发现相比化疗、单药免疫,抗血管生成药物联合免疫治疗疗效显著。信迪利单抗是我国首个上市获批的PD-1单抗,通过阻断PD-1与其配体(PD-L1和PD-L2)相互作用,解除肿瘤微环境免疫抑制状态以抗肿瘤,而盐酸安罗替尼是一种酪氨酸激酶血管抑制剂,可通过多靶点途径阻断肿瘤血供抑制肿瘤生长。两药都用于肺癌治疗,但目前国内外关于安罗替尼联合信迪利单抗治疗NSCLC的报道及临床数据较少,本文报道1例安罗替尼联合信迪利单抗治疗驱动基因阴性、多发转移的Ⅳ期肺腺癌,并根据病例进行相关文献复习,以期为临床医师诊疗NSCLC提供更多思路。
1 病例资料
1.1 病史及诊断
患者,男,64岁,因“咳嗽、咳痰、胸闷气短1月余”于2019年12月16日在空军军医大学唐都医院就诊,CT示右肺门、右肺下叶占位性病变(3.6 cm×2.4 cm)伴双侧锁骨上窝、右肺门、纵隔淋巴结肿大,右肺癌多发转移不除外。右肺病变及纵隔病变病理穿刺活检提示:肺腺癌。基因检测EGFR、ALK、ROS1未突变,肿瘤突变负荷(tumor mutational burden, TMB)为10 Muts/Mb,诊断为:右肺腺癌(T2aN3M1,Ⅳ期)。患者既往高血压病史10年、冠心病病史7年;吸烟30余年(10支/d),无结核病史。
1.2 治疗及疗效评价
于是自2019年12月21日始行一线PP方案(培美曲塞900 mg+奈达铂10 mg)化疗。2周期后因患者强烈抵触化疗,故从2020年2月11日始行三线治疗:口服盐酸安罗替尼胶囊(10 mg,每天一次,服2周停1周)靶向治疗,服药期间出现呕吐、咽痛及口腔黏膜炎等副反应,用中药干预后症状缓解。2020年2月25日复查CT示右肺肿瘤增大(见图1),右侧第7肋骨、腰4椎体、双侧肾上腺继发转移瘤,疗效评价疾病进展(progressive disease, PD)。但患者仍拒绝化疗,给予抑制骨转移、止痛等对症处理后,疼痛稍缓解,要求出院。3月7日患者因腰痛加重再次入院,充分和患者及家属沟通后,予GP方案(吉西他滨1 200 mg+顺铂40 mg)化疗2周期,并于4月1日至4月18日行腰椎调强适形放疗(右侧腰四椎体30 Gy/2F),腰痛缓解。5月6日患者因“头痛、恶心加重1周”入院,影像学提示肺部瘤病灶较前变化不明显,右侧丘脑稍高密度结节(直径约8 mm),考虑转移瘤,颅骨骨质伴软组织破坏较前明显,考虑转移,疾病再次进展。故5月18日至9月18日在安罗替尼靶向治疗基础上,予5周期GP方案并联合信迪利单抗(达伯舒:200 mg,28 d/疗程)。2周期后肿瘤缩小至33%(见图2A),5周期后复查右肺病灶明显缩小(1.3 cm×1.4 cm)至61%(见图2B)),疗效评估为部分缓解(partial response, PR)。后一直用安罗替尼靶向联合信迪利单抗治疗,病情稳定。
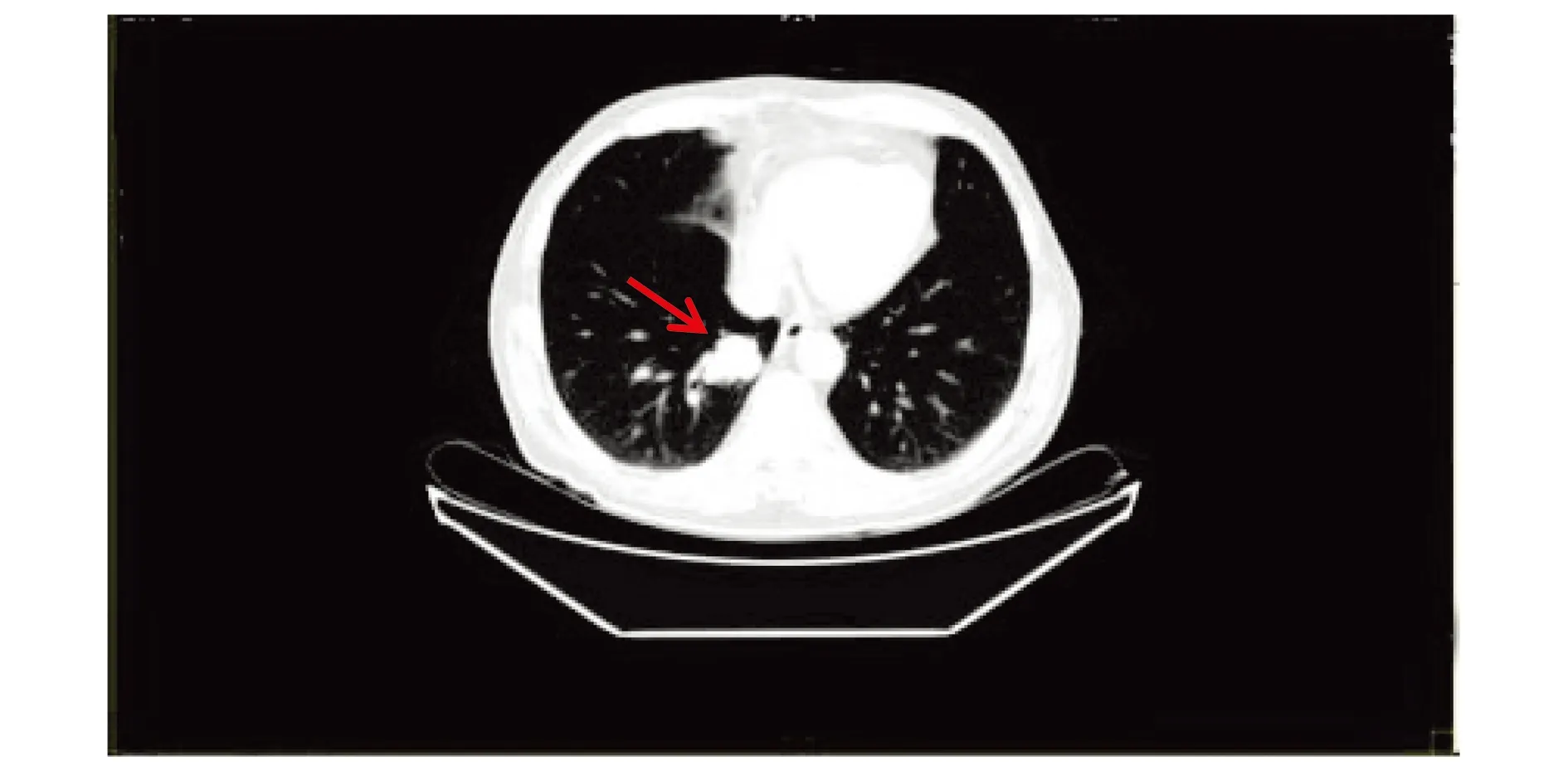
图1 2周期PP方案及安罗替尼治疗后胸部CT
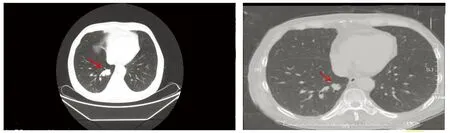
A.2周期治疗后肺部肿瘤缩小33% B.5周期治疗后肺部肿瘤缩小61%
12月23日影像学提示双侧肾上腺转移瘤,病灶较前明显增大,右侧大小约6.7 cm×3.5 cm,左侧大小约8.0 cm×5.2 cm,治疗不变,原方案执行。2021年11月23日患者自诉服用安罗替尼后心悸,故停止服用,仅用信迪利单抗维持治疗(至今已使用27周期)。目前患者肺部病灶基本稳定(1.3 cm×1.1 cm)(见图3),且双侧肾上腺转移瘤较前明显缩小,右侧缩小约58%(2.80 cm×0.71 cm),左侧缩小约56%(3.5 cm×2.1 cm),疗效评估为PR。
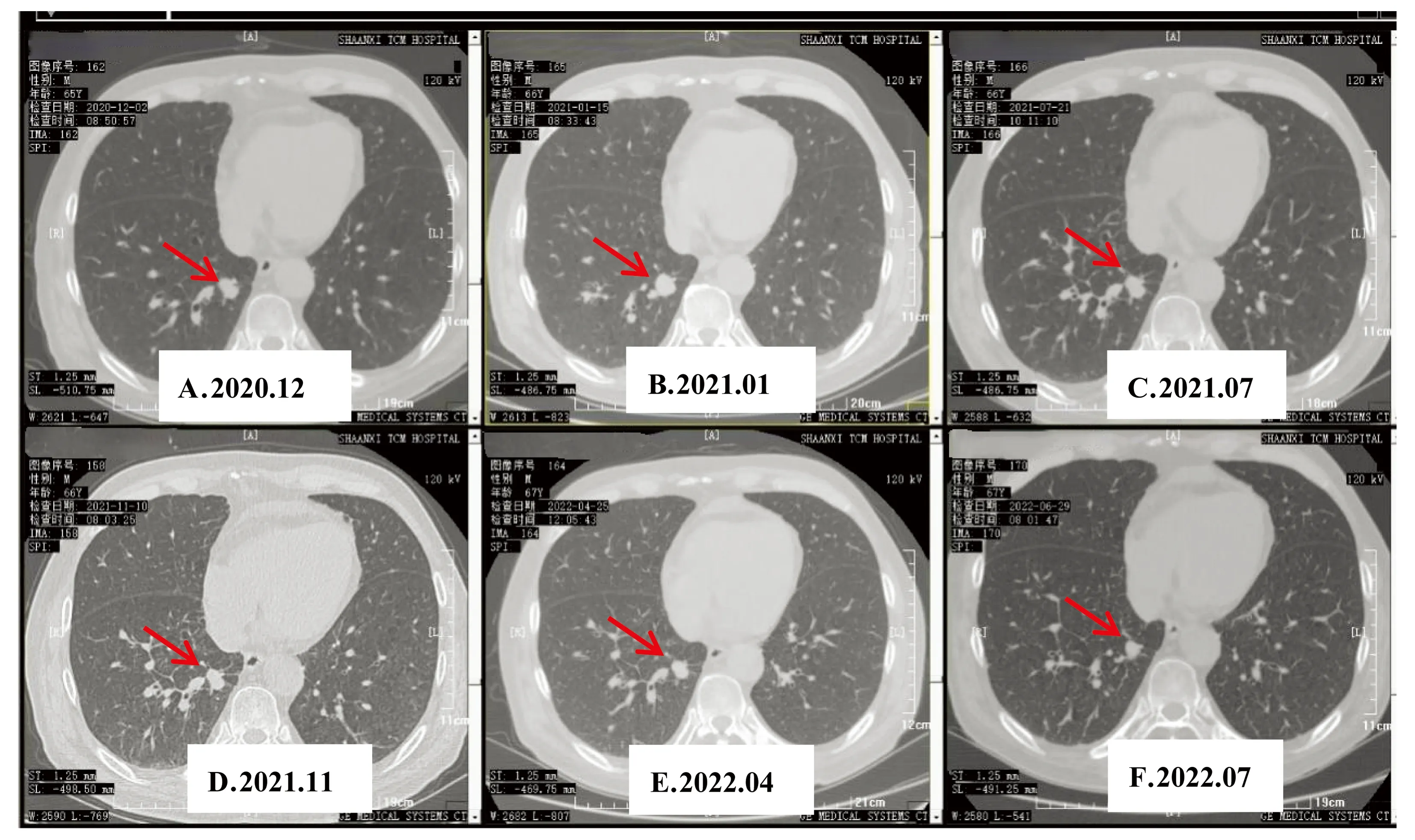
A-D.2020.12-2021.11期间,仅用安罗替尼+信迪利单抗治疗,肿瘤逐渐缩小;E-F.停用安罗替尼后,单用信迪利单抗维持治疗,肿瘤一直保持稳定
2 讨论
血管新生是恶性肿瘤生长和转移的关键,通过多靶点、多途径抑制肿瘤血管生成,可阻碍肿瘤进一步生长。但在选择性压力下,过度修剪的肿瘤血管极容易转变成耐缺氧表型,逆向促进肿瘤的侵袭和转移[6,7]。而最新研究表明,抗血管生成药物可增敏免疫治疗,两药协同能增强抗肿瘤疗效。本文报道1例驱动基因阴性的Ⅳ期多发转移性肺腺癌患者,通过化疗联合安罗替尼、信迪利单抗减轻瘤负荷,后用靶向联合免疫维持治疗获益明显。
信迪利单抗(达舒伯,Sintilimab)是我国自主研发的首个人源化重组抗PD-1单克隆抗体,通过阻断PD-1与其配体PD-L1、PD-L2相互作用抗肿瘤。而盐酸安罗替尼是一种新型多靶点酪氨酸激酶抑制剂,其靶点包括靶向血管内皮生长因子受体1~3、成纤维细胞生长因子受体1~4、血小板衍生生长因子受体和干细胞因子受体(c-kit),通过参与肿瘤血管生成和增殖信号传导抗肿瘤[9]。目前国内关于两药联合治疗NSCLC的临床报道较少,故中文以“安罗替尼”“信迪利单抗”“非小细胞肺癌”,英文“Anlotinib”“Sintilimab”“non small cell lung cancer”为检索词,在中国知网、万方、Pubmed数据库上共检索出12篇相关文献,过筛后只有4篇文献为临床试验性研究。陈颜等[7]通过纳入87例NSCLC患者进行对照研究,发现观察组29例患者的客观缓解率(objective response rate,ORR)为70.83%、疾病控制率(disease control rate, DCR)为96.6%,PFS达到(9.7±2.3)个月,常见的不良反应包括胃肠道反应、乏力、骨髓抑制等,但差异无统计学意义,不良反应一般可控。操思源等[8]纳入的56例患者中,观察组24例患者的ORR为70.83%、DCR为91.67%,虽有胃肠道反应、肝功能异常等副反应,但毒性反应评价仅为1~2级。陈巧林等[9]研究发现,观察组15例患者的ORR为86.67%,DCR为93.33%,PFS达(15.05±3.12)个月,常见发热、咳嗽、胃肠道反应、骨髓抑制等不良反应,但90.91%患者的毒性反应都小于3级,患者耐受良好。在上海胸科医院的一项单中心、开放标签、Ib期研究(NCT03628521)[10]中,治疗后患者总体ORR达72.7%(16/22),所有患者实现肿瘤缩小和疾病控制,中位PFS为15个月,生存周期明显得到获益。分析以上文献,发现患者的ORR都>70%,DCR>90%,综合疗效显著,且主要治疗相关不良事件(treatment-related adverse events,TRAEs)一般安全可控。虽然关于安罗替尼联合信迪利单抗治疗NSCLC的临床研究数据较少,但是实际疗效已在临床得到体现。
本例患者之所以获益,我们分析可能的原因如下:①患者已处于晚期,全身多脏器转移,此时肿瘤细胞增殖异常活跃,短周期化疗及三线安罗替尼姑息治疗疗效单一、抑瘤率低,故肿瘤开始迅速进展,继发转移至骨、肾上腺、脑。②基于IMpower150研究[6]中阿替利珠单抗+贝伐珠单抗+化疗在转移性非鳞非小细胞肺癌患者中的研究结果,发现抗血管生成药物、免疫检查点抑制剂、化疗多药联合能显著改善患者的PFS和总生存期(overall survival, OS)。所以,在肿瘤迅速进展后,我们考虑用PD-1抑制剂信迪利单抗联合化疗及靶向治疗,副反应更小且患者容易耐受。用药2周期后靶病灶缩小至33%,5周期后明显缩小(1.3 cm×1.4 cm)至61%,疗效突出且患者依从性高。目前已有研究[11]表明,安罗替尼通过下调PD-L1表达,提高肿瘤免疫微环境中CD8/FoxP3比值,重塑免疫微环境;同时安罗替尼和PD-1抑制剂联合使用可促进自身免疫细胞(如自然杀伤细胞、M1样肿瘤相关巨噬细胞和树突状细胞)的浸润以抗肿瘤[12]。故安罗替尼通过转变肿瘤微环境免疫抑制状态,提高了信迪利单抗疗效。其次,信迪利单抗能与更多的PD-1分子结合与CD3+T细胞,刺激T细胞激活[13]。这在Wang等[13]的试验中得到验证,Wang等发现患者在接受信迪利单抗4周后,PD-1受体表现出持续高占有率(>95%)。所以,安罗替尼和信迪利单抗通过彼此的正反馈提高疗效,最终推动免疫介导的肿瘤缩小。这不仅反映在本例报道中,患者治疗后原发灶由3.6 cm×2.4 cm缩小至1.3 cm×1.1 cm,肿瘤标志物NSE由133.4 ng/ml降至15.18 ng/ml,患者ECOG评分也改善至1分;另外还在一项Ⅰ期研究中得到临床证实,Chu等[10]报道信迪利单抗联合安罗替尼作为NSCLC一线治疗的ORR为72.7%,DCR为 100%,12个月 PFS率为71.4%。这些证据提示安罗替尼联合信迪利单抗可能是治疗晚期NSCLC有效且积极的治疗方案。
安罗替尼上市后报道的主要TRAEs有出血、高血压、手足综合征、蛋白尿、腹泻等,而信迪利单抗的TRAEs主要为免疫相关性不良事件如免疫性肺炎、肝炎、甲状腺功能减退等。在本例报道中,患者多药联合抗肿瘤过程中未发生血液学毒性、严重免疫相关性TRAEs。因患者既往有高血压及冠心病病史,随着治疗周期的延长,治疗后期出现极高危高血压、心悸表现,故停用安罗替尼。这是因为安罗替尼通过抑制血管内皮生长因子/血小板衍生生长因子-BB/成纤维细胞生长因子-2抑制血管新生和微血管密度,以致间接导致了高血压、冠心病的加重[14]。期间出现轻微的消化道反应、疲乏、口腔黏膜炎反应等症状在中药干预后也基本好转。虽然Chu等[10]研究中≥3级TRAEs发生率为54.5%,但是大多数3级TRAEs仅发生1次,最严重的也只出现1例5级免疫相关性肺炎,这说明安罗替尼联合信迪利单抗治疗NSCLC副反应小,安全可控。
3 结语
综上所述,血管-免疫系统在肿瘤侵袭、免疫逃避和转移扩散中起着关键作用,但相比单一疗法,抗血管生成联合免疫治疗疗效更优且效果肯定。本例患者经安罗替尼和信迪利单抗联合治疗后,临床症状改善、生存质量提高、生存期明显延长。但病例单一,后期仍需大样本研究以进一步验证其疗效、探索可能的作用机制并优化治疗方案,同时完善不良事件的监测及受益人群筛选,以期最大程度为患者获益。

