双氢青蒿素对脑胶质瘤小鼠表皮生长因子(EGF)和血管内皮生长因子(VEGF)的影响
詹增钦,刘 颖,郑钟洪,李景涛,伍 鑫
(广州中医药大学金沙洲医院国际肿瘤医疗中心,广东 广州 510000)
胶质瘤是最常见的颅内肿瘤之一,该病在全球发病率为3 ~6.4/10 万[1]。目前,胶质瘤的诊疗方式除了手术、传统的放化疗外,还有根据分子病理的靶向治疗、肿瘤电场治疗,但决定治疗方式的因素除了胶质瘤生长的位置,也与潜在的肿瘤生物学有关[2]。因胶质瘤呈弥漫性浸润,中枢神经系统具有敏感性,传统治疗会导致一系列的神经损伤,导致患者预后生活质量往往较差,易复发,生存期短。根据世界卫生组织(WHO) 制定的中枢神经系统肿瘤的分类[3],Ⅰ级和Ⅱ级胶质瘤为低级别胶质瘤(LGG),Ⅲ级和Ⅳ级胶质瘤为高级别胶质瘤,其中以胶质母细胞瘤为主(GBM)。尽管对于GBM 临床上有多模式的治疗策略,但此病患者的预后通常不佳,其中位生存时间仅为12 ~14个月,5 年内生存率仅为5%[4]。因此,深入研究胶质瘤的发病机制,探索潜在的治疗靶点与药物对相关诊断和治疗至关重要。青蒿素的水溶性较差,不易挥发,生物利用度偏低,这限制了其临床应用,因此研究人员通过结构改造合成了低毒、安全的青蒿素衍生物——双氢青蒿素(Dihydroartemisinin,DHA)[5]。有研究表明,DHA 对宫颈癌、胰腺癌、肺癌、肝癌、淋巴瘤以及前列腺癌等恶性肿瘤有明显的抑制作用,国内亦有少量文献[6]阐述了DHA 与脑胶质瘤的发生存在一定联系。表皮生长因子(EGF)是由53 个氨基酸残基组成的,与细胞的分化、增殖及癌变关系密切[7]。通过结合表皮生长因子受体可以抑制上皮增殖,促进组织修复,且具有保护细胞的作用。一旦EGF过度表达,会引起细胞过度增生、变异,从而发生向恶性表型的转化[7]。血管内皮生长因子(VEGF)是血管内皮细胞特异性的肝素结合生长因子,可促进血管内皮细胞增殖和新生血管的生成。研究表明,在各级别脑胶质瘤患者群体中,VEGF 的表达均与疾病的严重程度密切相关,提示VEGF 的异常表达在脑胶质瘤恶化的转变过程中发挥着重要作用[8]。DHA 同时也介导着VEGF 的表达,但对于DHA 是否能通过改变EGF 和VEGF 的表达来控制脑胶质瘤的发展,尚无相关研究报道,且鲜有相关的动物实验。在本文中,笔者主要是观察DHA 对脑胶质瘤小鼠EGF 和VEGF 表达情况的影响,旨在为抗肿瘤新药物的开发提供依据。
1 材料与方法
1.1 实验材料
购买8 周龄SPF 级SD 小鼠24 只,雌雄各半,购自广东省医学实验动物中心〔生产许可证号:SCXK(粤)2018-0002〕,体重在18 ~22 g 之间。实验中所有处理方法均经过伦理委员会批准。
1.2 方法
(1)实验分组:动物实验前喂养1 周,饲养箱温度(24±1)℃,湿度(50±5)%,明暗各12 h(8 am—8 pm), 自由进食及饮水,随机分为正常组、模型组、双氢青蒿素低剂量组、双氢青蒿素高剂量组各6 只。(2)模型构建:除正常组以外,其余组参考相关文献造模,将裸鼠固定在小鼠脑立体定位仪上,头皮逐层切开暴露,用2 mL 注射器针头在前囟前1.0 mm、中线旁开2.5 mm、硬脑膜下3.5 mm 处钻孔。用微量注射器吸取10 μL(1×105个细胞)配制好的C6 胶质瘤干细胞悬液,缓慢注射于小鼠纹状体内,注射后停留10 min。造模7 天后,动物活体成像仪检测裸鼠肿瘤荧光量达1×105时,认为造模成功。(3)干预方式:各组小鼠自由进食,双氢青蒿素低剂量组给予25 mg/kg双氢青蒿素灌胃,双氢青蒿素高剂量组给予50 mg/kg双氢青蒿素灌胃,模型组同时灌胃等量生理盐水,正常组不做任何处理,每天1 次,持续15 天。(4)检测方法:实验结束后,处死小鼠,取脑胶质瘤组织(正常组取正常脑组织),用电子天平称取0.5 g 脑胶质瘤组织(正常组取正常脑组织),用眼科小剪刀尽快剪碎,置于匀浆器中,加入9 倍量的冰生理盐水,用匀浆器制成10%的组织匀浆(匀浆器的末端置于放冰块的冷水中)。以3500 r/min 离心15 min,取上清液置4℃冰箱保存,按小鼠EGF、VEGF ELISA 试剂盒说明书要求在酶联免疫检测仪上检测EGF、VEGF 的含量,具体的检测方式如下:将各种试剂于室温下平衡30 min,每孔加样100 μL,盖上板膜,37℃孵育2 h,弃去液体,甩干;每孔加入生物素标记的抗体工作液100 μL,盖上板膜,37℃孵育1 h,弃去液体,甩干;洗板3 次,每次浸泡2 min,每孔加200 μL 洗液;每孔加HRP 标记的亲和素工作液100 μL,盖上板膜,37℃孵育1 h,弃去液体,甩干,洗板5 次,每次浸泡2 min,每孔加200 μL 洗液;每孔加底物溶液90 μL,37℃避光显色15 ~30 min;每孔加入终止液50 μL,终止反应;反应终止后5 min 内用酶标仪在450 nm 波长处测量吸光度OD 值。
1.3 统计学处理
2 结果
通过ELISA 试剂盒检测各组小鼠的EGF 和VEGF水平,验证了双氢青蒿素能够改变脑胶质瘤模型小鼠组织EGF、VEGF 的水平(使其趋于正常),具体的结果如下(表1 所示):正常组、模型组、双氢青蒿素低剂量组和双氢青蒿素高剂量组小鼠脑胶质瘤组织EGF 值分别 为(235.87±21.72)pmol/L、(584.36±29.63)pmol/L、(347.34±31.99)pmol/L 和(305.61±28.14)pmol/L。上述各组小鼠的脑胶质瘤组织VEGF 值则分别为(37.12±2.21)ng/L、(72.88±6.67)ng/L、(55.40±5.54)ng/L 和(42.81±3.39)ng/L。与正常组对比,模型组小鼠的EGF 和VEGF 水平均明显升高(P<0.01);与模型组相比,双氢青蒿素低剂量组的EGF 和VEGF 水平均明显下降(P<0.01);与模型组相比,双氢青蒿素高剂量组的EGF 和VEGF 水平也均明显下降(P<0.01),并且下降幅度比双氢青蒿素低剂量组的下降幅度更大,更加接近于正常小鼠的EGF 和VEGF 水平。提示了双氢青蒿素可以抑制脑胶质瘤小鼠模型异常增长的EGF 和VEGF 水平,使其恢复至正常的状态,并且这种抑制效果和双氢青蒿素的浓度呈正相关。
表1 各组小鼠EGF 和VEGF 的比较(± s)
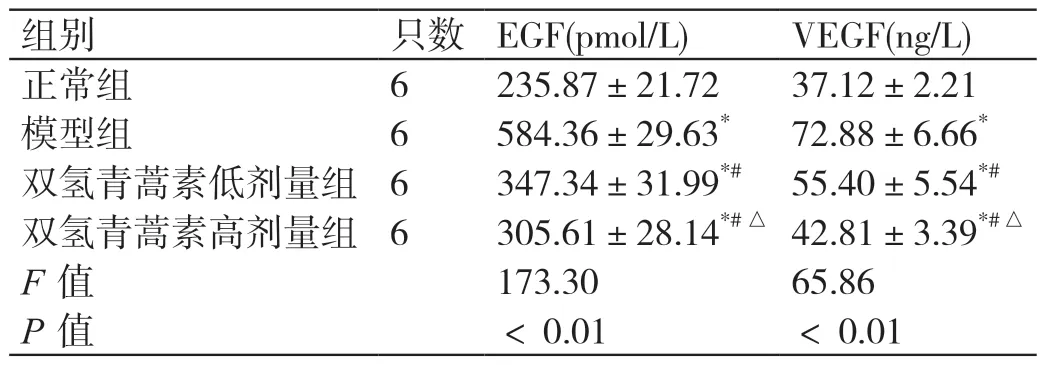
表1 各组小鼠EGF 和VEGF 的比较(± s)
注:EGF,表皮生长因子;VEGF,血管内皮生长因子;* 与正常组比较,P<0.01;#与模型组比较,P <0.01;△与双氢青蒿素低剂量组比较,P <0.01。
组别 只数 EGF(pmol/L) VEGF(ng/L)正常组 6 235.87±21.72 37.12±2.21模型组 6 584.36±29.63* 72.88±6.66*双氢青蒿素低剂量组 6 347.34±31.99*# 55.40±5.54*#双氢青蒿素高剂量组 6 305.61±28.14*#△ 42.81±3.39*#△F 值 173.30 65.86 P 值 <0.01 <0.01
3 讨论
青蒿素因其在治疗疟疾中的重要作用而闻名于世。除了抗疟疾的特性,人们发现青蒿素及其衍生物还具有多种药物活性,如抗病毒、抗炎症和抗肿瘤作用,同时具有多种生物活性,包括改善肝脏损伤、抑制炎症和逆转肿瘤细胞耐药[9]。DHA 作为青蒿素的衍生物之一,在过去十年的研究中,一直都是抗肿瘤新药物的研发重点[10]。其已经通过大量动物实验被证实可抑制癌症发生过程[11]。有研究指出,DHA 可通过激活氧化应激诱导人急性T 淋巴细胞增殖及凋亡来抑制癌变,对多种实体瘤细胞具有明显的生长抑制作用。不仅如此,DHA 还可通过包括Wnt/β-catenins 等复杂的信号通路传递细胞死亡信息、抑制癌变细胞转移和肿瘤血管生成,并可抑制促癌信号[12]。有研究指出,DHA 能够干预EGF 和VEGF 的表达。我们的动物实验初步证明了当给予脑胶质瘤小鼠DHA 干预时,小鼠的EGF 和VEGF 表达水平降低,并且随着给药浓度的增加,其表达水平趋于正常。肿瘤血管生成学说目前已得到越来越多的认可[13]。EGF 和VEGF 与脑胶质瘤的发生密切相关[8],临床上常将这两者作为胶质瘤检测的标志物。而介导EGF 和VEGF 的信号通路极其丰富,有JAK2/STAT3 信号通路、VEGF/VEGFR 信号通路、PI3K/AKT 信号转导通路等等[14-16]。动物实验的数据结果说明双氢青蒿素可能通过介导某些信号通路来调控EGF、VEGF 的表达,从而影响脑胶质瘤的发展进程,然而具体的信号通路,还需进一步分析研究。
综上所述,双氢青蒿素对脑胶质瘤小鼠的EGF、VEGF 表达水平具有明显的抑制效果,其作用机制可能是双氢青蒿素通过某些信号通路来调控EGF、VEGF 的表达,进而影响了脑胶质瘤的血管生长情况。
——青蒿素

