脑白质高信号与多系统萎缩临床症状的相关性
王垚 李楠楠 任珊 陈路 康盛华 冉维正 张新宁 赵迪 陈志刚
多系统萎缩(multiple system atrophy,MSA)是一种成年发病的持续进展的神经系统退行病,其临床特征表现为帕金森样症状、共济失调及自主神经功能障碍[1]。脑白质高信号(white matter hypertensity,WMH)是一种与年龄相关的脑小血管病,其患病率随年龄的增加而增加[2]。目前WMH被认为是导致老年人认知损伤、尿失禁和步态障碍的重要因素[3]。近年来亦有研究证实MSA可合并WMH[4-6]。目前有关WMH与MSA临床症状是否存在相关性尚不明确。本研究通过探讨不同程度WMH与MSA患者运动症状及非运动症状的相关性,旨在为MSA的临床评估及诊疗提供参考。
1 对象和方法
1.1 对象回顾性收集2017年1月至2021年12月北京中医药大学东方医院门诊及住院的合并WMH的MSA患者85例,其中男51例,女34例。根据Fazekas量表评分,轻度WMH 56例、中重度WMH 29例。纳入标准:符合中国MSA诊断专家共识[7];头颅核磁证实患者存在WMH。排除标准:其他不典型帕金森综合征和继发性帕金森综合征;头部外伤史;其他原因导致的认知障碍、步态异常以及尿失禁;伴有严重心、肝、肾脏疾病等。所有患者对本研究知情同意并签署知情同意书,本研究经北京中医药大学东方医院伦理委员会审查通过。
1.2 方法收集受试者一般人口学信息、临床特征以及辅助检查结果等。采用Hoehn-Yahr(H-Y)分级、统一多系统萎缩评估量表(UMSARS)评估运动症状;采用蒙特利尔认知量表(MoCA)评定认知功能;采用非运动症状量表(NMSS)评估患者非运动症状。收集患者就诊前后3个月内头颅MRI检查结果,采用半定量视觉量表(即Fazekas量表)评分评估WMH严重程度。该量表总分为 0~6分,包括两部分:(1)脑室旁WMH(0~3分):0分为无病变,1分为帽状或细铅笔状病变,2分为病变呈光滑“光晕状”,3分为病变呈不规则向深部延伸;(2)深部WMH(0~3分):0分为无病变;1分为点状病灶;2分为病灶有融合趋势;3分为病灶大片状融合。根据Fazekas量表总分将WMH严重程度分为轻度(0~2分)、中度(3~4分)和重度 (5~6分)。
1.3 统计学处理应用SPSS 20.0对数据进行统计分析,符合正态分布的计量资料采用均数±标准差表示,两均数间比较采用独立样本t检验;非正态分布的计量资料采用中位数(四分位数间距)表示,两组间比较采用Mann-Whitney秩和检验;计数资料采用卡方检验(当n≥40,且理论值T在1≤T≤5时,采用校正卡方检验;当n<40,或理论值T<1时,采用Fisher精确概率法);WMH严重程度与临床特征的相关性采用Spearman相关性分析;采用多元线性回归分析MoCA、NMSS与WMH严重程度的关系。取α=0.05。
2 结果
2.1 轻度和中重度WMH患者临床资料比较与轻度WMH组患者比较,中重度WMH患者MSA起病年龄、NMSS评分更高,MoCA评分低(均P<0.05),而两组患者间性别构成、糖尿病、心脏病、卒中史等余临床资料比较均无统计学差异(P>0.05)。具体结果见表1。

表1 两组MSA合并WMH患者临床资料比较
2.2 多元线性回归分析未校正任何混杂因素(模型1)、校正病程后(模型2)以及校正病程、年龄、性别、糖尿病、心脏病、卒中史、吸烟史、饮酒史(模型3)后,WMH严重程度对MoCA评分均有负向影响,并且有统计学意义(均P<0.05)。未校正任何混杂因素(模型1)时,WMH严重程度对NMSS评分有负向影响,并且有统计学意义(P<0.01),而校正病程后(模型2)及校正病程、年龄、性别、糖尿病、心脏病、卒中史、吸烟史、饮酒史(模型3)后,WMH严重程度对NMSS评分的影响均无统计学意义(P>0.05)。结果见表2。
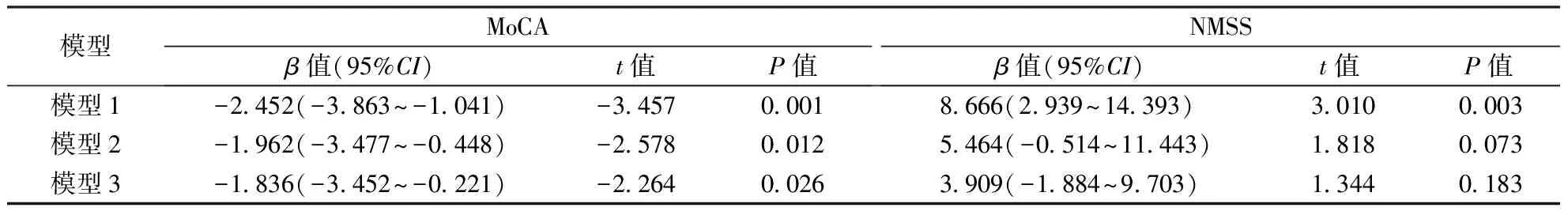
表2 MSA合并WMH患者WMH严重程度与MoCA和NMSS的多元线性回归分析结果
2.3 Spearman相关性分析MSA合并WMH患者WMH严重程度与NMSS子项中的心血管相关症状(包括跌倒)、睡眠/疲乏、排尿障碍以及性功能障碍存在显著相关性(P<0.05),而与NMSS子项中的情绪/认知、视/幻觉、注意力/记忆力、胃肠症状以及其他评分无相关性(P>0.05)。结果见表3。
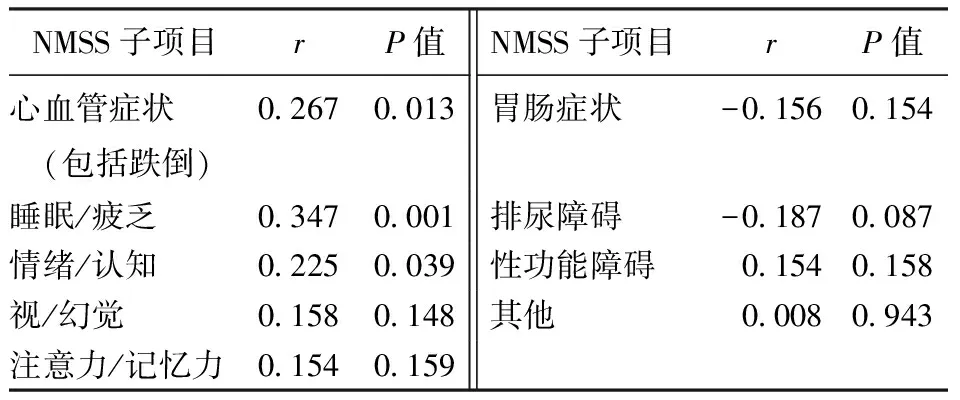
表3 MSA合并WMH患者WMH严重程度与NMSS的Spearman相关性分析结果
3 讨论
MSA是一种预后不佳的α突触核蛋白病,其步态障碍等运动症状及头晕、疲乏、排尿障碍等非运动症状严重影响患者生存质量[8]。而WMH作为一种年龄相关性的脑小血管病,亦可存在步态障碍、头晕、排尿障碍等症状,与MSA的临床症状重叠。近年来越来越多研究显示WMH与MSA可共病存在,但WMH对MSA临床症状的影响尚不完全清楚[5]。因此,探索WMH对于MSA各临床症状的影响可能会从脑小血管病方面为MSA的治疗找到新的干预思路。
本研究结果显示,与合并轻度WMH的MSA患者相比,合并中重度WMH者年龄更大,NMSS评分更高,MoCA评分更低,而UMSARS评分以及排尿功能障碍症状未见两组间存在统计学差异;多元线性回归分析结果显示,在校正年龄、病程、卒中史、高血压、糖尿病、心脏病、吸烟、饮酒史后,WMH对MoCA有负向影响,而对NMSS总评分无统计学影响;Spearman相关性分析显示NMSS子项中心血管症状、睡眠/疲乏以及情绪/认知子项分数均与WMH严重程度有相关性。
2022年运动障碍协会(MDS)提出的MSA诊断标准[9]中将发病3年内出现痴呆作为MSA诊断的排除标准,但近年来有研究显示MSA患者可表现为一定程度的认知障碍。Stankovic等[10]研究发现MSA患者的执行功能、记忆力、视空间能力显著下降。冉维正等[11]对199例MSA患者进行认知评估,结果也证实了MSA患者可出现视空间与执行和延迟回忆能力的下降。目前MSA患者认知障碍病理机制尚未完全明确,Hatakeyama等[12]通过简易精神状态量表(MMSE)以及额叶功能测试(FAB)对59例MSA患者进行认知功能评价后发现患者的额叶功能与白质改变存在相关性。Kim等[13]采用3T头颅核磁影像及MMSE评分对152例MSA患者进行研究发现,15%的患者符合DSM-Ⅳ痴呆标准,提示MSA的认知损伤与WMH可能有关。本研究结果支持这一观点。然而,认知障碍是否会影响MSA患者的生存期尚存争议。一项小样本[14]研究结果显示痴呆及痴呆病程并不影响MSA患者的生存时间。因此,有关WMH与MSA认知障碍的确切关系尚需进一步研究。
膀胱过度活动综合征(OAB),尤其是急迫性尿失禁是MSA常见的非运动临床症状。Kirby等[15]通过尿动力检查发现MSA患者在膀胱充盈时不会出现抑制性收缩,并提出其机制可能与黑质纹状体的功能下降有关。脑小血管病患者同样会出现尿失禁等排尿症状,Sakakibara等[16]研究发现脑小血管病患者中膀胱充盈期会出现逼尿肌自发性不随意收缩现象,此后“血管性排尿障碍”“血管性尿失禁”的概念逐渐被接受。血管性排尿障碍主要涉及额叶皮层环路、中扣带回环路以及皮层下环路,分别负责排尿控制、环境感知、运动反射等不同功能[17]。目前MSA合并WMH的排尿障碍机制尚未明确。本研究结果显示MSA患者WMH严重程度与排尿症状无相关性,其可能的原因在于排尿障碍不仅和WMH的损伤严重程度有关,也与WMH的病变位置有关。Clarkson等[18]结合弥散张量成像(DTI)技术评估60例存在急迫性尿失禁的社区老年女性的排尿功能后发现,急迫性尿失禁患者的上纵束和扣带回的WMH负担高于健康对照组。Kuchel等[19]通过DTI技术评估社区老年人发现只有部分的额叶白质纤维束(右侧额下回、前放射冠和额枕上束)参与到尿失禁的病理过程。因而合并WMH的MSA患者的排尿功能障碍可能是多个病理机制共同作用的结果。
MSA患者NMSS评分与患者的生活质量存在相关性[20],因而深入研究患者非运动症状的特征对改善患者的生活质量具有重要意义。本研究通过相关性分析以及多元线性回归发现,MSA患者的NMSS评分与WMH的严重程度相关,提示在评估MSA患者的非运动症状时也需要关注脑白质损伤对症状的影响。Zhang等[21]研究结果显示62.0%的MSA患者存在抑郁症状,71.7%的MSA患者存在焦虑症状。Petrovic等[22]研究发现帕金森病患者疲乏、抑郁、焦虑以及生活质量均与白质损伤程度相关。本研究进一步对WMH与NMSS子项分数进行了相关性分析,结果亦支持WMH与情绪/认知评分存在相关性。
综上所述,本研究结果显示,中重度WMH的MSA患者起病年龄、NMSS评分较轻度WMH患者更高,MoCA评分低,WMH对MoCA有负向影响,WMH严重程度与NMSS子项中的心血管症状、睡眠/疲乏以及情绪/认知子项分数均有相关性。在临床诊断及治疗中应重视对MSA患者的WMH情况进行系统评估。由于本研究为单中心研究,且入组患者病情相对较轻,存在一定程度偏倚;同时,未考虑不同位置WMH对临床症状的影响,因此有关MSA患者WMH与临床特征的关系仍需进一步研究。

