载脂蛋白E在胆固醇逆向转运中作用的研究进展
刘欣, 龙雄权, 陈金智,3, 胡密, 唐宛莹, 何平平, 欧阳新平
1.湖南师范大学医学院生理学教研室 湖南省生殖与转化医学研究中心,湖南长沙 410081;2.南华大学衡阳医学院基础医学院生理学教研室 神经科学研究所 神经变性与认知障碍衡阳市重点实验室,湖南衡阳 421001;3.长沙泰和医院,湖南长沙 410004
载脂蛋白E(apoprotein E,ApoE)在人体细胞中广泛表达,参与胆固醇的流出及胆固醇逆向转运(reverse cholesterol transport,RCT),维持人体内胆固醇稳态。近年研究已经证实,ApoE可以通过促进RCT等多种途径,减少动脉粥样硬化(atherosclerosis,As)等疾病的发生[1-2]。ApoE模拟肽类药物的开发已成为科学研究的热点,最近研究表明,ApoE模拟肽介导循环性As脂蛋白的清除,促进RCT,显著降低血浆胆固醇水平,从而减少As发生。ApoE模拟肽还具有抗炎、抗氧化及抗肿瘤作用。虽然近年来在ApoE及其模拟肽与RCT的研究取得一些进展,但仍存在许多问题尚未阐明。本文对ApoE在RCT中的作用进行综述,期望为As等心血管疾病的治疗寻找新的靶点和方法。
1 ApoE的分布
ApoE在人体细胞中广泛表达,包括肝细胞、肝窦细胞、脾巨噬细胞、淋巴结、肺组织、肾上腺各层的胶质细胞、肾小球囊细胞和睾丸平滑肌细胞等。其中,肝细胞是ApoE合成的主要部位,在大脑(数量仅次于肝脏)、肾上腺、睾丸、皮肤、肾脏、脾脏和脂肪组织以及各种组织的巨噬细胞中也很容易检测到ApoE的产生[3]。ApoE在少数细胞中不表达,例如肠道上皮细胞[4]。
2 ApoE结构、分类、调控与功能
2.1 ApoE的结构
ApoE含有299个氨基酸残基,有一个包含四螺旋结构22 kDa(1~199个残基)的N端结构域和一个包含一系列两性分子α螺旋10 kDa(215~299个残基)的C端结构域,N端结构域和C端结构域通过蛋白酶敏感环连接,317个氨基酸的蛋白质失去18个氨基酸的信号肽,成为含有N-末端、铰链和C-末端结构域的成熟蛋白质。后者包含与磷脂、低密度脂蛋白(low density lipoprotein,LDL)、硫酸肝素蛋白多糖(heparansulfateproteoglycan,HSPG)结合的区域,以及介导自结合的区域(图1)。N端结构域容纳低密度脂蛋白受体(low density lipoprotein receptor,LDLR)蛋白家族的结合位点与HSPG的结合区,C端结构域承载高亲和力的脂质结合位点,而在没有脂质的情况下,C端结构域介导蛋白质-蛋白质相互作用,从而促进ApoE同源二聚体和四聚体形成[5]。ApoE在N-末端螺旋束的螺旋上有许多赖氨酸和精氨酸(arginine,Arg)残基,形成一个带正电荷的口袋,与LDLR蛋白家族成员脂蛋白结合部位的酸性残基相互作用[6]。在N端,4个螺旋聚集在一起,插入的铰链结构域被C端以折叠回LDLR结合区的方式锁定,只有当C末端在嵌入磷脂时移开时,这一区域才会暴露,这确保ApoE只是脂蛋白的活性配体。

图1 ApoE的结构
2.2 ApoE的分类
人类ApoE主要有3种亚型,分别为ApoE2、ApoE3和ApoE4,其基因频率分别为5%、77%和18%[7]。在这些亚型中,涉及单核苷酸多态性的某些位置彼此不同,导致ApoE基因的结构和功能发生巨大的变化[8]。ApoE2可以降低人体血浆中LDL水平,促进胆固醇的流出,对心血管系统和神经系统有一定的保护作用,但可能会引起高脂血症[9]。ApoE3是34 kDa的可交换蛋白,作为最普遍的亚型,其在血浆和胆固醇稳态中起关键作用[10]。与ApoE3相比,ApoE2与LDLR的结合能力较低,而ApoE4与LDL的结合能力较高,这主要是因为在ApoE4中Arg-61和Glu-255之间存在盐桥结构,而在ApoE2与ApoE3中都不存在此结构[11]。最近对英国生物库中382 188名欧洲血统参与者的研究表明,ApoE4纯合子人群患严重新冠肺炎的风险很高(2.36%),与ApoE3纯合子人群相比,这种风险高出两倍[12]。造成这种差异是否与ApoE4的结构有关仍待研究。
2.3 ApoE的表达调控
ApoE的表达受多种因子的调控(图2)。核转录因子激活蛋白-1(activator protein-1,AP-1)、AP-2、cAMP、淀粉样β蛋白(amyloid beta,Aβ)、睾丸孤儿受体-4(testicular orphan receptor 4,TR4)、特异性蛋白-1(specificity protein 1,Sp1)、肝X受体(liver X receptor,LXR)、ATP结合盒转运体(ATP-binding cassette transporter A1,ABCA1)、过氧化物酶体增殖物激活受体-γ(peroxisome-proliferator-activated receptor-γ,PPAR-γ)、核因子-κB(nuclear factor-κB,NF-κB)等因子,这些因子能显著提高ApoE的表达。除此之外,成纤维细胞生长因子-1(gibroblast growth factor-1,FGF-1)通过磷脂酰肌醇3-羟基激酶(phosphatidylinositol 3-hydroxykinase,PI3K/Akt)刺激ApoE的合成,并依赖维甲酸X受体α(retinoid X receptor α,RXRα)诱导ApoE的表达,ERK通路的激活也可上调ApoE的表达[13]。ApoE基因表达还受到其胆固醇含量的调控,在人类THP-1巨噬细胞细胞中,胆固醇负荷使其ApoE合成量上调约15倍,这一过程是通过上调ApoE基因的表达实现[14]。Reardon等[15]发现干扰素(interferon,IFN)-γ可以减少ApoE的分泌,引起腹腔巨噬细胞胆固醇的积累,促进As的形成。
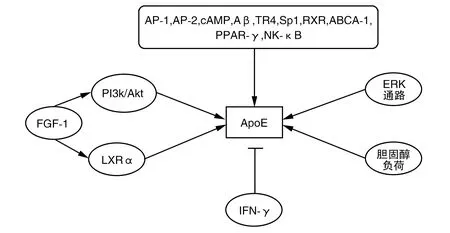
图2 ApoE的调控↑代表上调表达,⊥代表下调表达。很多因子能显著上调ApoE的表达例如AP-1,AP-2,cAMP,Aβ,TR4,Sp1,RXR,ABCA-1,PPAR-γ,NK-κB,FGF-1。一些信号通路例如ERK通路也可上调ApoE的表达。值得注意的是,胆固醇负荷可上调ApoE的表达,而ApoE可以促进RCT降低胞内胆固醇。IFNγ下调ApoE的表达,减少ApoE分泌。
2.4 ApoE的功能
ApoE是LDLR的配体,也是肝细胞乳糜微粒(chylomicron,CM)残粒受体的配体,与脂蛋白代谢密切相关,能够参与胆固醇的流出及RCT,维持人体的胆固醇稳态,抑制As的发生。肝细胞分泌的ApoE大多数与极低密度脂蛋白(very slow density lipoprotein,VLDL)颗粒有关,介导清除脂解产生的肠源性脂蛋白残留物[16]。冷暴露降低血清胆固醇同样依赖ApoE的作用[17]。细胞内ApoE可能在生理或病理生理上调节多种细胞过程,包括细胞骨架的组装和稳定、线粒体的完整性和功能以及树突的形态和功能[3]。ApoE可以将巨噬细胞表型从促炎M1型转变为抗炎M2型,抑制CD4+和CD8+淋巴细胞,减少白细胞介素(interleukin,IL)-2的产生,从而发挥抗炎作用。ApoE还具有抗氧化性,可以调节各种分子的水平[18]。
3 ApoE与胆固醇逆向转运
3.1 胆固醇逆向转运
RCT是指外周细胞的胆固醇通过血浆高密度脂蛋白(high density lipoprotein,HDL)进入肝脏,再经粪便排出的过程。外周组织细胞RCT包括三个连续的步骤:①外周组织细胞游离胆固醇(free cholesterol,FC)流出到HDL和(或)载脂蛋白A-Ⅰ(apolipoprotein A-I,ApoA-I)上;②HDL内FC受血浆卵磷脂胆固醇脂酰转移酶(lecithin-cholesterolacyltransferase,LCAT)酯化形成胆固醇酯(cholesterol ester,CE)并转移至HDL核心;③HDL内CE由肝细胞HDL受体家族成员(HDL recepter,HDLR)和(或)B族I型清道夫受体(scavenger receptor class B type I,SR-BI)摄取并在肝中被代谢。RCT的第一步是胆固醇的流出,巨噬细胞内的胆固醇脂滴通过自噬体转移到溶酶体,产生FC,FC转移到质膜,然后流出。胆固醇的流出有4种途径:简单扩散;SR-BI介导的扩散;在细胞外受体存在时,由ABCA1或三磷酸腺苷结合匣转运蛋白G1(ATP-binding cassette sub-family G member 1,ABCG1)介导的胆固醇流出。前两者为被动过程,后两者则为主动运输过程。胆固醇的外流需要细胞外低脂受体的参与,主要是ApoA-Ⅰ,也有含较少FC的新生HDL[4]。流出的胆固醇与细胞外低脂受体相结合形成新生的高密度脂蛋白,并在LCAT的作用下酯化,酯化的胆固醇约20%进入HDL内核,80%转移至VLDL和LDL,自此RCT的第二步已完成。RCT的最后一步有两种途径,含有外流胆固醇的HDL可与SR-BI或HDL受体家族成员相结合,介导胆固醇进入肝细胞。此外,高密度脂蛋白中的胆固醇可以通过胆固醇酯转移蛋白(cholesterolestertransferprotein,CETP)的作用转移到含载脂蛋白B(apolipoprotein B,ApoB)的LDL/VLDL中,LDL通过LDLR结合介导胆固醇转移到肝细胞。含有ApoE的HDL与LDL都可以与特异的ApoE受体结合从而被肝细胞摄取。HDL中的胆固醇约70%在CETP的作用下转移至LDL,通过LDL受体途径在肝被清除,20%通过HDL受体在肝被清除,10%由特异的ApoE受体介导在肝被清除。一旦进入肝细胞,胆固醇就可以FC的形式转移到胆汁中或在转化为胆汁酸后通过粪便从体内排出[4](图3)。
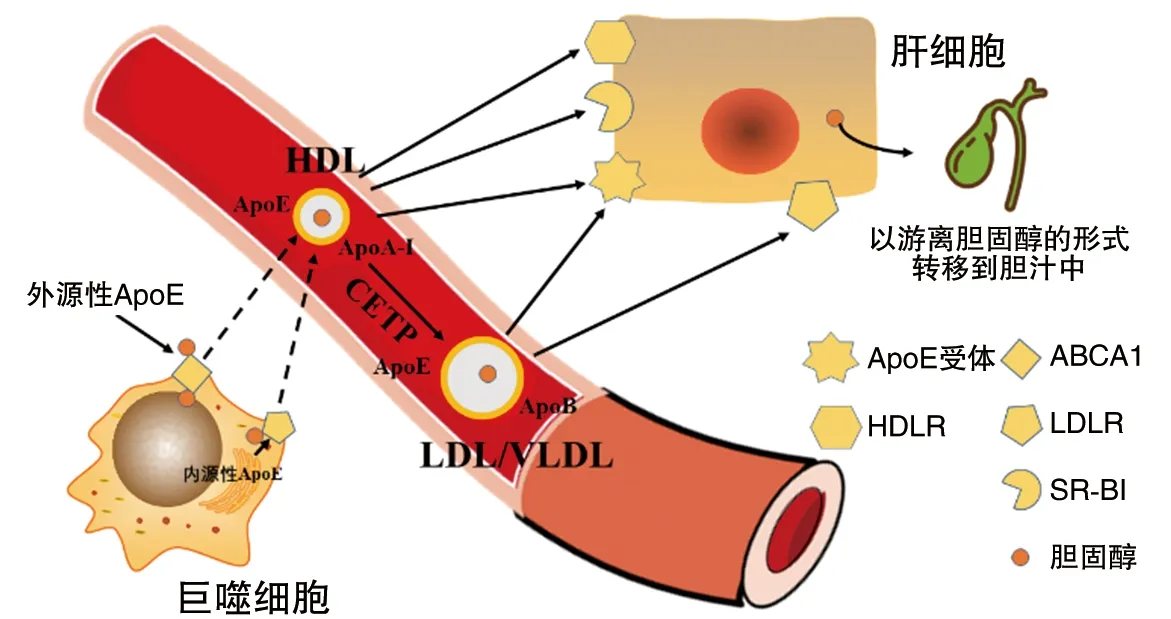
图3 ApoE与胆固醇逆向转运
ApoE促进RCT,外源性和内源性ApoE都能促进胆固醇从胆固醇负荷的巨噬细胞外流。内源性ApoE通过与细胞表面LDLR、蛋白聚糖和膜脂质结合促进胆固醇外流。外源性ApoE与ABCA1相互作用形成新生的盘状高密度脂蛋白,作为细胞外胆固醇低脂受体发挥作用。新生的盘状高密度脂蛋白与排出的胆固醇一起进入血浆,通过一些步骤结合到成熟的球形高密度脂蛋白颗粒中。HDL通过与SR-B1或HDLR相互结合并将胆固醇输送到肝细胞。此外,CETP可以识别LDL中的ApoE或ApoB,介导CE从HDL向LDL转移,同时HDL表面的部分ApoE也转移到LDL,新生的LDL与LDLR相互结合被肝细胞摄取。含有ApoE的HDL与LDL都可以与特异的ApoE受体结合从而被肝细胞摄取。
3.2 ApoE在RCT第一环节的作用
HDL通过巨噬细胞膜表面受体介导细胞胆固醇流出是防止血管内皮下胆固醇堆积最有效的方式[19],ApoE在这一过程中可能作为胆固醇受体发挥作用,表达ABCA1的HeLa细胞和J774细胞与人ApoE2、ApoE3和ApoE4 3种亚型蛋白共同孵育后刺激胆固醇的外流证明这一点。ApoE作为胆固醇受体的功能主要是由C-末端结构域实现的,N-末端四螺旋束区则是胆固醇流出相对较差的受体。在每个分子基础上,C结构域刺激胆固醇外流的效率与完整的ApoE相同,ApoA-1 N端结构域和ApoE C端结构域组成的嵌合分子,比完整的载脂蛋白和相互嵌合体更具胆固醇受体活性,这也表明ApoE C端结构域有促进胆固醇流出的能力[20]。上述实验皆是研究外源性ApoE对于胆固醇流出的作用,而内源性ApoE对于胆固醇流出的作用尚不可知。J774细胞一般不表达ApoE,然而在巨细胞病毒启动子的控制下,可以表达人体的ApoE3。使用这种修饰过的J774细胞实验,可以排除胆固醇介导ApoE基因表达上调的干扰,更好地观察内源性ApoE和外源性ApoE分别对胆固醇流出和细胞胆固醇稳态的影响,从而找到它们潜在的差异。通过使用J774+E细胞,Mazzone等[21-22]研究发现,内源性ApoE在促进固醇流出方面比外源性ApoE更有效。内源性ApoE的分泌是通过与细胞表面LDLR,蛋白聚糖和膜脂质结合,与质膜形成一种特殊的联系而完成的。减少内源性ApoE与这些细胞表面分子的联系,可以减少胆固醇的流出。然而,外源性ApoE与细胞表面没有观察到这种联系。在J774+E细胞中,研究人员还发现其胆固醇流出增加与ABCA1无关,这可能提示内源性ApoE介导胆固醇流出并不通过ABCA1途径。不同亚型的ApoE与LDLR结合能力不同,内源性ApoE与LDLR结合能力与其促进胆固醇流出的能力呈负相关,在巨噬细胞内3种纯合子亚型ApoE中,ApoE2促进胆固醇流出的能力比ApoE3和ApoE4强。由于外源性ApoE并不与LDLR相互作用,因此3种亚型外源性ApoE促进胆固醇流出的能力并无差异[4]。
3.3 ApoE在RCT第二、三环节的作用
ApoE除能促进胆固醇流出,也影响RCT的其他环节,在没有CETP的情况下,ApoE能够扩展HDL2的胆固醇负荷,从而运载更多的胆固醇至肝脏,分泌到胆汁中去[23]。将HDL2中的ApoE去除,这种扩展作用消失。Zanotti等[24]首次证明,ApoE在体内对巨噬细胞RCT有显著的贡献,并且这一作用完全归因于ApoE在巨噬细胞中的表达。这一结论是通过分别向野生型小鼠和ApoE-/-小鼠注射胆固醇负载野生型小鼠腹腔巨噬细胞(高表达ApoE)与胆固醇负载ApoE-/-小鼠腹腔巨噬细胞得到的,注射胆固醇负载野生型小鼠腹腔巨噬细胞的小鼠胆固醇逆向效率显著提高,动脉壁上巨噬细胞是否也符合这一结论目前仍不清楚。在ApoE与疾病之间的关系研究领域近年来研究并不深入,大规模人群研究表明,ApoE4等位基因携带者患As风险增加1.7倍[25]。ApoE血浆水平与不同的死亡原因有关:高ApoE水平与心血管疾病和癌症死亡有关,而低ApoE水平与痴呆症相关死亡有关。这可能是因为患有心血管疾病的患者需要更高的ApoE水平降低血浆胆固醇,减缓病程进展[26]。
总之,无论是内源性ApoE还是外源性ApoE,它们在RCT过程中都起着重要作用,这些作用不局限于RCT某一环节,缺乏ApoE将严重降低RCT效率从而引起As发生。
4 ApoE模拟肽
基于对ApoE促进RCT机制的研究,研发ApoE模拟肽类药物成为治疗As等疾病的一种新思路。ApoE模拟肽类药物目前正在进行临床前和临床评估,取得非常好的试验效果,具有广阔的发展前景[27]。如上所述,ApoE刺激胆固醇流出的功能主要是由C结构域实现的,基于这一认识,研究人员将C结构域便作为开发ApoE模拟肽的基础,每个模拟物包含26个氨基酸。ATI-5261是研发出来的第一种ApoE模拟肽,虽然这种肽在体内可以促进巨噬细胞胆固醇的流出及逆向转运,减少ApoE-/-老鼠As的发生,但表现出肌肉毒性[28]。CS-6253作为新型ApoE来源的ABCA1激动肽,它与ATI-5261有着相似的作用,但它没有肌肉毒性[29]。ApoE模拟肽通过与LDLR和(或)热休克蛋白相互作用,介导肝脏从循环中清除致As的ApoB,也具有增强HDL介导巨噬细胞胆固醇外流、减轻炎症和抑制As发展的能力,同时ApoE模拟肽诱导巨噬细胞胆固醇外流的效率与天然ApoE3和ApoA-I相似,甚至更高[27]。Ac-hE18A-NH2可以降低动物模型中的血浆胆固醇,并表现出抗炎特性,是目前治疗血脂异常的理想药物,正在进行I期临床试验[30]。研究发现,ApoE模拟肽COG1410不仅可以减少蛛网膜下腔出血后的血脑屏障的破坏,在早期脑损伤中提供神经保护[31],还能减轻缺血性脑卒中的血脑屏障损伤[32]。COG1410治疗还明显改善早期脑损伤后的前庭运动功能和葡萄糖摄取功能,并使损伤周围和同侧半球的血管内皮生长因子生成减少,从而发挥神经保护作用[33]。同时COG1410还对耐药性鲍曼不动杆菌表现出较强的抑菌活性[34]。ApoE模拟肽除拥有抗As、抗炎与抗菌的作用外,还表现出抗肿瘤作用,许多临床前研究表明,载脂蛋白模拟物在癌症动物模型中具有治疗作用[35]。ApoE模拟肽还可以参与免疫调节,改善哮喘的疾病进展[36]。ApoE模拟肽功能的多态性与ApoE本身功能多态性有着密不可分的关系。
总体而言,ApoE模拟肽的研究正在迅速发展。除天然ApoE所具有的功能外,ApoE模拟肽还能提高HDL的水平与功能,显著降低血浆胆固醇水平,其抗炎与抗氧化的功能使其具有极佳的抗As的特性。大量的临床前与临床研究都支持ApoE模拟肽具有不错的治疗效果,可以预测ApoE模拟肽即将成为心血管疾病防治的重要候选药物。
5 小结与展望
总的来说,ApoE可以促进胆固醇的流出及RCT,降低患As的风险。在特定环境(细胞培养与体内培养)和特定细胞类型中,ApoE也可以影响胆固醇外流和RCT。在这些情况下,巨噬细胞胆固醇负荷在调节ApoE转录中的作用还没有完全阐明。大多数研究都使用了放射性标记的胆固醇,但并不能探索巨噬细胞中完整的胆固醇稳态。将不同组织来源的巨噬细胞在体内包埋在藻酸盐胶囊中,可能成为探索这些问题的可行方法。ApoE模拟肽类药物是治疗As和AD等疾病的理想药物,虽然ApoE模拟肽常表现出肌肉毒性,ApoE模拟肽在体内减少As等疾病发生的确切机制尚不明确,但新型ApoE模拟肽已经成功解决肌肉毒性问题并且具有天然ApoE不具备的作用。种种趋势表明,ApoE模拟肽具有非常好的发展前景。

