LVEF对STEMI合并non-IRA CTO患者PCI术预后的影响
李鹏鹏, 吕哲, 冯怡, 代传忠
1.聊城市人民医院,山东聊城 250004;2.聊城市第四人民医院,山东聊城 252002
ST段抬高心肌梗死(ST segment elevation myocardial infarction,STEMI)指心电图具有典型ST段抬高的一类急性心肌梗死,目前临床上STEMI患者接受治疗后,其病死率控制并未达到理想水平[1-2]。左心室射血分数(left ventricular ejection fraction,LVEF)降低与STEMI高病死率和心血管风险增加相关[3]。有研究表明,急性冠状动脉综合征患者非梗死相关动脉(non-infarction relative artery,non-IRA)的慢性完全闭塞(chronic total occlusion,CTO)与不良预后相关[4-5]。然而,合并non-IRA CTO的STEMI患者预后与LVEF关系的相关研究很少,本文对此进行了研究,现报道如下。
1 资料和方法
1.1 研究对象
选取本院2019年1月—2021年1月收治的130例STEMI患者,根据LVEF水平分为LVEF降低组(39例)和LVEF保留组(91例);根据是否合并non-IRA CTO每组分为CTO亚组和无CTO亚组。各组一般资料见表1。纳入标准:①经心电图和冠状动脉造影检查确诊为急性STEMI;②行急诊经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI);③PCI术后体力状态符合康复训练要求。排除标准:①年龄≥80岁;②陈旧性心肌梗死、严重心律失常、心力衰竭、心源性休克;③严重肝、肾、肺功能障碍;④3个月内有外伤史、手术史或急性脑血管病史;⑤未有效控制的高血压或主动脉夹层、室壁瘤;⑥肢体功能障碍、语言障碍,无法配合康复训练。本研究经本院医学伦理委员会批准,所有患者或家属均知情并签署知情同意书。
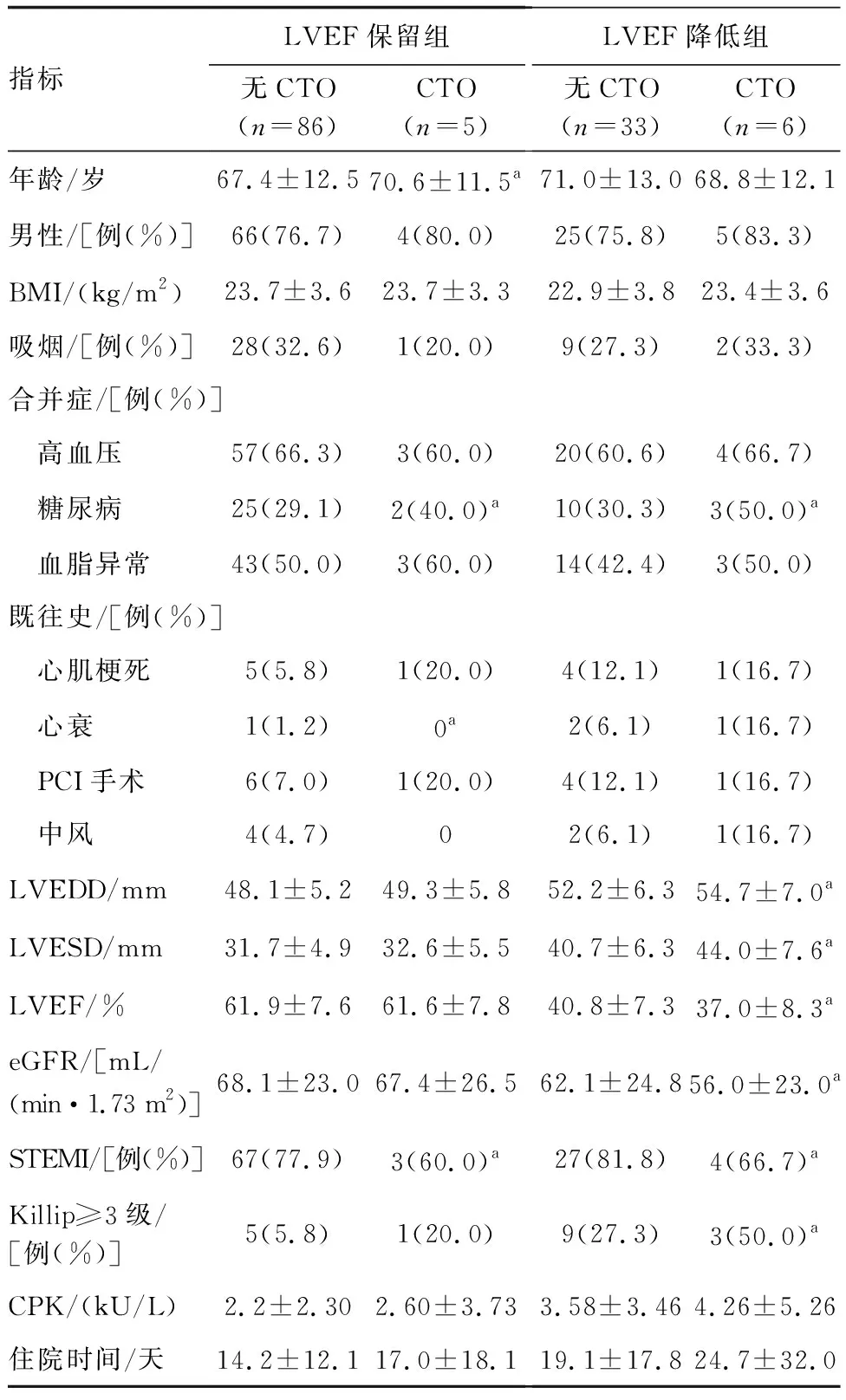
表1 各组一般资料的比较
1.2 non-IRA CTO的判定和LVEF的测定
non-IRA CTO被定义为非梗死相关冠状动脉(直径>2.5 mm)管腔出现狭窄程度>70%的病变,冠状动脉造影检查发现冠状动脉管腔中断,TIMI血流分级0或1级,可合并侧支循环[6]。区分CTO与亚急性或急性闭塞是基于闭塞的形态(没有新鲜血栓,存在桥、心外膜或隔膜侧支)以及既往心肌梗死病史。PCI手术成功与否被定义为残余狭窄<30%并且TIMI血流分级>2级。LVEF在心肌梗死发生后1周内采用双平面法经胸超声心动图测量。
1.3 术后随访
通过门诊或电话随访,收集并记录临床事件。随访中丢失的患者使用最后1次接触的数据进行审查。对所有患者进行1年全因死亡和主要心血管不良事件(major adverse cardiovascular event,MACE)的随访,MACE定义为心源性猝死、心肌梗死、冠状动脉旁路移植术、不稳定型心绞痛或心力衰竭再住院。
1.4 统计学方法
2 结 果
2.1 各组全因死亡、MACE的比较
随访期间11例(8.46%)患者死亡,16例(12.31%)患者发生MACE。LVEF降低组CTO者的全因死亡率和MACE率高于无CTO者(P<0.05);而LVEF保留组CTO者与无CTO者上述指标差异无显著性(P>0.05;图1)。LVEF降低组CTO亚组与无CTO亚组比较,全因死亡、MACE差异均有显著性(P<0.05;表2)。

图1 患者1年随访全因死亡率与MACE发生率的Kaplan-Meier曲线分析

表2 各组患者随访1年后全因死亡、MACE的比较
2.2 全因死亡、MACE的多因素Cox回归分析
在LVEF降低患者中,non-IRA CTO是全因死亡和MACE的独立预测因子(P<0.05;表3)。随访期间,LVEF降低组6例CTO患者有2例再次成功进行PCI手术(CTO-PCI),4例未尝试PCI手术或手术失败。LVEF保留组5例CTO患者中有1例再次成功进行PCI手术(CTO-PCI),4例未尝试PCI手术或手术失败。与未进行CTO-PCI组比较,LVEF降低组的CTO-PCI成功者的全因死亡率与MACE率更低(P<0.05;图2)。
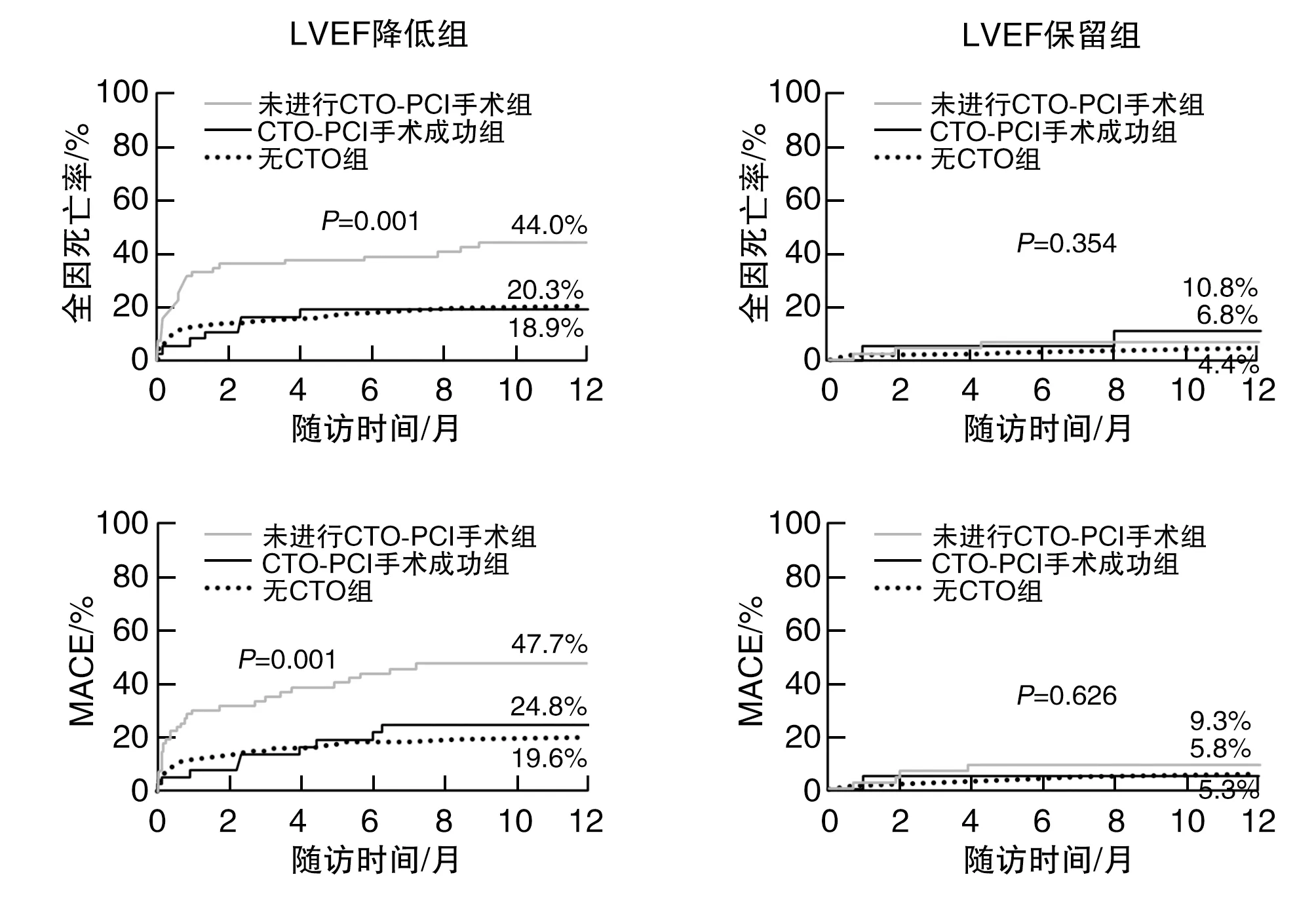
图2 无CTO患者、CTO-PCI组患者与无CTO-PCI组患者1年随访全因死亡率与MACE发生率的Kaplan-Meier曲线分析

表3 随访1年后全因死亡和MACE的多因素Cox回归分析
3 讨 论
STEMI患者是否存在non-IRA CTO对预后十分重要[7-8],LVEF是一项无创指标,住院期间可在床边通过超声心动图轻松获得,是STEMI患者接受PCI治疗的重要预后因素[9]。但很少有研究评估STEMI合并non-IRA CTO患者LVEF与预后的关系。本研究探讨了STEMI合并non-IRA CTO患者LVEF与预后的关系,结果表明:non-IRA CTO患者预后不良与LVEF降低显著相关;在LVEF降低组中,non-IRA CTO是全因死亡和MACE的独立预后因素,而对于LVEF保留组则不是预后因素;non-IRA CTO患者PCI手术成功与LVEF降低组患者的预后改善相关。既往有心肌梗死病史和入院时Killip分级是STEMI合并non-IRA CTO患者全因死亡率的独立预测因素,这些结果可能提示,CTO的预后影响可能取决于左室收缩功能障碍的程度[10]。
本研究发现,与LVEF保留组患者相比,LVEF降低组的CTO患者可能具有更高风险,且临床结局更差,因为这些患者往往有更高糖尿病患病率、既往心肌梗死史、入院时Killip分级为3或4级。在调整了这些基线特征的差异后,CTO的存在仍然是LVEF降低组中全因死亡率的独立预测因素。对于LVEF降低组的CTO患者预后不良的另一个解释可能是面临STEMI的双重危险:一方面正常由CTO供应的心肌部分维持在冬眠状态,由侧支血供应,一旦IRA闭塞,CTO段侧支充盈不良表明广泛缺血,而侧支充盈良好则表明IRA单支区域缺血;另一方面,若CTO区域依赖IRA侧支血流量,STEMI急性缺血区域将广泛扩展到双血管区域,这可能导致梗死面积增加,LVEF降低,导致更高病死率[11]。本研究中LVEF降低的CTO患者倾向于CTO节段侧支充盈更低,CTO心肌供血闭塞IRA发生率更高,肌酸磷酸激酶水平也更高。
此外,本研究结果还发现,LVEF引导的血管重建在不评估CTO区域心肌活力和缺血情况下,不一定适用于non-IRA CTO患者。与非闭塞性病变的PCI相比,这些手术成功率低,并发症发生率高,需要更长操作时间、更大造影剂量、更大辐射暴露和成本,因此对CTO病变是否PCI存在部分争议。越来越多证据表明,可以从缺血和CTO血管供应的心肌区域活力两方面评估病变,因为非存活心肌或非相关病变的血运重建与侵入性手术的直接风险相关,且不能保证长期受益[12-13]。本研究CTO病例中,non-IRA CTO的血供重建指征由医师综合考虑疾病史、心肌缺血及超声心动图、磁共振成像和靶血管解剖特征的复杂性等作出评估。
综上所述,LVEF能够为不同类型STEMI合并non-IRA CTO患者提供预后的评估。non-IRA CTO合并STEMI患者仅在LVEF降低组中与预后不良有关,而在LVEF保留组不相关;在non-IRA CTO患者接受PCI治疗中,LVEF降低组的全因死亡率和MACE率可能有所改善,但LVEF保留组的全因死亡率和MACE率没有改善。

