沉默lncRNA-UCA1对乏氧诱导NSCLC细胞A549放射抵抗的作用机制
宗斌, 房栋, 张文琪, 刘意
镇江市中西医结合医院科教部,江苏镇江 212004
肺癌是临床上常见的呼吸系统恶性肿瘤,其发病率、病死率和复发率都较高[1]。肺癌主要分为小细胞肺癌和非小细胞肺癌。临床上,放射治疗是非小细胞肺癌(non-small cell lung cancer,NSCLC)的一种重要辅助治疗手段,但由于NSCLC的异质性,产生了一定的放射抵抗,使放疗效果不容乐观[2]。研究表明,乏氧微环境是影响肿瘤产生放射抵抗的重要因素,激活缺氧诱导因子,影响肿瘤细胞损伤后的修复与耐受能力[3]。长链非编码RNA(long chain noncoding RNA,lncRNA)是一组长度大于200 bp的非编码蛋白质RNA[4]。尿路上皮癌相关基因1(urothelial carcinoma associated gen 1,UCA1)是在多种肿瘤中普遍表达的长链非编码RNA,参与肿瘤的发生发展[5]。UCA1在肿瘤治疗中耐药和放射抵抗方面发挥着关键作用,但lncRNA-UCA1对乏氧诱导NSCLC放射抵抗的作用及机制仍有待探索。本研究通过乏氧诱导裸鼠模型,siRNA调控UCA1的表达,探讨lncRNA-UCA1对乏氧诱导NSCLC放射抵抗的影响及潜在的机制。
1 材料和方法
1.1 试剂及仪器
非小细胞肺癌细胞株A549、H1650、H460和人正常支气管上皮细胞株HBE购自北京国家实验细胞资源共享服务平台。雄性BALB/C无胸腺裸鼠(SPF级,4~6周龄)购自北京维通利华公司。
DMEM细胞培养基、FBS和0.25%胰蛋白酶购自美国Gibco生物公司;青霉素、链霉素购自美国MCE生物公司;细胞周期试剂盒、细胞凋亡试剂盒购自上海碧云天生物技术公司;TRIzol试剂购自北京索莱宝科技有限公司;RNA提取试剂盒、Lipo2000购自美国Invitrogen公司;B细胞淋巴瘤-2(B cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X,BAX)、磷酸化蛋白质丝氨酸苏氨酸激酶(phosphorylated protein serine threonine kinase,p-Akt)及磷酸化雷帕霉素靶蛋白(phosphorylase mammalian target of rapamycin,p-mTOR)购自美国CST公司;lncRNA-UCA1 si-RNA购自上海吉凯基因化学技术有限公司。细胞恒温CO2培养箱购自德国Binder公司;细胞超净工作台购自广州禄米实验室设备科技有限公司;Novoexpress流式细胞仪购自美国艾森生物公司;Eclipse Ti-s倒置显微镜购自日本Nikon公司;凝胶成像系统、实时荧光定量PCR仪购自美国Bio-red公司。
1.2 细胞培养
10%FBS和1%青霉素、1%链霉素的DMEM培养基培养细胞,置于37℃、5%CO2饱和湿度培养箱中,隔天换细胞培养液。
1.3 细胞分组及处理
取对数生长期细胞接种于六孔板中,接种密度为1×105个/孔,设置3个复孔;置于常氧培养箱中继续培养,当细胞生长融合至60%~70%时进行实验。依据是否转染lncRNA-UCA1干扰序列,将细胞分为si-NC组(未转染)及si-RNA组(转染lncRNA-UCA1干扰序列)。lncRNA-UCA1干扰序列:正义链为5′-GCCATATGAAGACACCCTA-3′,反义链为5′-TTAATCCAGGAGACAAAGA-3′。细胞转染结束后进行乏氧培养,将在正常培养条件下生长稳定后的细胞转移至含1%O2、5%CO2、94%N2的培养箱中继续培养24 h[6-7],将乏氧培养后细胞置于线性加速器之下(剂量率为2 Gy/min),予以4 Gy的X射线照射,放射源距为100 cm[8]。
1.4 平板克隆形成实验
取处理后细胞置于常氧培养环境中2周,观察至肉眼可见细胞克隆形成,终止培养。4%多聚甲醛固定,0.25%结晶紫染色,流水清洗,置于烘箱中干燥。根据克隆个数,计算出各组平均致死量(D0)、准域剂量(Dq)、外推数(N)、放射增敏比(sensitive enhancement ratio,SER)。
1.5 qRT-PCR检测lncRNA-UCA1 mRNA表达水平
采用TRIzol试剂提取细胞总RNA,使用Takara反转录试剂盒反转录合成cDNA,使用Takara试剂盒SYBR Prime Ex Taq进行序列扩增。以β-actin为内参,β-actin上游引物为5′-ACATCCGTAAAGACCTCTATGCC-3′,下游引物为5′-TACTCCTGCTTGCTGATCCAC-3′,采用2-ΔΔCT法计算UCA1的表达水平。lncRNA-UCA1序列:上游引物为5′-ACGCTAACTGGCACCTTGTT-3′ ,下游引物为5′-TGGGGATTACTGGGGTAGGG-3′, β-actin序列:上游引物为5′-ACATCCGTAAAGACCTCTATGCC-3′,下游引物为5′-TACTCCTGCTTGCTGATCCAC-3′。
1.6 流式细胞术检测细胞周期及凋亡率
取处理后细胞种于六孔板中(1×105个/孔),设置3个复孔,使用0.25%胰酶消化中和收集细胞,5 000 r/min离心5 min,弃掉上清,加入PBS缓冲液洗涤细胞,5 000 r/min离心5 min,弃掉上清,加入预冷的70%乙醇,在旋涡振荡器上轻柔混匀,置于4 ℃环境中固定24 h;1 000 r/min离心5 min,PBS缓冲液重悬洗涤细胞,5 000 r/min离心5 min,使用流式细胞仪检测细胞周期及细胞凋亡率。
1.7 Western blotting检测BAX、Bcl-2、p-Akt、p-mTOR及β-actin蛋白含量
将RIPA蛋白裂解液加入细胞中,冰上放置充分裂解15 min;收集细胞后超声破碎,4 ℃、12 000 r/min低温高速离心20 min,提取蛋白液;采用BCA法定量蛋白含量。采用10%SDS-PAGE凝胶电泳2 h,转印至PVDF膜1.5~2.0 h,封闭液封闭2 h,加入1∶1 000一抗,4 ℃环境下孵育过夜;TBST缓冲液清洗,二抗孵育2 h,TBST缓冲液清洗,使用Rio-red凝胶成像系统曝光显影。
1.8 裸鼠成瘤实验
取对数生长期si-NC及si-RNA转染的A549细胞100 μL(1×107个/mL),分别接种于裸鼠(5只/组)右侧腋窝皮下,根据接种细胞的不同分为si-NC组及si-RNA组。各组接种后,隔天称量裸鼠体质量并记录。第7天时,裸鼠皮下接种处观察到肉眼可见的结节;第15天时,裸鼠皮下接种处观察到皮肤表面有明显不规则肿块,予以4 Gy X-射线照射成瘤位置,继续正常饲养1周;第20天颈椎处死法处死裸鼠,完整剥离瘤体,游标卡尺测量瘤体最大直径,称量、拍照、记录。
1.9 统计学分析
使用GraphPad Prism 8.0版本统计软件进行实验数据统计,计数资料采用χ2检验,计量资料采用t检验。P<0.05为差异具有统计学意义。
2 结 果
2.1 不同NSCLC细胞对放射的敏感性
平板克隆实验结果显示,HBE细胞D0、Dq、N、SER值显著低于A549、H1650、H460细胞(P<0.05;表1),提示NSCLC细胞A549、H1650、H460存在放射抵抗,由于A549细胞在放射生物参数中差异最明显,故选用A549作为后续实验细胞。
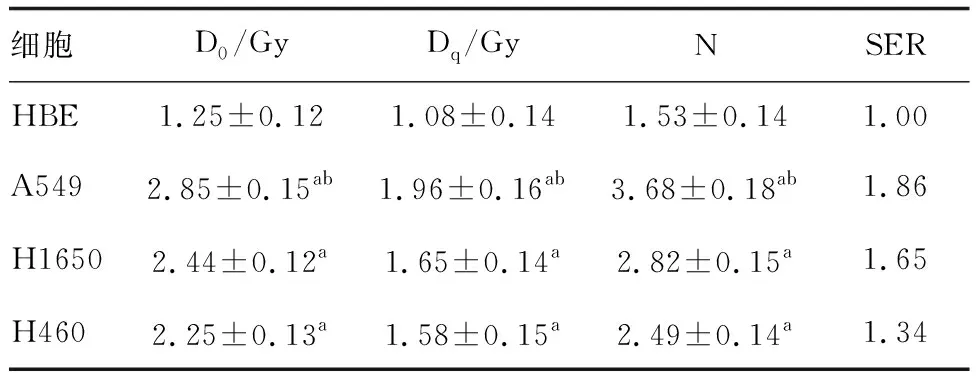
表1 不同NSCLC细胞对放射的敏感性
2.2 不同NSCLC细胞中常氧和乏氧状态下lncRNA-UCA1的表达水平比较
在常氧(常氧组)和乏氧(乏氧组)环境中分别处理细胞后,qRT-PCR检测结果显示,细胞A549、H1650、H460在乏氧状态下lncRNA-UCA1的表达水平显著高于常氧状态下(P<0.05;表2);提示乏氧促进lncRNA-UCA1的表达,故后续考察乏氧状态下沉默lncRNA-UCA1对A549细胞的影响。

表2 不同NSCLC细胞中常氧和乏氧状态下lncRNA-UCA1的表达水平比较
2.3 沉默lncRNA-UCA1对A549细胞放射敏感性、细胞周期及凋亡率的影响
平板克隆实验及细胞周期结果显示,与si-NC组比较,si-RNA组D0、Dq、N值显著降低,G2期细胞比例下降(P<0.05),细胞凋亡率显著增加(P<0.05;表3)。

表3 A549细胞放射敏感性、细胞周期及凋亡率变化
2.4 沉默lncRNA-UCA1对A549细胞Bcl-2、BAX、p-Akt及p-mTOR蛋白含量的影响
Western blotting蛋白印迹结果显示,与si-NC组比较,si-RNA组p-mTOR、p-Akt、Bcl-2表达水平显著下调,BAX表达水平显著上调(P<0.05;图1)。
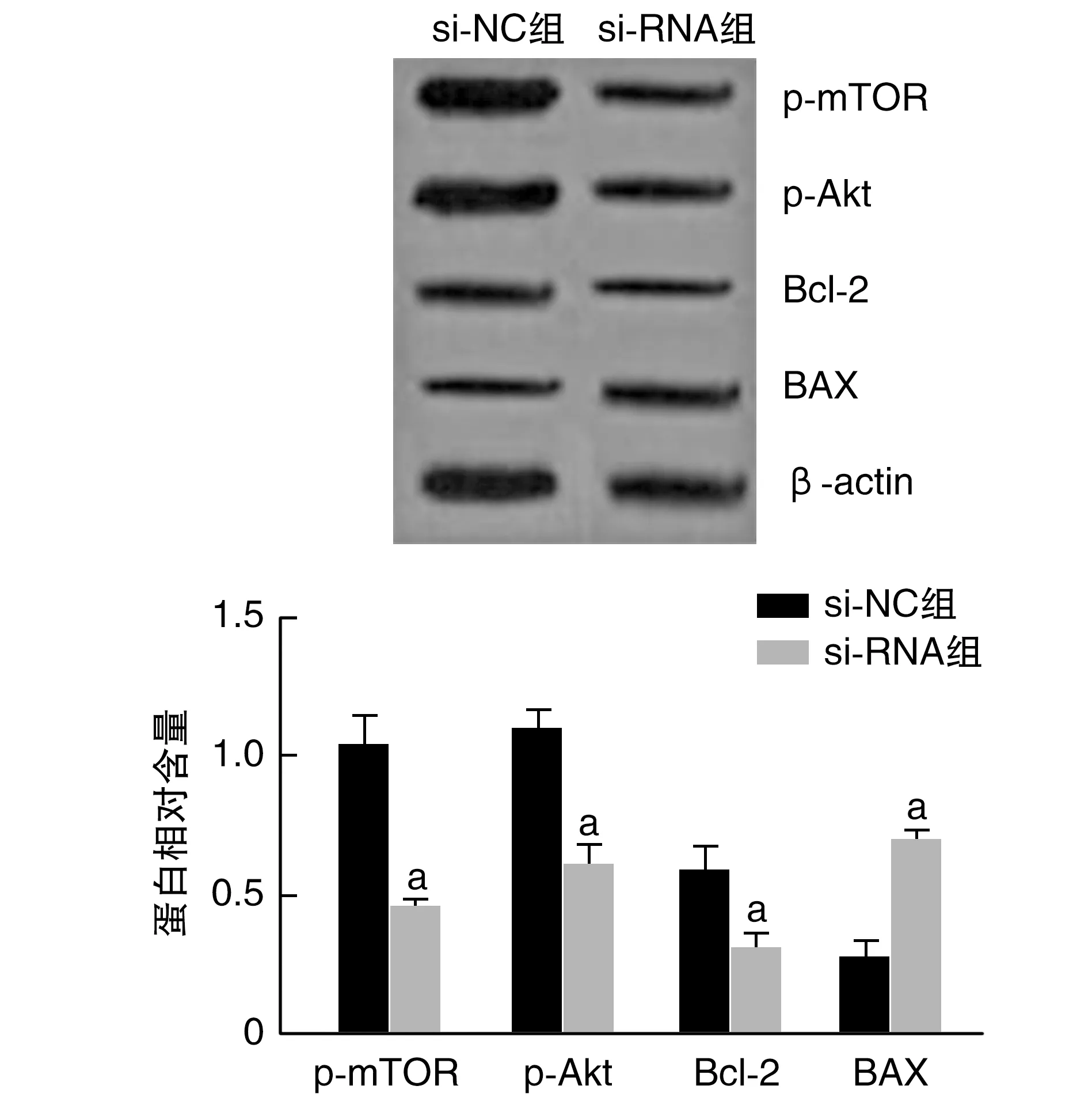
图1 Bcl-2、BAX、p-Akt及蛋白相对含量1为β-actin;2为p-Akt;3为p-mTOR;4为Bcl-2;5为BAX。a为P<0.05,与si-NC组比较。
2.5 裸鼠成瘤能力
结果显示,与si-NC组比较,si-RNA组肿瘤增殖变慢,肿瘤的体积明显缩小(P<0.05;图2)。
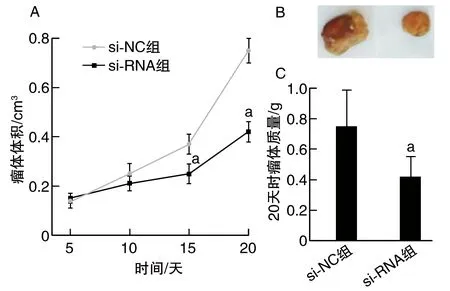
图2 lncRNA-UCA1对裸鼠成瘤能力的影响A为瘤体体积;B为lncRNA-UCA1对裸鼠成瘤瘤体形态;C为20天时瘤体质量。a为P<0.05,与si-NC组比较。
3 讨 论
NSCLC对化疗药物不敏感,故放射治疗是其主要的治疗方法[9-10]。由于肿瘤异质性和其乏氧微环境下产生放射抵抗,对治疗效果产生不良影响,引起预后不良和高复发率,因此,积极探索肿瘤的放射抵抗对临床肿瘤治疗具有重要意义。
研究表明,lncRNA-UCA1在肿瘤中呈异常表达,其参与肿瘤的发生发展,影响肿瘤的放射敏感性[11]。Fotouhi等[12]研究表明,UCA1的缺失会诱导辐射敏感性、降低增殖能力并破坏细胞周期进程,这可能是通过改变Akt信号和诱导细胞周期在G2/M过渡时停止而发生的。研究发现,lncRNA-UCA1通过激活PI3K/Akt途径降低人宫颈癌细胞放射增敏性;经X射线照射前后,lncRNA-UCA1在大肠癌放射抵抗细胞CCL244中差异性表达,影响细胞的放射敏感性[13]。本研究结果表明,lncRNA-UCA1通过激活Akt/mTOR信号通路调控A549细胞的放射抵抗。
细胞周期的调控极其复杂。肿瘤在放射化疗后引起肿瘤细胞DNA损伤,从而影响细胞周期和修复机制的启动[14]。沉默lncRNA-UCA1可以逆转放射诱导的周期阻滞,增加A549细胞的放射敏感性。细胞凋亡是高度保守的程序性死亡,在组织和细胞的发育过程中维持多细胞生物内环境的稳态[15]。外源性死亡受体依赖途径和内源性线粒体依赖途径是最具有特征的凋亡通路,Bcl-2家族蛋白是公认的凋亡调控因子,Bcl-2和BAX是主要的效应因子,与细胞的凋亡进程密切相关[16]。沉默lncRNA-UCA1后,细胞凋亡率显著增加,抗凋亡蛋白Bcl-2表达显著下调,促凋亡蛋白BAX表达显著上调,从而促进放射诱导细胞凋亡,增加A549细胞的放射敏感性。
Akt/mTOR信号通路是肿瘤发生的内在因素,Akt蛋白对正常细胞和癌细胞的增殖生长至关重要,其下游蛋白mTOR在细胞过程中也发挥着不可或缺的作用[17]。研究表明,Akt/mTOR通路广泛参与肿瘤的发生发展和放射抵抗[18]。Bamodu等[19]研究发现,PDK1表达上调激活PI3K/Akt/mTOR信号通路促进肝癌的辐射抵抗和去分化表型,为放射抵抗的肝癌患者提供了潜在的治疗方法。Tan等[20]研究表明,依鲁替尼联合放射诱导G2/M阻滞和细胞凋亡,靶向激活EGFR/Akt/mTOR信号通路从而提高胰腺癌细胞对放射治疗的敏感性。沉默lncRNA-UCA1能下调细胞体内和体外的p-Akt和p-mTOR蛋白表达。
综上所述,沉默lncRNA-UCA1通过激活Akt/mTOR通路抑制NSCLC A549细胞的放射抵抗,增加其放射治疗敏感性。

