非生物胁迫下青花菜LncRNA内参基因的筛选
裴徐梨 焦鹏 荆赞革 杞如春 王定康 唐征

摘 要 长链非编码RNA在植物抵御逆境胁迫中起着重要作用。适宜的内参基因是准确评价其表达水平的基础。本研究利用实时荧光定量PCR技术检测16个青花菜LncRNAs表达水平,并通过geNorm、NormFinder、BestKeerper软件进行表达稳定性分析。结果表明:青花菜的16个LncRNAs在不同逆境胁迫下表达稳定性存在差异。其中在弱光胁迫条件下, XLOC_000400表达最稳定;在低温胁迫条件下 XLOC_030832基因稳定性最好;在干旱和渍水胁迫条件下最稳定表达的内参基因分别是 XLOC_007087和 XLOC_012179;高温和盐胁迫处理下最稳定表达的内参基因均为 XLOC_007980。 XLOC_010342和 XLOC_007980在青花菜不同逆境胁迫下的表达稳定性较好。研究结果可为准确定量青花菜不同逆境胁迫下的LncRNAs提供合适的内参基因。
关键词 青花菜;内参基因;长链非编码RNA;非生物胁迫
长链非编码RNA(Long Non-coding RNA,LncRNA)是一类长度大于200 bp的内源RNA,可参与植物成花转变、花粉发育、逆境胁迫响应等多种生物学过程。扎桑等[1]在对2个青稞品种进行盐碱胁迫过程中获得了6 704条LncRNAs,同时发现不同阶段的盐碱胁迫中有不同的lncRNAs参与胁迫应答;许欣[2]在盐胁迫刚毛柽柳LncRNA转录组测序分析后,发现在胁迫过程中lncRNA对差异表达基因的调控起重要作用;分析黄瓜响应高温胁迫时发现一些lncRNAs可通过调控基因表达来响应胁迫[3];除此之外,在新疆杨中鉴定了10 531个lncRNA,发现在盐胁迫下有60%的lncRNA参与了胁迫应答的过程[4]。
实时荧光定量PCR(qRT-PCR)是基因表达分析研究中应用最为广泛的方法之一。然而qRT-PCR的使用还存在一些问题,如在基因表达相对定量时,需要有适宜的内参基因作为标准来衡量目标基因的表达水平,从而确保试验结果准确。
内参基因表达的稳定性在不同品种、不同逆境胁迫或是不同组织器官中表达的稳定性不尽相同。再加上同mRNA相比较,LncRNAs表达量更低,因此选择编码蛋白的基因作为内参来研究LncRNA的表达量,就不一定能很準确地反映其表达水平的高低。试验前期课题组对青花菜高温和盐胁迫LncRNAs进行了高通量测序,基于FPKM法计算的表达水平,从中筛选出多个表达较稳定的LncRNAs作为候选内参基因,利用实时荧光定量PCR技术并运用geNorm、Normfinder和BestKeeper软件对青花菜不同非生物胁迫下的表达稳定性进行分析。通过综合分析得到适宜的内参基因,研究结果可为青花菜不同非生物胁迫下LncRNAs的表达计算提供适宜的内参基因。
1 材料与方法
1.1 试验材料和胁迫处理
以青花菜自交系“KU19-3”为材料,放置于光照培养箱内进行培养。昼夜温度为25 ℃/18 ℃,光照周期为16 h/8 h。五叶期时进行非生物胁迫处理。胁迫处理如下:高温(40 ℃)、低温(4 ℃)、干旱(PEG 10%)、渍水(淹水高于基质表面)、弱光(30%光照度)、盐胁迫(100 mmol/L NaCl灌根),分别在处理后0、3、12和24 h取样。
1.2 总RNA提取和cDNA合成
提取的叶片总RNA经1%琼脂糖凝胶电泳检测其完整性,而后采用PrimeScriptTM 1st Strand cDNA Synthesis Kit试剂盒(TaKaRa公司)反转录成cDNA第一链。
1.3 引物设计
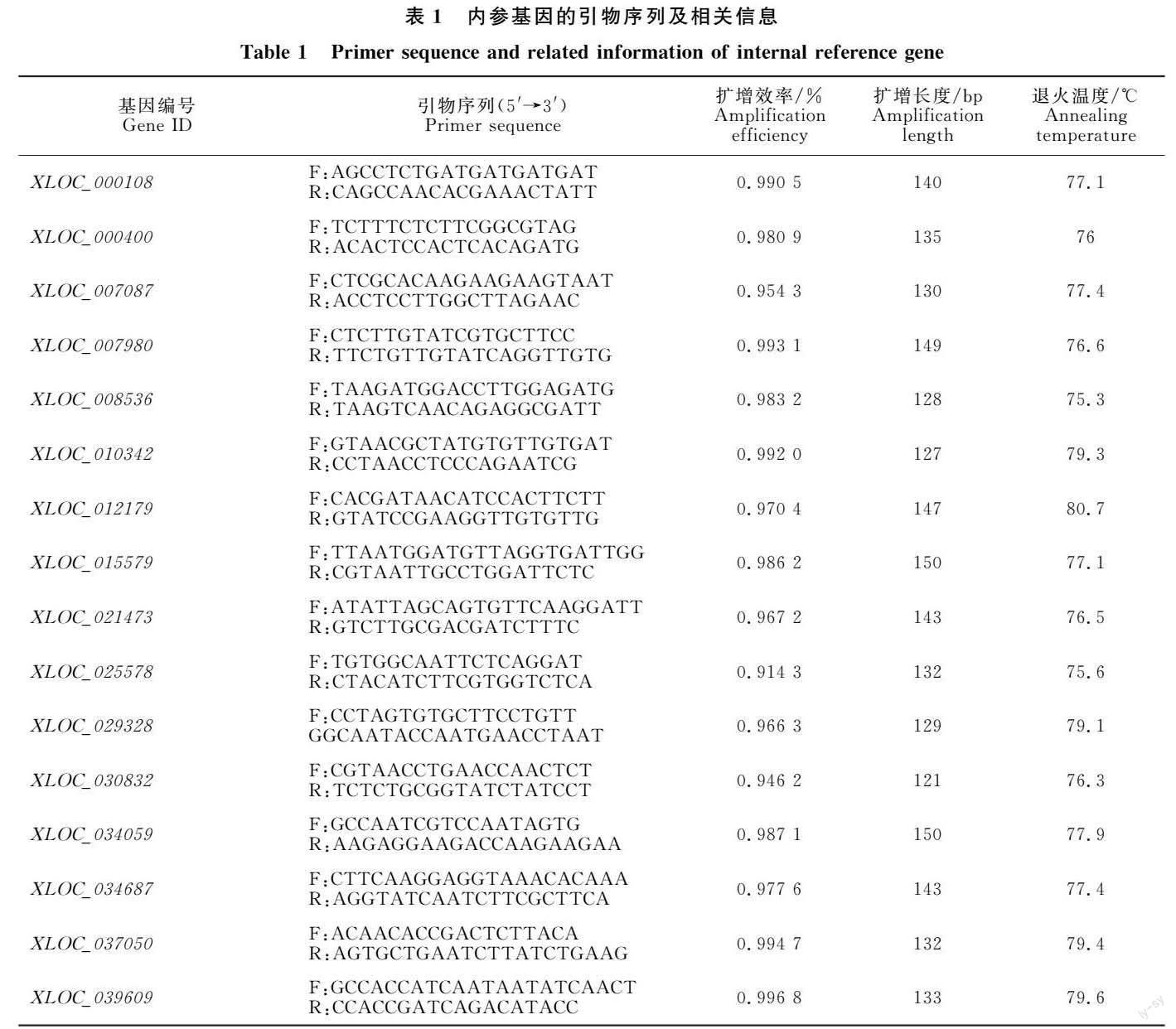
根据笔者课题组高温和盐胁迫LncRNA的测序结果(相关结果已发表在西北农业学报)筛选出16个表达较稳定的LncRNA,设计荧光定量引物(表1)。
1.4 荧光定量PCR和表达稳定性分析
qRT-PCR使用SYBR Premix Ex Taq试剂盒(TaKaRa公司)在ABI 7500(Applied Biosystems公司)上运行。反应体系和参数参照裴徐梨[5]的方法。利用geNorm、NormFinder和BestKeeper软件对候选LncRNA的表达稳定性进行分析。
2 结果与分析
2.1 LncRNA候选内参基因扩增特异性分析
对候选LncRNA内参基因进行熔解曲线分析,结果显示为单一峰(图1)。表明设计的引物扩增特异性好。
2.2 LncRNA候选内参基因稳定性评价
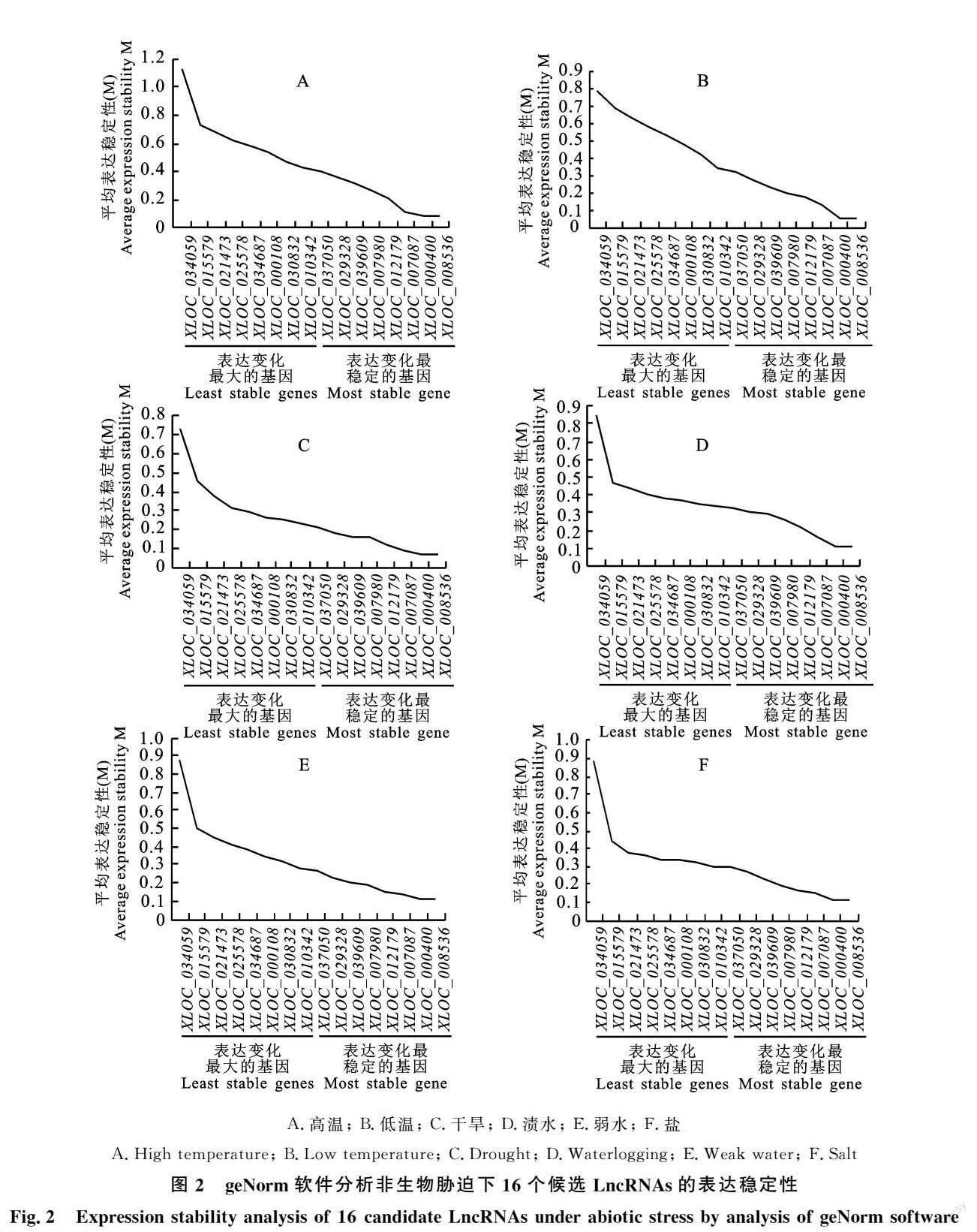
2.2.1 geNorm稳定性评价 从图2可以看出,高温胁迫下, XLOC_000400和 XLOC_008536的M 值最小,表达稳定性最好;低温胁迫下, XLOC_007980和 XLOC_008536表达稳定性最好;在盐胁迫下, XLOC_000108和 XLOC_000400表达稳定性最好;在渍水胁迫下, XLOC_007087和 XLOC_012179表达稳定性最好;干旱和弱光胁迫下均是 XLOC_007980和 XLOC_034687表达稳定性最好。而 XLOC_034059的M值在6种非生物胁迫中均较大,表现最不稳定。
2.2.2 NormFinder稳定性评价 由NormFinder软件评价结果可知,高温胁迫下 XLOC_007980和 XLOC_012179稳定值均为0.064,稳定性最好;低温胁迫下 XLOC_010342和 XLOC_025578稳定值(0.038)最小;干旱胁迫下 XLOC_021473和 XLOC_029328稳定值均为0.013,稳定性最好;渍水胁迫下 XLOC_012179和 XLOC_021473的表达最稳定,稳定值均为0.060;在弱光和盐胁迫下,表达最稳定的是 XLOC_000400,稳定值分别为0.047和0.049。 XLOC_034059的稳定值在6种胁迫下均最高,稳定性差(表2)。
2.2.3 BestKeeper稳定性评价 BestKeeper软件评价结果表明,高温胁迫下表达最稳定的是 XLOC_037050,其SD值为0.15;低温胁迫下 XLOC_012179 SD值为0.23,表达最稳定。 XLOC_034059在这两种胁迫下SD值最大,稳定性最差。渍水和盐胁迫下表达最稳定的分别是 XLOC_012179(SD=0.46)和 XLOC_007980 (SD=0.16),最不稳定的均为 XLOC_039609;弱光胁迫下 XLOC_010342表达最稳定,SD值为0.13, XLOC_007980(SD=0.68)表达最不稳定;干旱胁迫下 XLOC_015579(SD=0.15)表达最稳定, XLOC_030832表达最不稳定,SD值高达1(表3)。
2.2.4 LncRNA候选内参基因稳定性综合评价 通过geNorm、NormFinder和BestKeeper软件获得的最适内参基因有所差异,因此将数据进行综合分析。结果显示,在弱光胁迫条件下,最稳定的内参基因为 XLOC_000400;在低温胁迫条件下 XLOC_030832基因稳定性最好;在干旱胁迫和渍水胁迫条件下最稳定表达的内参基因分别是 XLOC_007087和 XLOC_012179;高温和盐胁迫处理下最稳定表达的内参基因均为 XLOC_007980。综上所述, XLOC_010342和 XLOC_007980为青花菜不同逆境胁迫下的LncRNAs准确定量的最适宜内参基因(表4)。
3 讨 论
植物内参基因通用性不是特别高。同一内参基因在不同的生长阶段、不同组织细胞、不同环境以及不同胁迫下,其稳定性也会有所不同。如内参基因 UBC18、 ACT2-1和 EF1a在毛竹实生苗中表达性较好,但在开花竹中稳定性较差[6]。在非生物胁迫下的番茄植株根和叶中,Actin表达稳定,茎中SAND基因表达稳定[7]。本研究对青花菜中多个LncRNA在非生物胁迫下的表达稳定性进行分析,结果发现 XLOC_000400弱光胁迫下表达稳定,而在渍水胁迫下其稳定性却较差; XLOC_007980也存在类似的现象,其在盐胁迫下表达稳定,而在渍水胁迫下表达最不稳定。试验结果表明,在筛选青花菜LncRNA内参基因时,其稳定性也表现出此现象。
内参基因在不同的试验条件或不同逆境处理下的表达是不恒定的[8]。在本试验中发现geNorm、NormFinder和BestKeeper的分析结果有较大差异,但也有共同点: XLOC_034059在所有环境胁迫中都表现极不稳定, XLOC_000108和 XLOC_039609在高温、干旱和盐胁迫下表现极不稳定。这些研究结果表明候选的青花菜LncRNAs在不同试验条件下的表达稳定性存在差异,所以针对不同非生物胁迫处理需选择适宜的内参基因。
参考文献 Reference:
[1] 扎 桑,王玉林,原红军,等.盐碱胁迫下青稞全转录组分析[J].西南农业学报,2021,34(7):1375-1385.
ZHA S,WANG Y L,YUAN H J,et al.Transcriptome analysis of tibetan hulless barley under salt-alkali stress [J].Southwest China Journal of Agricultural Sciences,2021,34(7):1375-1385.
[2] 许 欣.刚毛柽柳盐胁迫响应长链非编码RNA的鉴定及耐盐功能分析[D].哈尔滨:东北林业大学,2021.
XU X.Identification and Functional analysis of long noncoding RNA on salt tolerance of Tamaris hispida[D].Harbin:Northeast Forestry University,2021.
[3] 贺学英.黄瓜热胁迫响应lncRNAs、circRNAs和miRNAs的鉴定及ceRNA网络构建[D].南京:南京农业大学,2019.
HE X Y.Identification of heat-stress responsive lncRNAs,circRNAs and miRNAs and construction of ceRNA network in cucumber[D].Nanjing:Nanjing Agricultural University,2019.
[4] 馬建超.新疆杨基因组及其lncRNA响应盐胁迫的研究[D].兰州:兰州大学,2018.
MA J CH.Genome sequence of a widely cultivated poplar and its lncRNA response to salt stress[D].Lanzhou:Lanzhou University,2018.
[5] 裴徐梨 ,荆赞革,唐 征,等.青花菜花蕾发育miRNA荧光定量内参基因的筛选[J].基因组学与应用生物学,2021(2):1-11.
PEI X L,JING Z G,TANG ZH,et al.Selection of miRNA reference genes for quantitative RT-PCR in developmental bud of broccoli [J].Genomics and Applied Biology,2021(2):1-11.
[6] 齊飞艳,胡 陶,彭镇华,等.毛竹实时荧光定量PCR内参基因的筛选及成花基因 PheTFL1表达分析[J].西北植物学报,2013,33(1):48-52.
QI F Y,HU T,PENG ZH H,et al.Screening the reference genes for the studies of quantitative real-timeRT-PCR in tomato under abiotic stress[J].Acta Botanica Boreali-Occidentalia Sinica,2013,33(1):48-52.
[7] 韩晓雪,韩佳轩,姜 晶.番茄在非生物胁迫下实时定量RT-PCR中内参基因的筛选[J].分子植物育种,2015,13(4):822-831.
HAN X X,HAN J X,JIANG J.Screening the reference genes for the studies of quantitative real-time RT-PCR in tomato under abiotic Stress [J].Molecular Plant Breeding,2015,13(4):822-831.
[8] REMANS T,SMEETS K,OPDENAKKER K.Normalisation of Real- time RT-PCR gene expression measurements in Arabidopsis thaliana exposed to increased me tal concentrations[J].Planta,2008,227(6):1343-1349.
Abstract Long non-coding RNAs(LncRNAs) plays important role in plant resistance to stress.Appropriate reference genes are the basis to accurately evaluate their expression levels.In this study, real-time fluorescent quantitative PCR technology was used to detect the expression levels of 16 LncRNAs in broccoli, and their expression stability was analyzed by geNorm, NormFinder, and BestKeerper software.The results showed that 16 LncRNAs revealed diverse expression stability under different stresses in broccoli.Among them, XLOC_000400 was the most stable under low light stress; XLOC_030832 had the best stability under low temperature stress; the most stable reference genes under drought and waterlogging stress were XLOC_007087 and XLOC_012179, respectively; under high temperature and salt stress, the most stably reference gene was XLOC_007980.In conclusion, XLOC_010342 and XLOC_007980 have good expression stability under different stresses in broccoli.This study provides suitable reference genes for further research on the expression of LncRNAs under abiotic stresses in broccoli.
Key words Broccoli; Reference gene; Long non-coding RNA; Abiotic stress

