牦牛CCL14蛋白对HepG2细胞活性和凋亡的影响
梅群弟 李娟 王利

摘 要 旨在研究牦牛CCL14蛋白(Bos grunniens C-C motif chemokine 14 protein, BgCCL14)对HepG2细胞的影响和作用机制。将原核表达的BgCCL14蛋白与HepG2细胞共培养,利用CCK-8试剂盒检测细胞活性,平板克隆检测细胞克隆形成能力,细胞划痕检测细胞迁移以及荧光定量PCR检测相关基因的表达量。结果表明,1 μg/mL、10 μg/mL和20 μg/mL的BgCCL14蛋白均能显著降低HepG2细胞活性;20 μg/mL的BgCCL14蛋白对细胞增殖和迁移有极显著抑制作用;20 μg/mL的BgCCL14蛋白处理36 h极显著上调凋亡基因BAK和BAX 的mRNA水平,极显著降低 HIF1A、 PI3K和 CDK1基因的mRNA水平,显著降低mTOR基因 的mRNA水平。这表明BgCCL14蛋白可能通过促进细胞凋亡抑制肝癌细胞活性。
关键词 CCL14;HepG2细胞;凋亡
趋化因子是一类分子质量8~10 ku的分泌性蛋白,根据前两个半胱氨酸残基的位置可分为C、CXC、CC或CX3C 4 个亚家族[1]。CC基序趋化因子配体14(C-C motif chemokine 14 protein, CCL14)是一种小的分泌性蛋白,又被称为血滤液CC趋化因子1(HCC-1),根据其序列和结构同源性被确定为CC趋化因子家族成员[2-3]。 CCL14基因聚集在17q11.2號染色体[4-5],编码一种促进免疫细胞活化的趋化因子。 CCL14在血浆中浓度很高,且在脾、肝、骨骼肌、心肌、肠道和骨髓等正常组织中均有表达[6],与CCR1、CCR3和CCR5结合,发挥促进单核细胞、嗜酸性粒细胞和T淋巴母细胞的趋化等功能[7-9]。此外, CCL14在肿瘤中与肿瘤血管生成、侵袭以及肿瘤浸润的免疫细胞趋化等密切相关。 CCL14还被报道与多种人类癌症的预后相关,低水平的 CCL14 mRNA提示与包括肝癌、乳腺癌、肺癌和胰腺导管腺癌在内的几种癌症的预后较差[10]。通过基因过表达与敲除研究 CCL14对肝细胞癌(Hepatocellular carcinoma, HCC)细胞系增殖、迁移的影响[11],但CCL14蛋白的体外活性、对癌细胞的影响及机制的研究还未见报道。
HCC是最常见的恶性肿瘤之一,发病率和死亡率在世界范围内居于前列。HCC具有较高的疾病复发率,且多数肝癌患者存在预后较差的问题[12-13]。因此,深入了解肝癌发病的分子机制对于开发新的治疗方法以提高生存率至关重要。而牦牛作为中国西部高原的优质遗传牛种,是非常宝贵的资源库[14-15]。此前本实验室(西南民族大学动物分子遗传与育种实验室)已克隆了牦牛 CCL14基因,并选择pET-28a(+)载体进行原核表达,获得26 ku的重组蛋白。本研究采用肝细胞癌HepG2细胞系与原核表达的牦牛 CCL14重组蛋白(BgCCL14)共培养,研究CCL14对HepG2细胞活性、克隆形成及迁移的影响和作用机制,以期为抗癌机制研究和肝细胞癌的治疗积累基础资料。
1 材料与方法
1.1 材 料
1.1.1 试验细胞 肝细胞癌HepG2细胞系由成都医学院馈赠。
1.1.2 主要试剂 BgCCL14蛋白由西南民族大学动物科学国家民委重点实验室此前原核表达并冻存;反转录试剂盒Prime ScriptTM RT reagent Kit(Cat# RR047A)和TB Green TM Premix Ex TaqTM Ⅱ(Cat# RR820A)购自宝日生物技术(北京)有限公司;结晶紫染液(S19004)购自源叶生物有限公司;青霉素-链霉素溶液(E607011-0100)、DMEM培养基(E600003-0500)、胎牛血清(E510008-0100)、胰蛋白酶消化液(E607002-0100),CCK-8试剂盒(E606335-0250),以及荧光定量PCR所涉及的引物购自生工生物工程有限公司,具体引物信息见表1,部分引物参照石浩等[12]设计。
1.2 方 法
1.2.1 细胞分离培养 冻存的HepG2细胞于37 ℃水浴锅中迅速融化,吸取细胞悬液至15 mL离心管中,加入10 mL DMEM培养液混匀后1 000 r/min离心5 min,弃上清,沉淀用5 mL含有10% FBS的DMEM培养液重悬,加入到T25细胞培养瓶中培养。待HepG2细胞生长到80%~90% 覆盖率,用0.25%的胰酶对细胞消化后1 000 r/min离心5 min,弃上清液,沉淀重悬后用细胞计数仪计数,按对应的浓度将细胞加入相应的细胞培养板中,用于后续的试验。
1.2.2 CCK-8检测 消化传代的HepG2细胞按1×104个/孔接种于96孔板,置于37 ℃、5% CO2培养箱中培养过夜,待细胞达到80%~90%覆盖率左右换液,加入终浓度为0 μg/mL、1 μg/mL、10 μg/mL和20 μg/mL的BgCCL14蛋白(每个浓度设置复孔3 个)。在相同条件下培养24 h,加入10 μL CCK-8 Solution后37 ℃孵育,酶标仪检测波长450 nm处的吸光值。
1.2.3 细胞克隆形成试验 对数生长期的HepG2细胞消化传代后,以约1×103个/孔细胞的密度将细胞接种于6孔板中,加入终浓度为0 μg/mL和20 μg/mL的BgCCL14蛋白(每个浓度设置复孔3个),将细胞置于细胞培养箱中连续培养2周,弃除细胞培养液上清后,加入4%的多聚甲醛覆盖细胞,固定30 min左右,用无菌PBS洗涤2~3次,加入结晶紫对细胞染色10 min,用无菌水洗涤,晾干后拍照并计数。
1.2.4 细胞划痕试验 将细胞密度为5×105个/mL的HepG2细胞铺于24孔板上,加入含10%FBS的DMEM培养基培养24 h,直至长成单层细胞。用直尺和10 μL枪头对单层的肝癌细胞划线,呈“一”字划痕,划线完成的细胞用PBS缓冲液洗涤2~3 次,加入DMEM培养液,再加入终浓度为0 μg/mL和20 μg/mL的BgCCL14蛋白进行处理(每个浓度设置复孔3个)。相同条件下培养36 h,在倒置相差显微镜下观察肝癌细胞的迁移情况,并用Image J软件对迁移程度进行分析。
1.2.5 总RNA提取和cDNA的获得 取处理后的细胞,去除上清液,加入1 mL的Trizol溶液,用苯酚/氯仿/异戊醇的方法抽提细胞总RNA,使用Prime ScriptTM RT reagent Kit和反转录程序获得细胞cDNA。
1.2.6 荧光定量PCR检测 将消化传代的HepG2细胞以3×105 个/cm2的密度接种于6孔板内,37 ℃、5% CO2培养24 h后进行换液,向其中加入终浓度为20 μg/mL的CCL14蛋白,并设置未加任何细胞因子的对照组。将细胞在相同条件下培养12 h、24 h和36 h,分别在3 个不同时间段收集细胞,提取HepG2细胞RNA,反转录获得cDNA。以细胞cDNA为模板,GAPDH作为内参,检测BAK、BAX、 HIF1A、 PI3K、mTOR、 CDK1基因的mRNA水平。
1.2.7 数据分析 数据以“平均值±标准误”表示,细胞迁移情况采用Image J软件进行分析,荧光定量PCR相关基因表达量以GAPDH为内参基因,采用2-ΔΔCt法对数据进行处理。采用SPSS 26.0软件进行单因素方差分析(One-way ANOVA)分析显著性,“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)。
2 结果与分析
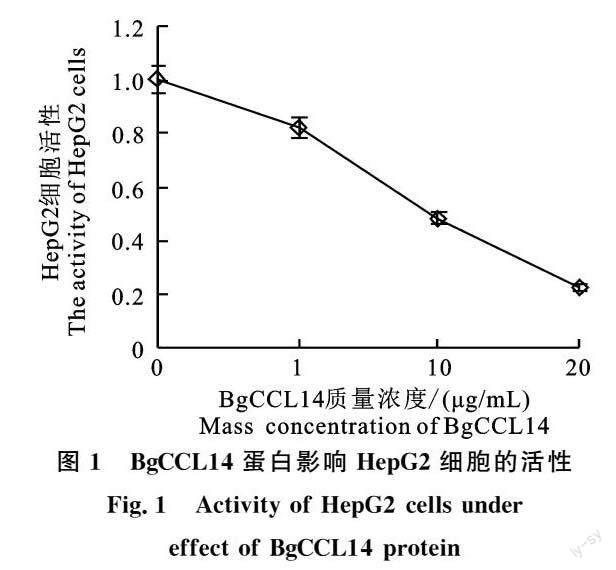
2.1 BgCCL14蛋白降低HepG2细胞活性
利用CCK8方法检测HepG2细胞在不同浓度BgCCL14蛋白处理下的细胞活性,结果发现(图1)HepG2细胞活性随BgCCL14蛋白的质量浓度增加而降低。HepG2细胞活性在1 μg/mL、10 μg/mL和20 μg/mL的BgCCL14蛋白处理下均受到抑制,在20 μg/mL的BgCCL14蛋白处理下活性最低,且3 个BgCCL14蛋白浓度处理下的HepG2细胞活性均显著低于0 μg/mL组。
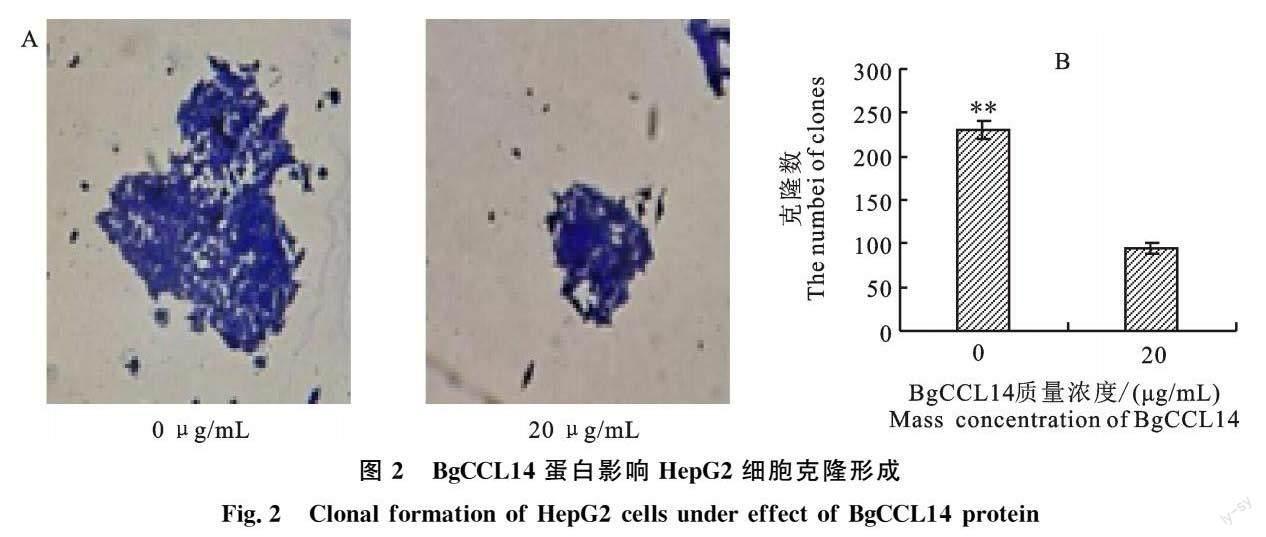
2.2 BgCCL14蛋白抑制HepG2细胞的克隆形成
經BgCCL14蛋白处理的HepG2细胞培养过后,用倒置相差显微镜进行拍照,并记录其克隆形成情况(图2),发现BgCCL14蛋白对肝癌细胞的克隆大小和克隆数量有一定的抑制作用,且BgCCL14蛋白处理的肝癌细胞数量极显著低于0 μg/mL组。
2.3 BgCCL14蛋白抑制HepG2细胞的迁移
对BgCCL14蛋白处理24 h的HepG2细胞进行迁移能力测定,计算其细胞的迁移率,结果发现经BgCCL14蛋白处理的肝癌细胞迁移率降低,极显著低于0 μg/mL组(图3)。
2.4 BgCCL14蛋白促进HepG2细胞凋亡
经20 μg/mL的BgCCL14蛋白处理12 h、24 h和36 h后,利用荧光定量PCR对HepG2细胞进行相关基因水平的检测,结果发现BAK基因在BgCCL14蛋白处理12 h、24 h和36 h的表达量均增加(图4),且12 h和36 h表达量均极显著高于0 μg/mL组。BAX基因表达量在BgCCL14蛋白处理12 h、24 h和36 h均增加,且12 h、24 h和36 h处理的表达量极显著高于0 μg/mL组。 HIF1A基因的表达量在CCL14蛋白处理12 h后极显著高于0 μg/mL组,24 h和36 h的表达量降低,且36 h的表达量极显著低于0 μg/mL组。 PI3K基因表达量在BgCCL14蛋白处理12 h、24 h和36 h后降低,且3 个时间段均极显著低于0 μg/mL组。mTOR基因的表达量在CCL14蛋白处理12 h、24 h和36 h后均降低,且36 h显著低于0 μg/mL组。 CDK1基因表达量在BgCCL14蛋白处理12 h、24 h 和36 h后均降低,且3 个时间段的表达量均显著低于0 μg/mL组。
3 讨 论
趋化因子主要参与调节细胞运输和控制血管生成参与感染和炎症期间的宿主反应,在免疫细胞到损伤和感染部位的募集和激活中起关键作用[1, 16-17],还与癌症的进展、侵袭和转移相关。作为肿瘤微环境的重要成员,趋化因子介导免疫细胞向肿瘤微环境的募集,直接或间接地参与肿瘤环境和免疫机制的形成,还可直接影响肿瘤细胞的生存和发展[18-19]。例如,CXCL9和CXCL10与卵巢癌、结肠癌患者肿瘤免疫细胞浸润、转移及生存率相关,裸鼠动物试验也证明它们具有抗肿瘤作用[20];CXCL8在肿瘤微环境中募集Treg细胞,参与肿瘤转移和侵袭[21];CCL7通过ERK/JNK通路影响肝癌细胞的侵袭和迁移[22];CXCL3调节乳腺癌细胞上皮-间质转化[23]等。
CCL14与CC家族其他的趋化因子一样,除了与机体免疫的发生相关,还参与癌症等许多疾病进展[24-26]。CCL14除在多种正常组织中表达外,也在癌组织中存在异常表达。CCL14在包括肝癌、乳腺癌、肺癌和胰腺导管腺癌等多种人类癌症组织中表达量明显低于正常组织,被确定为一种潜在的预后生物标志物[27]。肝癌中CCL14 mRNA水平与肿瘤浸润的免疫细胞类型和数量相关;过表达和敲除试验发现CCL14可抑制多种HCC细胞系的增殖活性和动物移植瘤模型的生长[11, 25, 28]。而本试验的BgCCL14蛋白也具有相同的作用,体外与HepG2细胞共培养使细胞活性、克隆形成和迁移能力降低。表明BgCCL14重组蛋白拥有与体内蛋白相似的性质,对肿瘤细胞有一定抑制作用。
目前关于趋化因子抗肿瘤的机制研究仍较少见,诱导肿瘤细胞凋亡是很重要的一种手段[29]。慢病毒载体过表达的CCL14可以通过抑制Wnt/β-catenin通路的激活而发挥促进肿瘤细胞凋亡,抑制癌细胞增殖的作用[30]。本试验中BgCCL14蛋白可显著上调HepG2细胞凋亡相关基因BAX、 BAK和 CDK1 mRNA 水平,BAX和BAK是BCL-2家族典型的凋亡促进基因,其蛋白质形式可以在线粒体膜形成膜孔,释放细胞色素C,诱导凋亡小体产生[31]; CDK1在有丝分裂、G2/M期检查点执行维护、细胞凋亡、细胞多能性和基因组稳定性维护等发挥重要作用[32-33]。 HIF1A由于在肿瘤中具有双向调控的作用,其基因水平在短时间内升高,随着时间增加而下调[34-35]。表明BgCCL14蛋白可能也通过凋亡途径抑制肿瘤细胞活性。同时存在通路相关基因 PI3K、mTOR下调的现象,PI3K/mTOR通路可能是BgCCL14促细胞凋亡的潜在机制。
综上所述,肝癌细胞HepG2与牦牛CCL14蛋白共培养,发现BgCCL14能够显著抑制HepG2细胞活性和上调凋亡相关BAX和BAK基因,并下调 PI3K、mTOR和 CDK1基因mRNA水平。这表明,BgCCL14可能通过促进凋亡抑制HepG2细胞的活性和增殖。
参考文献 Reference:
[1] ROLLINS B J.Chemokines[J].Blood,1997,90(3):909-928.
[2] SCHULZ-KNAPPE P,MGERT H J,DEWALD B,et al.HCC-1,a novel chemokine from human plasma[J].Journal of Experimental Medicine,1996,183(1):295-299.
[3] TSOU C L,GLADUE R P,CARROLL L A,et al.Identification of C-C chemokine receptor 1 (CCR1) as the monocyte hemofiltrate C-C chemokine (HCC)-1 receptor[J].Journal of Experimental Medicine,1998,188(3):603-608.
[4] NARUSE K,UENO M,SATOH T,et al.A YAC contig of the human CC chemokine genes clustered on chromosome 17q11.2[J].Genomics,1996,34(2):236-240.
[5] NOMIYAMA H,FUKUDA S,LIO M,et al.Organization of the chemokine gene cluster on human chromosome 17q11.2 containing the genes for CC chemokine MPIF-1,HCC-2,HCC-1,LEC,and RANTES[J].Journal of Interferon & Cytokine Research,1999,19(3):227-234.
[6] GU Y R,LI X Y,BI Y H,et al.CCL14 is a prognostic biomarker and correlates with immune infiltrates in hepatocellular carcinoma[J].Aging,2020,12(1):784-807.
[7] NAGARSHETH N,WICHA M S,ZOU W P.Chemokines in the cancer microenvironment and their relevance in cancer immunotherapy[J].Nature Reviews Immunology,2017,17(9):559-572.
[8] ZLOTNIK A,YOSHIE O.The chemokine superfamily revisited[J].Immunity,2012,36(5):705-716.
[9] KORBECKI J,KOJDER K,SIMISKA D,et al.CC Chemokines in a tumor:a review of pro-cancer and anti-cancer properties of the ligands of receptors CCR1,CCR2,CCR3,and CCR4[J].International Journal of Molecular Sciences,2020,21(21):8412.
[10] 李 奕.趨化因子CCL2、CCL3、CCL14调节巨噬细胞在多发性骨髓瘤归巢、增殖与分化中的作用及机制研究[D].杭州:浙江大学,2015.
LI Y.Chemokines CCL2,CCL3,CCL14 regulate microphage bone marrow homing,proliferation and polarization in mutiple myemola[D].Hangzhou:Zhejiang University School of Medicine,2015.
[11] ZHU M X,XU W Y,WEI CH Y,et al.CCL14 serves as a novel prognostic factor and tumor suppressor of HCC by modulating cell cycle and promoting apoptosis[J].Cell Death & Disease,2019,10(11):796.
[12] 石 浩,何小娥,丁仁惠,等. 油茶皂苷提取物对HepG2细胞凋亡的影响[J].食品科技,2020,45(8):180-186.
SHI H,HE X E,DING R H,et al.Effect of saponin extract from Camellia oleifera on apoptosis of HepG2 cells[J].Food Science and Technology,2020,45(8):180-186.
[13] 陈 祥,钱 程,曹雪涛.肝细胞癌的免疫逃逸和免疫治疗研究热点与发展趋势[J].中国肿瘤生物治疗杂志,2017,24(1):73-82.
CHEN X,QIAN CH,CAO X T.Hot points and development trend of research on the immune escape and immune therapy of hepatocellular carcinoma[J].Chinese Journal of Cancer Biotherapy,2017,24(1):73-82.
[14] 张思源,柴志欣,彭娅林,等.牦牛和犏牛 DDX25/GRTH基因序列及其在睾丸组织的表达水平[J].西北农业学报,2015,24(10):1-9.
ZHANG S Y,CHAI ZH X,PENG Y L,et al.Sequencing and expression of DDX25/GRTH mRNA in yak and cattle-yak testis[J].Acta Agriculturae Boreali-occidentalis Sinica,2015,24(10):1-9.
[15] 熊显荣,兰道亮,胡嘉嘉,等.IMPDH基因克隆、生物信息学分析及在牦牛卵巢不同时期中的差异表达[J].西北农业学報,2017,26(6):812-819.
XIONG X R,LAN D L,HU J J,et al.Cloning,bioinformatics analysis and differential expression of IMPDH gene in yak ovary at different stages[J].Acta Agriculturae Boreali-occidentalis Sinica,2017,26(6):812-819.
[16] YOSHIE O,IMAI T,NOMIYAMA H.Chemokines in immunity[J].Advances in Immunology,2001,78:57-110.
[17] LEGLER D F,THELEN M.Chemokines:chemistry,biochemistry and biological function[J].Chimia (Aarau),2016,70(12):856-859.
[18] BALKWILL F.Chemokine biology in cancer[J].Seminars in Immunology,2003,15(1):49-55.
[19] BALKWILL F.Cancer and the chemokine network[J].Nature Reviews Cancer,2004,4(7):540-550.
[20] ZHAO E D,MA J T,KRYCZEK I,et al.Cancer mediates effector T cell dysfunction by targeting microRNAs and EZH2 via glycolysis restriction[J].Nature Immunology,2016,17(1):95-103.
[21] KRYCZEK I,WANG L,WU K,et al.Inflammatory regulatory T cells in the microenvironments of ulcerative colitis and colon carcinoma[J].OncoImmunology,2016,5(8):e1105430.
[22] 陈对对,杨 强,叶 子,等.CCL7通过ERK/JNK通路影响肝癌细胞的侵袭和迁移[J].胃肠病学和肝病学杂志,2020,29(12):1341-1348.
CHEN D D,YANG Q,YE Z,et al.CCL7 promotes the migration and invasion of liver cancer cell via ERK/JNK pathway[J].Chinese Journal of Gastroenterology and Hepatology,2020,29(12):1341-1348.
[23] 李文燕,祝迪薇,顾艳玲,等.CXCL3/CXCR2调节乳腺癌细胞上皮-间质转化的作用机制研究[J].浙江医学,2021,43(3):254-259.
LI W Y,ZHU D W,GU Y L ,et al.Effect of CXCL3/CXCR2 on epithelial-mesenchymal transformation in breast cancer cell[J].Zhejiang Medical Journal,2021,43(3):254-259.
[24] HU Y T,YI W J,JIANG T T,et al.Serum proteins TGFBI,PCSK9,and CCL14 are potential biomarkers for different traditional Chinese medicine syndromes of multidrug-resistant tuberculosis.[J].Anatomical Record (Hoboken),2020,303(8):2131-2143.
[25] BLAIN K Y,KWIATKOWSKI W,ZHAO Q H,et al.Structural and functional characterization of CC chemokine CCL14[J].Biochemistry,2007,46(35):10008-10015.
[26] ELSNER J,FUCHS B,Blder R,et al.The CCL14 derivative NNY-CCL14 prevents the recruitment of eosinophils and lymphocytes and airway hyperresponsiveness in allergic airway inflammation[J].The Journal of Allergy and Clinical Immunology,2005,115(2):S66-S67.
[27] ZHANG X,WAN J X,KE Z P,et al.TMEM88,CCL14 and CLEC3B as prognostic biomarkers for prognosis and palindromia of human hepatocellular carcinoma[J].Tumor Biology,2017,39(7):784-807.
[28] GU Y R,LI X R,BI Y H,et al.CCL14 is a prognostic biomarker and correlates with immune infiltrates in hepatocellular carcinoma.[J].Aging,2020,12(1):784-807.
[29] 赵 燕,沈晓云.Mcl-1蛋白的抗凋亡作用与癌症治疗[J].生命的化学,2011,31(6):863-867.
ZHAO Y,SHEN X Y.Anti-apoptosis function of Mcl-1 protein and its role in cancer[J].Chemistry of Life,2011,31(6):863-867.
[30] ZHU M,XU W,WEI C,et al.CCL14 serves as a novel prognostic factor and tumor suppressor of HCC by modulating cell cycle and promoting apoptosis[J].Cell Death & Disease,2019,10(11):796.
[31] 王 江,魏曉丽,张爱华,等.Bax/Bak蛋白在凋亡通路中的调控与激活机制[J].生命的化学,2017,37(6):952-957.
WANG J,WEI X L,ZHANG A H,et al.Regulation and activation mechanisms of Bax/Bak proteins in apoptotic pathway[J].Chemistry of Life,2017,37(6):952-957.
[32] 艾平平,谈 顺.CDK1与结直肠癌的研究进展[J].临床与实验病理学杂志,2019,35(5):561-563.
AI P P,TAN SH.Advances in CDK1 and colorectal cancer[J].Chinese Journal of Clinical and Experimental Pathology,2019,35(5):561-563.
[33] 任 静,蒋孝华.Plk1和Cdk1在细胞周期和肿瘤中的研究进展[J].现代医药卫生,2016,32(6):872-875.
REN J,JIANG X H.Advances in the study of Plk1 and Cdk1 in cell cycle and tumor[J].Journal of Modern Medicine & Health,2016,32(6):872-875.
[34] 曾元莲,于少朋,胥 亦,等.中药调控HIF-1α抑制肝癌的研究进展[J].中药与临床,2020,11(2):65-70.
ZENG Y L,YU SH P,XU Y,et al.Research progress on the inhibition of liver cancer of traditional Chinese medicine through the regulation of HIF-1α[J].Pharmacy and Clinics of Chinese Materia Medica,2020,11(2):65-70.
[35] NAKAMURA K,KOMATSU M,CHIWAKI F,et al.SIM2l attenuates resistance to hypoxia and tumor growth by transcriptional suppression of HIF1A in uterine cervical squamous cell carcinoma[J].Scientific Reports,2017,7(1):14574.
Abstract The aim of this study is to study the effect of Bos grunnies C-C motif chemokine 14 protein (BgCCL14) on HepG2 cells and its mechanism.HepG2 cells were co-cultured with prokaryotic expressed BgCCL14 protein.The cell viability was detected by CCK-8 kit, the ability of cell clone formation was detected by plate clone, the cell migration was detected by scratch test ,and the expression of related genes was detected by qPCR.The results showed that BgCCL14 protein of 1 μg/mL, 10 μg/mL and 20 μg/mL significantly decreased the viability of HepG2 cells.And BgCCL14 protein of 20 μg/mL significantly inhibited cell proliferation and migration.In addition, BgCCL14 protein of 20 μg/mL extremely significant up-regulate the mRNA levels of apoptotic genes BAK and BAX in 36 h, and decreased mRNA levels of HIF1A, PI3K, and CDK1 genes.And the mRNA levels of mTOR also significantly decreased.So BgCCL14 may affect viability of HepG2 cells and promotes its apoptosis.This study will benefit for further study of the function of CCL14.
Key words CCL14; HepG2 cells; Apoptosis

