羊场疫苗联合免疫程序初探
王田田 徐伟 赵敏 张雅雅 王运航 刘刚 郝婷婷 敬晓棋 李河林
摘 要 为了简化免疫程序,提高工作效率,降低劳动成本,将4种不同疫苗组合联合免疫陕北白绒山羊,单独免疫组作对照。免疫接种后,观测疫苗联合使用的安全性,同时采用商品化试剂盒检测免疫后不同时间的抗体水平。结果显示,联合免疫组中所有试验羊在免疫后7 d观察期内,均未观察到任何不良反应,不论是2 种疫苗联合免疫组(口蹄疫灭活疫苗和羊快疫-猝狙-羔羊痢疾-肠毒血症四联干粉灭活疫苗与山羊痘活疫苗和山羊传染性胸膜肺炎灭活疫苗)、4 种疫苗联合免疫组(口蹄疫灭活疫苗、羊快疫-猝狙-羔羊痢疾-肠毒血症四联干粉灭活疫苗、山羊痘活疫苗和山羊传染性胸膜肺炎灭活疫苗)还是5种疫苗联合免疫组(口蹄疫灭活疫苗、小反刍兽疫活疫苗、羊快疫-猝狙-羔羊痢疾-肠毒血症四联干粉灭活疫苗、山羊痘活疫苗和山羊传染性胸膜肺炎灭活疫苗),组内每种疫苗免疫后不同时间抗体水平在检测期内与单独免疫每种疫苗的对照组所产生的抗体水平无显著差异,同时联合免疫组内每种疫苗之间未发现互相干扰现象。因此,联合免疫是安全有效的,结果可为羊场免疫程序的优化提供参考。
关键词 山羊;疫苗;联合免疫;免疫程序
当前羊产业正处于转型升级的巨大变革之中,正在从传统的放牧转向舍饲,从小规模散养转向规模化、集约化养殖,从传统的粗放式管理转向科学、精细化管理,随之而来的则是疫病防控的压力剧增。免疫疫苗是防控疫病的主要手段,现开发的疫苗多以单苗为主,为了确保疫苗使用后的免疫保护效果,每种疫苗需单独免疫。羊场需防控的主要疫病有口蹄疫、小反刍兽疫、羊传染性胸膜肺炎、羊痘和羊梭菌病等[1-2],至少需要使用前述5种疫病相应的疫苗,但由于不同疫苗的免疫保护期不同,如口蹄疫灭活疫苗(以下简称“口蹄疫疫苗”)和羊快疫、猝狙、羔羊痢疾和肠毒血症四联干粉灭活疫苗(以下简称“三联四防”)的免疫期均为6个月,山羊痘活疫苗和山羊传染性胸膜肺炎灭活疫苗(以下简称“传胸苗”)的免疫期均为12个月,而小反刍兽疫活疫苗(以下简称“小反刍兽疫疫苗”)的免疫期为3 a,为有效防控上述疫病,常规情况下,羊场需每隔6个月免疫1 次口蹄疫疫苗和三联四防(尤其是羔羊),每隔12个月免疫1 次山羊痘活疫苗和传胸苗,为了确保小反刍兽疫疫苗的免疫效果,临床应用时一般每2 a免疫1 次,故羊群尤其是新生羔羊,每年至少需要免疫7次。多数羊场执行的免疫程序均包含上述5种疫苗,且每次免疫需间隔一段时间(一般7~10 d),免疫次数多,工作时间长,劳动强度大,也增加羊的应激和人力成本,进而影响养殖场经济效益,尤其是规模化羊场更是如此。
为简化免疫过程,提高免疫工作效率,降低劳动成本,本试验依据不同疫苗的免疫期,并结合临床实际生产周期,将相似免疫期的疫苗进行组合,研究多种疫苗联合免疫后的免疫保护情况,以期优化免疫程序。
1 材料与方法
1.1 试验动物
健康成年陕北白绒山羊(布鲁氏菌病抗体阴性)70只,来自榆林学院陕西省陕北绒山羊工程技术研究中心试验动物场。
1.2 主要试剂
口蹄疫O型灭活疫苗(OJSM株)(批号:19138018),金宇保灵生物药品有限公司产品;小反刍兽疫活疫苗(Clone 9株)(批号:2019012-1),天康生物股份有限公司产品;山羊传染性胸膜肺炎灭活疫苗(C87-1株)(批号:201907)及羊快疫、猝狙、羔羊痢疾和腸毒血症四联干粉灭活疫苗(批号:202012),哈药集团生物疫苗有限公司产品;山羊痘活疫苗(批号:2019012),吉林正业生物制品股份有限公司产品;山羊传染性胸膜肺炎间接血凝诊断试剂盒(批号:20200911206)、山羊痘间接ELISA抗体检测试剂盒(批号:20200721118)、口蹄疫O型抗体液相阻断ELISA检测试剂盒(批号:20200507101-1),均购自中国农业科学院兰州兽医研究所;小反刍兽疫病毒阻断ELISA抗体检测试剂盒(批号:020172010),购自青岛立见诊断技术发展中心。
1.3 试验方案
免疫试验方案见表1。将试验羊随机分成5组,A、B、C和D组,15只/组,E组10只。A组首次分点同时免疫口蹄疫疫苗和三联四防,7 d后分点同时免疫山羊痘活疫苗和传胸苗,14 d后免疫小反刍兽疫疫苗;B组首次分点同时免疫山羊痘活疫苗和传胸苗,7 d后分点同时免疫口蹄疫疫苗和三联四防,14 d后免疫小反刍兽疫活疫苗;C组首次分点同时免疫口蹄疫疫苗、三联四防、山羊痘活疫苗和传胸苗4种疫苗,7 d后免疫小反刍兽疫活疫苗;D组同时分点免疫上述5种疫苗;E组为对照组,每隔7 d单独免疫每种疫苗。免疫剂量及免疫途径均按各疫苗说明书要求进行。免疫后连续7 d观测所有试验羊是否有不良反应,并于免疫前及免疫后7、14、21、28、35、42、60、90、120、150、180、210、360 d经颈静脉采血,分离血清,分别检测各种疫苗免疫前及免疫后不同时间抗体水平。
1.4 免疫后安全性观测
所有试验羊在每次免疫疫苗后均观测7 d,观测羊只的精神状况、采食量、体温及是否有其他严重不良反应、死亡等。
1.5 抗体检测
按照商品化试剂盒说明书操作,检测免疫前及免疫后不同时间口蹄疫、羊痘、山羊传染性胸膜肺炎以及小反刍兽疫的抗体水平。
口蹄疫免疫抗体检测:采用口蹄疫O型抗体液相阻断ELISA测定,抗体效价(log2)≥7,抗体阳性,99%以上保护;抗体效价(log2)≤4 为阴性,不保护;4<抗体效价(log2)<7,为可疑,需重测,重测样品抗体效价(log2)≥7,抗体阳性,<7则为阴性。
小反刍兽疫抗体检测采用阻断ELISA测定,在试验成立的前提下,被检样品阻断率(PBs)>50,判为阳性,而≤50为阴性。
山羊传染性胸膜肺炎抗体检测采用间接血凝法,被检血清抗体效价(log2)≥3,判为阳性,而≤2为阴性。
羊痘抗体检测采用间接ELISA测定,在试验成立的前提下,被检血清OD450≥0.25,抗体阳性,而OD450≤0.2抗体为阴性,中间为可疑需重复检测,若重检样OD450≥0.23,抗体阳性,否则为阴性。
1.6 数据统计与分析
利用Microsoft Excel 2016和Graphpad Prism 9软件进行数据处理、统计、分析,5%显著水平,并用Microsoft Excel 2016制图。
2 结果与分析
2.1 疫苗联合免疫安全性观测结果
疫苗免疫后24 h内个别羊只出现精神沉郁、慢草不食、饮水减少、体温略有升高等一过性副作用,后陆续恢复正常,7 d观测期内,均未观测到其他严重的不良反应,说明使用几种疫苗(2种、4种、5种)同时分点联合免疫成年陕北白绒山羊是安全的。
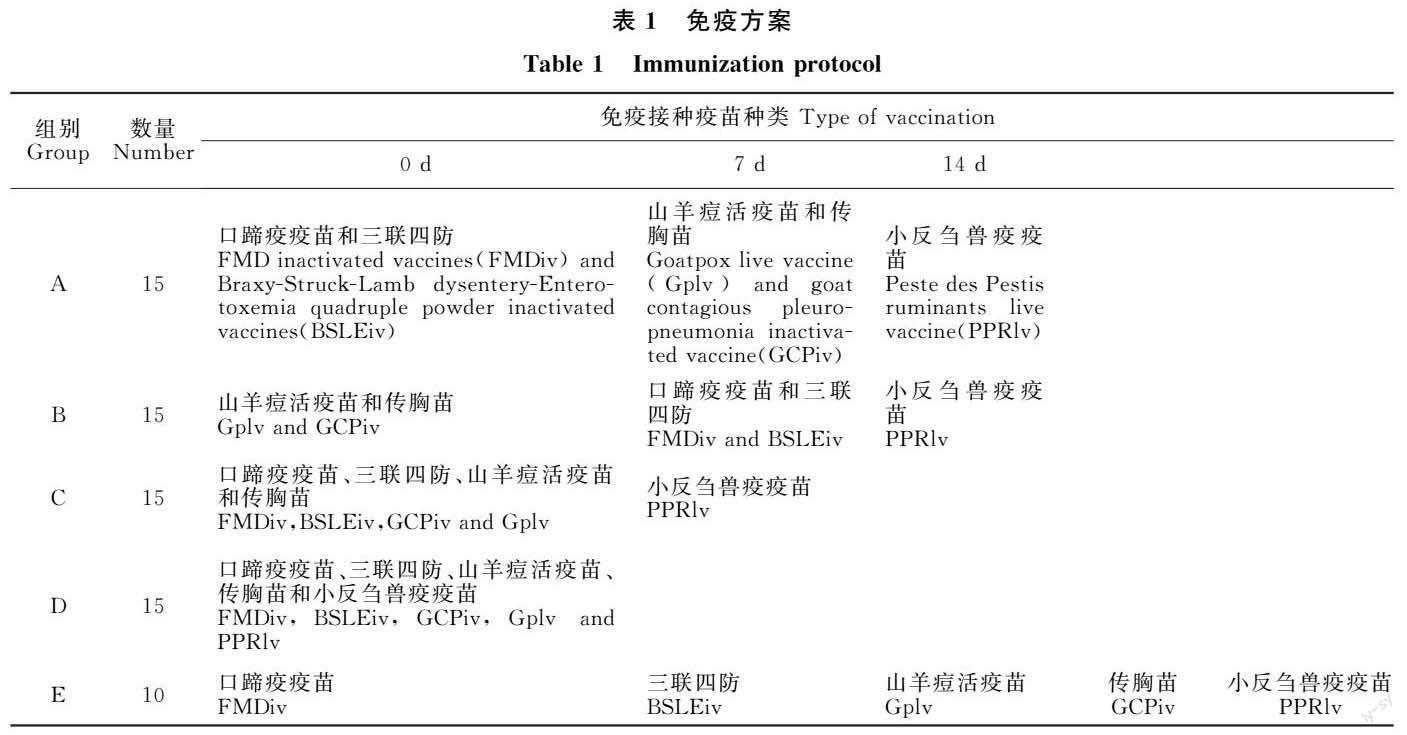
2.2 口蹄疫疫苗免疫后不同时间抗体水平
从图1可见,疫苗免疫前抗体滴度(log2)均低于≤4,羊群处于未被保护状态,免疫后,抗体水平上升较快,免疫后14 d 抗体滴度(log2)均为4~6,21 d抗体滴度(log2)≥7,99%以上保护,且抗体持续至免后5个月后开始下降,180 d则降至4以下,不能保护,再次免疫口蹄疫疫苗后1个月,抗体水平升至保护水平。同时各组间口蹄疫抗体水平基本无差异,说明各种组合下,同时免疫并不影响口蹄疫抗体水平的消长以及持续。
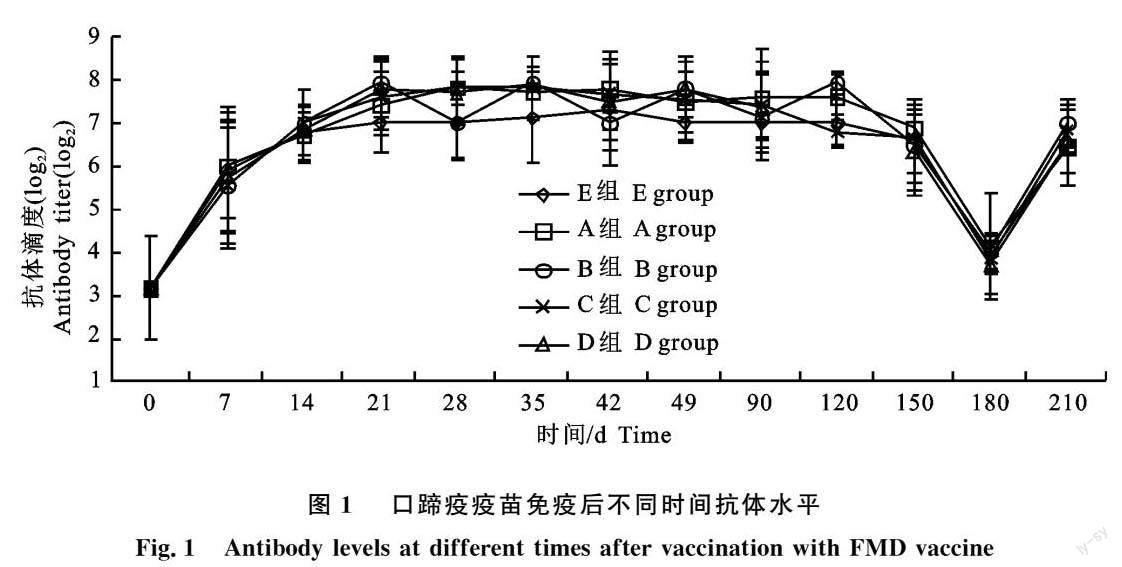
2.3 小反刍兽疫活疫苗免疫后不同时间抗体水平
试验前小反刍兽疫抗体平均阻断率(图2-a)低于50%,阳性率(图2-b)在60%左右,处于不能完全保护状态,疫苗免疫后,抗体水平迅速上升,且在近1 a的检测期,群体抗体阻断率和阳性率均稳定持续在较高水平,阳性率均在85%以上,远高于国家要求的70%群体阳性率水平。同时各组间小反刍兽疫抗体水平基本无差异,说明4种疫苗组合联合免疫并不影响小反刍兽疫抗体水平的消长以及持续。
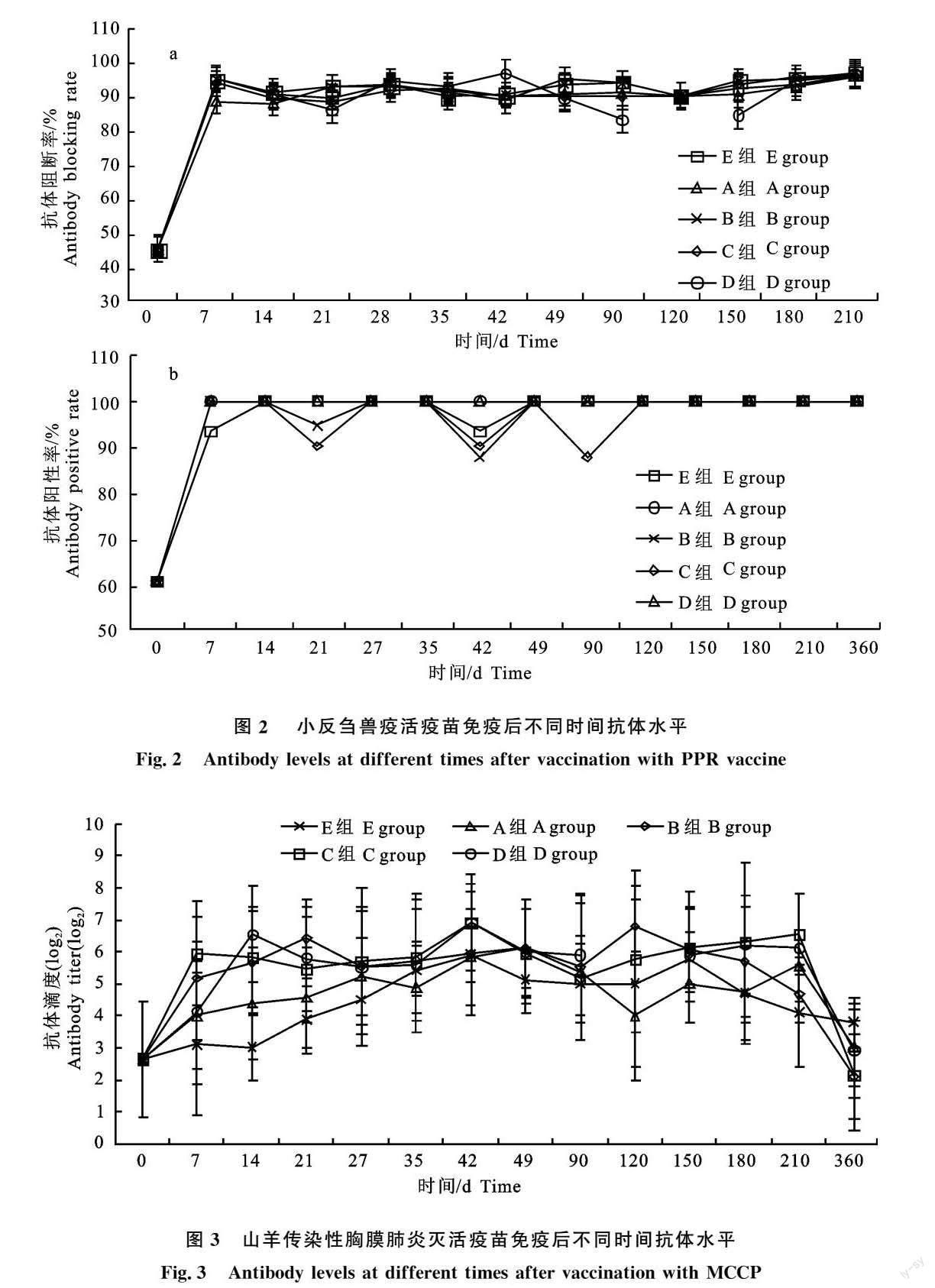
2.4 山羊传染性胸膜肺炎灭活疫苗免疫后不同时间抗体水平
从图3结果可见,疫苗免疫前群体的抗体水平(log2)处于3以下,疫苗免疫后抗体水平上升较慢,21 d后100%阳转,且抗体持续12个月后开始下降至未完全保护50%以下。同时各组间传染性胸膜肺炎抗体水平基本无差异,说明各种组合下,同时免疫并不影响传染性胸膜肺炎抗体水平的消长以及持续。
2.5 山羊痘活疫苗免疫后不同时间抗体水平
免疫前群体的阳性率低于70%(图4-b),已处于未保护状态,免疫疫苗后,抗体水平上升较快,免疫后14 d抗体100%阳性,检测期内抗体阳性率均维持在80%以上,至12个月后所有试验组抗体水平均开始下降至80%左右,处于保护水平的临界点。由于每批次检测的差异,使得免疫后直接检测的抗体滴度(OD450)起伏较大(图4-a),但整体趋势与阳性率一致。同时各组间羊痘抗体水平基本无差异,说明各种组合下,联合免疫亦不影响羊痘抗体水平的消长以及持续。
3 讨 论
为了简化免疫程序,降低劳动力成本,许多学者[1-3]探索了多种疫苗联合免疫效果,尤其是口蹄疫和小反刍兽疫疫苗。口蹄疫和小反刍兽疫是国际动物卫生组织(Office International des Epizooties,OIE)规定的法定报告疫病,也是全球计划根除的动物疫病,中国将其列为一类疫病,且均为强制免疫病种[4-5]。2020年国家动物疫病强制免疫计划中要求,二者群体免疫密度应常年保持在90%以上,其中应免畜禽免疫密度应达到100%,且免疫抗体合格率应常年保持在70%以上。许多研究均表明[6-8],口蹄疫、小反刍兽疫疫苗可同时分点免疫羊群,且抗体的合格率均达到规定标准,与分别单独免疫组相比,免疫效果差异不显著,说明疫苗同时免疫不会干扰各自抗体水平的消长和持续。
就疫苗联合免疫的安全性及是否存在干扰拮抗现象而言,目前已在山羊[8]、湖羊、细毛羊[1]、小尾寒羊[9]、藏羊[10]等多个品种试验,仅许伟等[11]的研究中试验羊(文中未标明试验羊种类)出现了过敏以及死亡案例,该试验采用同时免疫小反刍兽疫和山羊支原体肺炎及口蹄疫、小反刍兽疫和羊痘3种疫苗2种方式,分析认为是由于疫苗免疫剂量过大以及试验动物个体差异所致。Zhang等[12]的研究结果表明,绵羊同时免疫小反刍兽疫疫苗和羊痘疫苗后,产生的小反刍兽疫抗体水平高于单独免疫对照组,而羊痘抗体水平正好相反,低于对照组,说明同时免疫这两种疫苗存在相互干扰现象,影响羊痘的免疫效果。本研究中选用两种疫苗联合免疫(A组、B组)的依据在于不同疫苗的免疫期不同,相同免疫期的两两组合,并交叉先后免疫,评价免后保护效果。试验结果表明,不论哪两种疫苗组合(口蹄疫疫苗和三联四防与羊痘疫苗和传胸苗),同时分点免疫羊只后均未观测到任何临床不良反应,且免疫后抗体消长规律、阳转率、持续期,均和对照组无差异,疫苗两两组合免疫不会互相影响彼此的抗体消长,且不同组合先后免疫亦未出现干扰现象,说明本试验采用的疫苗组合可以同时免疫羊群,不仅安全,且可提供有效保護。进一步同时免疫此4种疫苗(C组),结果表明,试验羊均未出现不良反应,且同时免疫亦不影响免疫后抗体消长、阳转率、持续期,相互之间并未出现干扰现象。祁广仪等[13]与姚菊霞等[14]将口蹄疫、三联四防、小反刍兽疫和羊痘4种疫苗分点同时注射,免疫羊产生的抗体水平与单苗免疫组相比差异均不显著,疫苗免疫后产生的抗体效价相对较高且稳定,不同疫苗之间相互干扰、拮抗作用不明显,抗体合格率均在70%以上,与本研究结果基本一致。
从检索到的文献可知,联合免疫试验中很少涉及山羊传染性胸膜肺炎灭活疫苗,仅许伟等[11]同时免疫小反刍兽疫和山羊支原体肺炎灭活疫苗,但临床实践中肺炎发病率很高,其中山羊传染性胸膜肺炎(Contagious caprine pleuropneumonia,CCPP)引起的损失最大,亦已被OIE列入必须上报的疫病种类。Deeney等[15]对2005-2019年间英格兰和威尔士的羊群进行流行病学调查发现,肺组织和上呼吸道中羊肺炎支原体阳性率分别为73% (n=449)和12%(n=72)。Zhao等[16]对新疆南部羊群流行病学调查发现,824份鼻拭子中肺炎支原体阳性率为40.78%,而3月龄内羔羊的阳性率高达53.39%,说明肺炎支原体是造成羊呼吸道疾病的主要病原,故传染性胸膜肺炎疫苗亦应成为羊场必须免疫的疫苗之一。目前国内商品化的传染性胸膜肺炎疫苗有山羊传染性胸膜肺炎灭活疫苗(C87-1株)和山羊支原体肺炎灭活疫苗(MoGH3-3株+M87-1株)2种,本研究中选用了前者,结果表明,传染性胸膜肺炎疫苗联合免疫安全且能如说明书所示有效保护1 a,同时本研究首次试验了5种疫苗联合免疫(D组),结果表明试验羊均未出现不良反应,同时免疫后各种抗体消长规律、阳转率、持续期均和对照组无差异,且相互之间并未出现干扰现象,说明在生产实践中,同时联合免疫上述5种疫苗亦可行。
依据本研究结果,可初步形成羊场成年羊疫苗联合免疫的免疫程序,即羊群免疫上述5种疫苗后6个月,同时分点免疫口蹄疫灭活疫苗和羊三联四防灭活疫苗,12个月后,同时分点免疫口蹄疫灭活疫苗、羊三联四防灭活疫苗、山羊痘活疫苗以及山羊传染性胸膜肺炎灭活疫苗,18个月后,同时分点免疫口蹄疫灭活疫苗和羊三联四防灭活疫苗,24个月后,同时分点免疫口蹄疫灭活疫苗、羊三联四防灭活疫苗、山羊痘活疫苗、山羊传染性胸膜肺炎灭活疫苗以及小反刍兽疫活疫苗,此后循环。该免疫程序将疫苗的免疫期与生产周期有效衔接,多种疫苗组合联合免疫,即契合实际生产周期中疫苗的免疫需求(需免疫的疫苗种类以及免疫次数),有效防控相应疫病,又减少了免疫次数,显著降低劳动量及劳动力成本,进而增加养殖效益。
当前尚无针对三联四防苗免疫后抗体水平监测/检测的商品化试剂盒,故本试验未检测该疫苗免疫后不同时间抗体水平,亦未采用其他方法(如血清中和法)进行抗体水平评价,此为本试验不足之处之一。此外本次试验样本数较少,且仅在成年陕北白绒山羊上進行了试验,故下一步拟扩大试验样本数量和试验种类(绵羊),进一步验证联合免疫后疫苗的安全性和效力,以期推广应用至生产实践中。同时,将联合免疫方式拓展至羔羊及育肥羊免疫程序优化上,进而形成覆盖各生长阶段的联合免疫流程。
4 结 论
与单独免疫每种疫苗相比,5种疫苗联合免疫不仅可提供与单独免疫相当的临床保护效果,而且更高效、经济,据此形成的免疫程序利于羊场尤其是规模化羊场有效降低人力成本、减少应激,提质增效。
参考文献 Reference:
[1] 王 斌,王淑芳,白天俊,等.羊群不同疫苗组合免疫后其抗体水平的评价[J].中国动物传染病学报,2021,8:1-10.
WANG B,WANG SH F,BAI T J,et al.Detection and evaluation of antibody levels of different vaccine combinations[J].Chinese Journal of Animal Infectious Diseases,2021,8:1-10.
[2] 鲁立柱,柏 庆,任国堂,等.羊口蹄疫灭活疫苗分别与小反刍兽疫活疫苗及布氏菌活疫苗联合使用的免疫效果分析[J].中国生物制品学杂志,2017,30(9):897-900,5.
LU L ZH,BAI Q,RENG G T,et al.Immune effect of inactivated Foot-and-Mouth disease vaccine combined with live attenuated Peste des Petits Ruminants vaccine or live Brucella vaccine[J].Chinese Journal of Biologicals,2017,30(9):897-900,5.
[3] 黄继康,封士军,高 杨,等.湖羊口蹄疫及小反刍兽疫疫苗同时免疫与单独免疫效果比较[J].畜牧兽医科技信息,2020(10):36-37.
HUANG J K,FENG SH J,GAO Y,et al.Comparison between simultaneous immunization and single immunization of FMD and PPR vaccine in Hu sheep[J].Chinese Journal of Animal Husbandry and Veterinary Medicine,2020(10):36-37.
[4] 王韦华,刘桂梅,吴奇强,等.口蹄疫病毒可视化RT-LAMP检测方法的建立[J].西北农业学报,2018,27(12):1736-1744.
WANG W H,LIU G M,WU Q Q,et al.Establishment of a visible detection of Foot-and-Mouth disease virus by reverse transcription loop-mediated isothermal amplification assay[J].Acta Agriculturae Boreali-occidentalis Sinica,2018,27(12):1736-1744.
[5] 何亚鹏,鲍长磊,张 琪,等.小反刍兽疫病毒疫苗株N和M基因的克隆、序列分析及原核表达[J].西北农业学报,2017,26(2):179-184.
HE Y P,BAO CH L,ZHANG Q,et al.Cloning,sequence analysis and prokaryotic expression of N and M genes of Peste des Petits Ruminantsvirus vaccine strains[J].Acta Agriculturae Boreali-occidentalis Sinica,2017,26(2):179-184.
[6] 郝玉青,白艳艳,刘健鹏,等.陕北白绒山羊小反刍兽疫及口蹄疫疫苗免疫方法比较[J].中国畜牧兽医文摘,2016,32(3):126,37.
HAO Y Q,BAI Y Y,LIU J P,et al.Comparison of immunization methods of PPR and FMD vaccines in Shanbei white cashmere goats[J].Abstracts of Chinese Animal husbandry and Veterinary,2016,32(3):126,37.
[7] 鄧林玉,杨登林,杨 莉,等.山羊同时接种口蹄疫O-A-亚Ⅰ型三价灭活疫苗和小反刍兽疫活疫苗后30 d内抗体动态研究[J].湖北畜牧兽医,2016,37(7):26-27.
DENG L Y,YANG D L,YANG L,et al.Study on antibody dynamics of goats inoculated with FMD O-A-Asia Ⅰ trivalent inactivated vaccine and PPR live vaccine within 30 days[J].Hubei Journal of Animal and Veterinary Sciences,2016,37(7):26-27.
[8] 冯春红,冯 华,郑书源.山羊口蹄疫及小反刍兽疫疫苗分点同时免疫效果比较[J].养殖与饲料,2017(9):68-69.
FENG CH H,FENG H,ZHENG SH Y.Comparison of simultaneous immunization efficacy of FMD and PPR vaccines in goats[J].Animals Breeding and Feed,2017(9):68-69.
[9] 王雅雯,努尔麦麦提·麦麦提敏,李仕林,等.小尾寒羊口蹄疫-小反刍兽疫联合免疫效果评价[J].现代畜牧兽医,2021(6):62-63.
WANG Y W,NUERMAIMAITI·MAIMAITIMENG,LI SH L,et al.Evaluation of the effect of combined immunization of small-tailed Han sheep with FMD and PPR vaccines[J].Modern Journal of Animal Husbandry and Veterinary Medicine,2021(6):62-63.
[10] 才仁卓玛,铁富萍,刘文清,等.高原型藏羊多疫苗联合免疫与单苗免疫效果对比试验[J].湖北畜牧兽医,2021,42(7):13-16.
CAIRENZHUOMA,TIE F P,LIU W Q,et al.Comparative study on the effect of several vaccine combined immunization and single vaccine immunization on Plateau Tibetan sheep[J].Hubei Journal of Animal and Veterinary Sciences,2021,42(7):13-16.
[11] 许 伟,贺 文,王 力,等.羊只多种疫苗组合分点同时免疫效果对比试验[J].中国兽医杂志,2020,56(1):40-42.
XU W,HE W,WANG L,et al.Comparative study on the simultaneous immunization with several vaccines in sheep[J].Chinese Journal of Veterinary Medicine,2020,56(1):40-42.
[12] ZHANG D,YANG B,ZHANG T,et al.In vitro and in vivo analyses of co-infections with Peste des Petits Ruminants and Capripox vaccine strains[J].Virology Journal,2021,18(1):69.
[13] 祁广仪,任宝玺,姚菊霞.羊一畜多苗多点同时联合注射效果研究[J].中兽医学杂志,2015(6):14-16.
QI G Y,REN B X,YAO J X.Effect of several vaccines were simultaneously injected at several points in sheep[J].Journal of Chinese Veterinary Medicine,2015(6):14-16.
[14] 姚菊霞,祁广仪,任宝玺,等.羊四苗分点同时免疫与单苗免疫对比试验[J].畜牧兽医杂志,2016,35(3):44-47.
YAO J X,QI G Y,REN B X,et al.Contrast test of four vaccine immune simultaneously at different points and single vaccine immune in sheep[J].Journal of Animal Science and Veterinary Medicine,2016,35(3):44-47.
[15] DEENEY A S,COLLINS R,RIDLEY A M.Identification of Mycoplasma species and related organisms from ruminants in England and Wales during 2005-2019[J].BMC Veterinary Research,2021,17(1):325.
[16] ZHAO J Y,DU Y Z,SONG Y P,et al.Investigation of the prevalence of Mycoplasma ovipneumoniae in southern Xinjiang,China[J].Journal of Veterinary Research,2021,65(2):155-160.
Abstract In order to simplify the immunization procedure,improve work efficiency and reduce labor cost,with each immunome as control,four different vaccine combinations were simultaneously immunized to Shanbei white cashmere goats in this experiment.The safety of the combined vaccine was observed and the four types of antibody levels were detected by commercial kits at different times after immunization.The results showed that no adverse reactions in all goats were observed in the combined immunization group during the observation period of 7 days after immunization,which indicated that combined immunization was safe.No matter which combination immunization group,such as two types of vaccines(FMD inactivated vaccines(FMDiv) and Braxy-Struck-Lamb dysentery-enterotoxemia quadruple powder inactivated vaccines(BSLEiv) or goatpox live vaccine(Gplv) , goat contagious pleuropneumonia inactivated vaccine(GCPiv)),four types vaccines(FMDiv-BSLEiv-GCPiv-Gplv) or five types of vaccines(FMDiv-BSLEiv-GCPiv-Gplv-PPRlv(Peste des pestis ruminants live vaccine)),there was no difference in antibody levels for each vaccine at different time after immunization between the group and the control group during the detection period and there was no interference between each vaccine in the combined immunization group.Therefore,the results of combined immunization can provide a reference for optimizing immunization schedule for goat farms.
Key words Goat;Vaccine;Combined vaccination;Immunity program

