国内外药品上市后安全性评价文献计量分析*
卢圆圆,杨林慧,蔡沅璇,赵宇航,彭月,黄锐,上官小芳
(1.华中科技大学同济医学院附属湖北省妇幼保健院药学部,武汉 430070;2.南昌市医疗保障局,南昌 330038;3.华中科技大学同济医学院药学院,武汉 430030;4.武汉科技大学医学院,武汉 430080)
从20世纪60年代波及世界的“反应停”事件到震惊全国的“齐二药”药害事件,再到罗非昔布的撤市,药品安全问题从未淡出社会视野,相反一直是医疗健康发展的重要一环。药品上市后安全性评价既是对上市前药品评价的延续和完善,又是科学决策疾病的临床用药、药品市场流通方案等重大问题的关键证据来源[1]。WHO乌普萨拉监测中心汇集世界药物不良反应信息并作出风险评估;国际人用药品注册技术协调会(the International Council for Harmonization of Technical Requirement for Pharmaceuticals for Human Use,ICH)制定标准流程和规章制度,通过建立科学有效的监测系统来推动药品安全监管工作顺利进行。我国药品上市后安全性评价工作起步较晚,尚未形成完善的药品上市后安全性研究规范和评价体系。新的《中华人民共和国药品管理法》要求持有人等应当主动开展药品上市后研究,因此迫切需要制定适合我国国情的药品上市后安全性研究工作指南。笔者以Web of Science(WOS)和中国知网(CNKI)为数据源,运用CiteSpace可视化分析2002年1月—2022年4月公开发表有关药品上市后安全性评价相关文献,挖掘核心关键词,清晰展示药品上市后安全性评价研究领域的知识结构、合作网络、研究热点以及集中趋势,以有助于我国的药品上市后安全性研究工作。
1 资料与方法
1.1国内药品上市后安全性评价资料来源 从中国知网数据库收集相关文献记录,以“药品上市后安全性评价” “药物警戒” “药品上市后安全性监测” “药品上市后研究” “药品风险管理”等为中文主题词组成检索式进行检索。由于2002年前“药品上市后安全性评价”相关文献极少,为使文献检索紧跟临床联合用药安全性与风险管理研究前沿与研究热点,且尽可能较为全面地纳入该领域的相关文献,文献发表时间选择为2002年1月—2022年4月,共得到文献1270篇。排除会议、报纸、年鉴、专利、成果等类型文献,共纳入国内药品上市后安全性评价文献1073篇。
1.2国外药品上市后安全性评价资料来源 国外文献以Web of Science 为数据库,选取核心合集进行检索。以 “post-marketing surveillance”“post-authorisation safety study”“post-marketing assessment”“pharmacovigilance”“drug safety”“adverse drug reaction”为关键词组合匹配成检索式进行检索,文献类型为“article”和“review”,文献选取时间跨度为2002年1月—2022年4月,共得到文献5116篇,文献去重转换后共纳入4244篇。
1.3研究方法 将所检索的国内外药品上市后安全性评价文献导入CiteSpace软件,使用CiteSpace软件分别绘制文献关键词共现图谱与聚类图谱、时区图谱、作者合作网络关系图谱、机构合作网络关系图谱等,以达到可视化分析的目的;再结合高频关键词表等数据,将国内外药品上市后安全性评价的研究进行对比分析,从而总结国内外药品上市后安全性评价研究领域的知识结构、合作网络、研究热点以及集中趋势。
2 结果
2.1国内药品上市后安全性评价文献计量分析
2.1.1国内药品上市后安全性评价文献关键词共现网络分析 中文文献关键词共现网络分析见图1,表1。
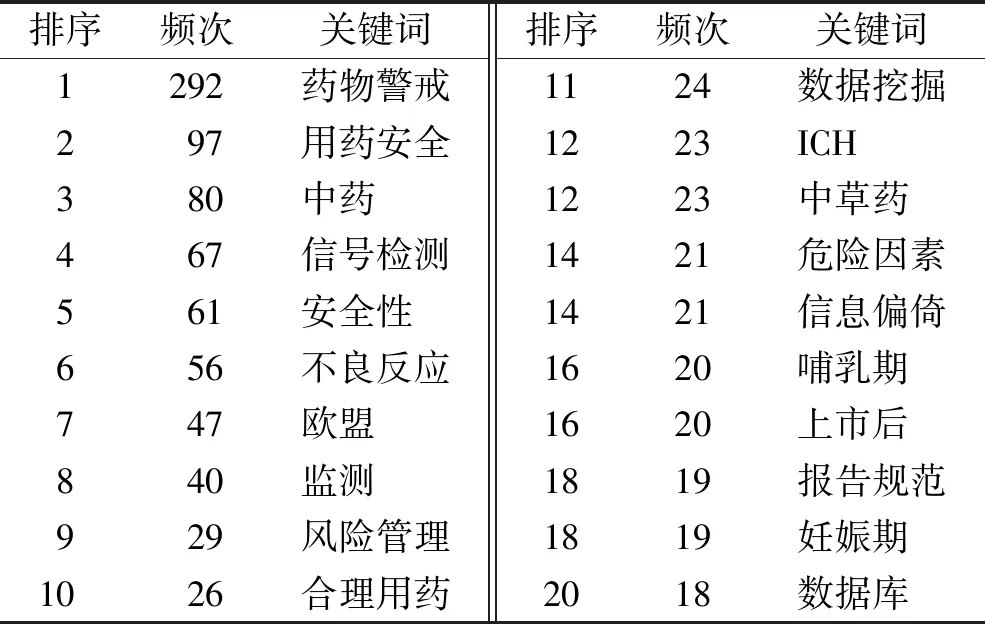
表1 2002—2022年国内药品上市后安全性评价相关文献的高频关键词(n≥18)
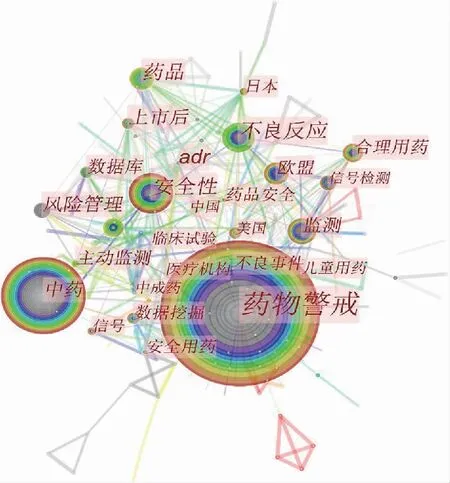
图1 中文文献关键词共现知识图谱
共现图谱中节点圆环代表关键词频次,其大小代表关键词出现的频次以及时间跨度;各点之间的连线则是反映该领域关键词之间的合作关系及密切程度[2-3]。知识图谱(图1)共呈现出关键词网络节点315个,关键词节点间连线537条。从关键词热点图谱可发现药品上市后安全性评价研究领域的热点。图谱中排名前10位的关键词为“药物警戒”“用药安全”“中药”“信号检测”“安全性”“不良反应”“欧盟”“监测”“风险管理”“合理用药”,见表1。
聚类采取LLR算法,对文献标题、摘要、引用文献等整体进行信息提取,形成具有不同研究特点的区域和聚类标识。模块化值(Modularity)为0.641 2,表示网络的聚类结果良好[4-6]。图2显示关键词聚类图谱共聚出12类,标签顺序为0到11,数字越小,聚类中包含的关键词的信息则越丰富。排除因文献样本量较少的而被系统自动过滤的部分,剩下的聚类标签分别为“#0 药物警戒”“#1 美国”“#2 不良反应”“#3报告规范”“#4 中药”“#5 药品”“#6 数据库”“#7 FDA”“#8 安全用药”“#9 混杂”“#11 职能”。根据系统聚类以及关键词频次表,可以发现国内学者研究内容主要集中在以下6个方面,① 中药或某种具体药物上市后的不良反应发生情况;② 美国食品药品管理局(FDA)、欧盟药品管理局(EMA)等在药品上市后安全性评价领域的职能分配和体系构建;③ 药品上市后安全性评价的技术支撑路径;④ 药品不良反应上报数据规范性;⑤ 药品上市后风险因素评估;⑥ 关注特殊人群用药的上市后安全性评价。

图2 中文文献关键词聚类图谱
时区图将相同时间内的节点集合在相同的时区中,即关键词首次出现的时间。时区图更加直接呈现不同研究热点出现的时间,以及当前的研究趋势[5-7]。从图3可以推断,药品上市后安全性评价领域从2010年始,研究重点从依据自发呈报系统上报的数据开展安全性评价,拓展为采用主动监测方法对重点目标药品的安全性以及新的、严重不良反应进行上市后监测。此外,从管理维度上来看,药品上市后安全性评价领域重视临床药师在药品上市后安全性评价的关键作用,并建立指标体系以科学地进行药品上市后安全性评价。2015年,“大数据”等关键词频繁出现在文献中,随着医疗健康信息平台迅猛发展,医疗健康数据体量爆炸式增长,学者们也不断从健康数据库中探寻药品上市后的风险信号。近年国内学者研究热点主要集中在我国药品监管领域法律法规体系完善的措施探索,学者对日本、德国等发达国家的药物警戒体系研究颇深。

图3 中文文献关键词时区图
2.1.2国内药品上市后安全性评价文献科研合作网络分析 科研合作网络能够全面客观了解不同学术机构,以及不同作者之间在同一领域研究热点的合作关系,网络中的节点大小反映论文数量[7]。从图4及表2可知,近20年,国内谢雁鸣、王连心、张冰等学者于国内药品上市后安全性评价领域发文较多,尤其是针对中药、中成药上市后安全性评价形成连续的研究脉络。此外,部分学者在药品上市后安全性评价的方法论上锐意创新,以詹思延教授为核心的学者团队致力于推动医疗健康大数据以及药物流行病学与药品上市后安全性评价的相互融合,从而丰富药品上市后安全性评价的技术支撑体系。
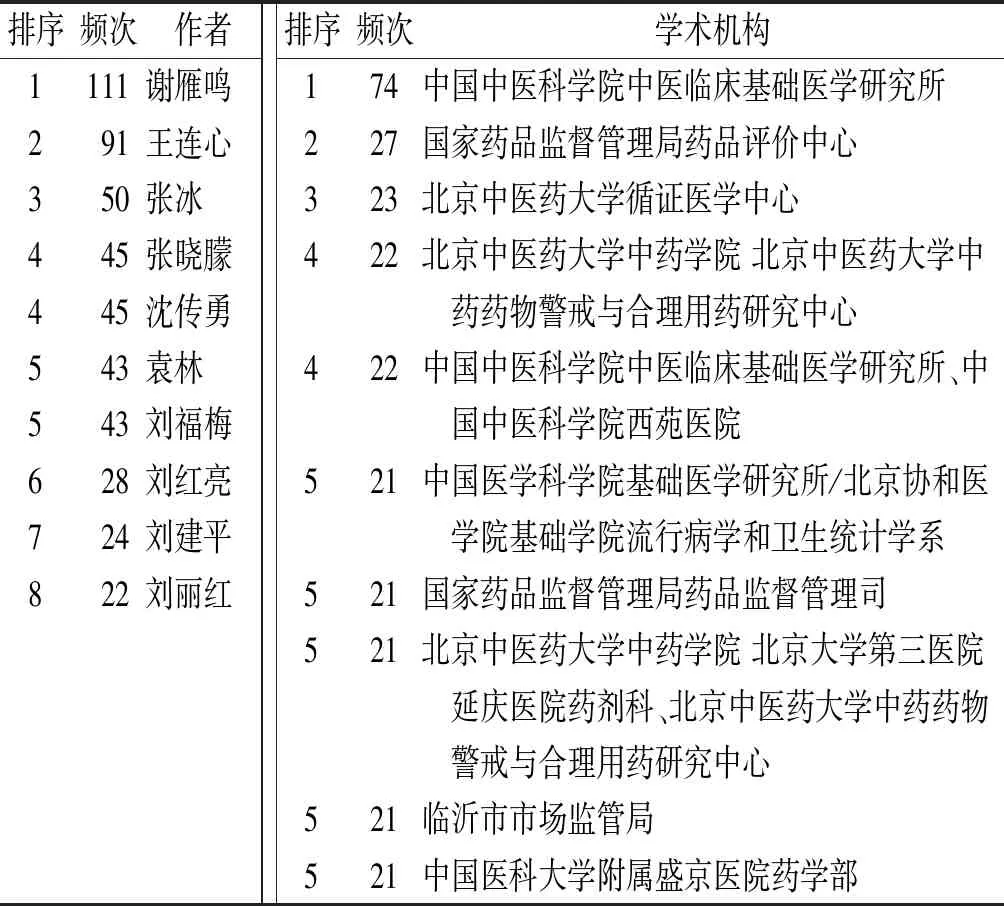
表2 2002—2022年国内药品上市后安全性评价相关文献作者及学术机构发文量排序

图4 2002—2022年中文文献作者合作网络图谱
近20年国内针对药品上市后安全性评价领域发文量较多的学术机构主要集中在北方高校、医院以及药品监管部门。此外,国家药品监督管理局药品评价中心、国家药品监督管理局药品监督管理司对于药品上市后安全性评价的发文数量可观。从研究领域看,中药科研院所对于药品上市后安全性评价的研究热度居高不下。
2.2国外药品上市后安全性评价文献计量分析
2.2.1国外药品上市后安全性评价文献关键词共现网络分析 关键词共现网络分析结果:知识图谱共呈现出729个关键词网络节点、3230条关键词节点间连线。由图5可见,国外文献中共现次数排名前10位的关键词为“safety”“adverse drug reaction”“pharmacovigilance”“adverse event”“risk”“efficacy”“drug safety”“double blind”“therapy”“system”,出现频次分别为766,680,517,474,423,403,335,328,231,188次;中心度位于前10位的关键词依次是“double blind”(0.09)、“adverse event”(0.07)、“therapy”(0.07)、“risk”(0.07)、“meta-analysis”(0.07)、“drug”(0.06)、“multicenter”(0.06)、“children”(0.05)、“post-maketing surveillance”(0.05)、“clinical trail”(0.05)、“adverse reaction”(0.05)。见表3。
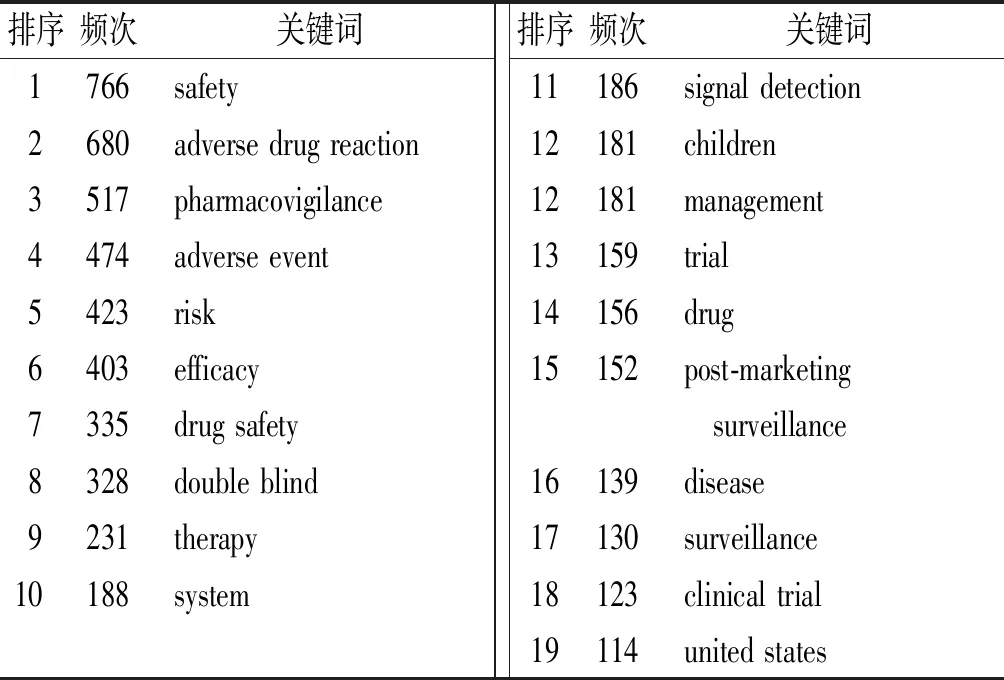
表3 2002—2022年国外药品上市后安全性评价相关文献的高频关键词(n≥110)
根据图5和表3,可以将国外的研究内容归为以下三个主要方面。Ⅰ:“safety”“drug safety”“management”“pharmacovigilance”“post-marketing surveillance”“adverse drug reaction”“adverse event”等药品上市后安全性监管相关名词;Ⅱ:“risk”“signal detection”“database”“meta-analysis”“prevalence”“clinical trial”“double blind”“data mining”“disproportionality”等药品上市后安全性评价方法路径等名词;Ⅲ:“children”“patient safety”“impact”“information”等关注特殊患者,关注特殊人群等名词。
采用关键词聚类模块绘制聚类图谱,结果见图6。网络的模块度用Modularity Q表示,取值范围为0~1,Modularity Q>0.3表明该关键词聚类图具有显著的网络聚类结构[8];该值越接近1,表明关键词聚类图具有越密切的聚类间联系,聚类结果越具有价值[9]。而Weighted Mean Silhouette S则是衡量网络同质性的轮廓值,取值范围为-1~1,Weighted Mean Silhouette S>0.7表明聚类效果良好,且同质性和聚类结果可信度与该数值具有正向相关性。图谱中模块化值(Modularity)为0.436 3>0.3,表示关键词图谱聚类结果良好,具有显著性。图6中,根据国外文献进行聚类分析得到13个关键词聚类标签,Weighted Mean Silhouette S值为0.724 4>0.7,表明网络结构显著,具有较好的同质性和聚类效果。按照关键词词频体大小,具体聚类标签结果见表4。

表4 国外药品上市后安全性评价文献关键词聚类

图6 外文文献关键词聚类图谱
结合系统聚类以及关键词频次表(图6,表4),可以发现国外学者在药品上市后安全性评价领域的研究内容集中在炎症性肠病、糖尿病、心房颤动、血管内凝血等特定疾病用药研究[10-11];研究呈现形式依然是以报道药物不良反应和不良事件为主[12-14];在风险评估层面,风险信号检测、数据挖掘等利用大数据寻找风险因素的研究较为集中[15-17];在研究方式上,回顾性横断面研究与前瞻性队列研究并重[18-19]。
2.2.2国外药品上市后安全性评价文献科研合作网络分析 国外药品上市后安全性评价的文献科研合作网络结果见图7。

图7 国外药品上市后安全性评价相关文献的作者合作网络图
节点大小表示作者的发文量,而节点之间连接是作者合作关系外显[8]。近20年发文量排在首位的作者为JEANLOUIS MONTASTRUC。中心度方面,排在首位的作者是GIANLUCA TRIFIRO(0.07)。见表5。
表5 国外药品上市后安全性评价相关文献发文量排名前十的作者
国家及学术机构合作网络展现出研究成果颇丰的国家和机构,对完善体系建设和合理应用研究证据具有重要意义[20]。每个节点就是一个学术机构,而节点轮廓大小表示机构的发文量,不同学术机构之间存在的合作关系则通过节点之间的连线表示[20]。结果见图8。

图8 国外药品上市后安全性评价相关文献的学术机构合作网络图
由图8可见,近20年来发文量最多的机构为“US FDA”(美国食品药品监督管理局),达到118篇;其次为“Uppsala Monitoring Ctr”(世界卫生组织乌普萨拉监测中心),发文量为70篇。接下来分别是“Univ Utrecht”(英国乌德勒支大学)、“Pfizer Inc”(美国辉瑞生物制药公司)、“Univ Bordeaux”(法国波尔多第一大学)、“INSERM”(法国国家健康与医学研究院)、“Netherlands Pharmacovigilance Ctr Lareb”(荷兰药物警戒中心)、“Erasmus Univ”(鹿特丹伊拉斯姆大学)、“Univ Bologna”(意大利博洛尼亚大学)、“Univ Messina”(意大利墨西拿大学)。
从图9中可知,与学术机构呈现的网络图谱相似,国外文献中,发文量排名前5位的国家分别是美国、英国、法国、意大利和日本。此外,近20年中国的发文量达到178篇,初始年2007年,位列第11位。从宏观国家层面到微观学术机构层面,美国、英国、法国、意大利等国家都有较为紧密的合作,其中美国监管部分和制药企业联系紧密,与MAH制度深入落实相关;法国作为最初提出药物警戒概念雏形的国家,已经建立较为完善且成熟的药品上市后安全性评价体系,并将其逐渐融入药物警戒体系中,更为全面进行药品安全性监管。我国药品上市后安全性评价领域虽起步较晚,但自从2007年起发展迅速,随着药物警戒政策法规不断完善,我国药品上市后安全性评价工作将更加有章可循,有法可依。
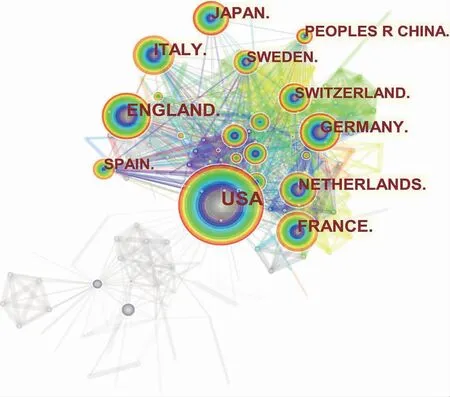
图9 国外药品上市后安全性评价相关文献的国家合作网络图
3 讨论
3.1国内外药品上市后安全性评价研究现状对比 从发展脉络和研究内容来看,国外较早便针对药品上市后安全性评价展开了大量研究,且在药害事件的推动之下,逐步建立起以上市许可持有人为主要责任体,行政监管部门与组织、医疗机构、机构为利益相关者的药品安全监管法规体系,并依托此进行大量药品上市后安全性评价的临床研究。在研究内容方面,利用真实世界数据进行高质量风险信号检测、疫苗安全性评价、药品使用风险因素、特殊人群用药的风险评估是其国外目前的研究热点[22-26]。国内对于药品上市后安全性评价研究起步虽较晚,但发展较为迅速,经过近半个世纪的不断探索,国内的研究从监测药品不良反应的发生情况到利用不良反应报告上报系统、对美国FEARS系统与WHO药物不良事件记录系统等数据库进行风险信号挖掘、探索中药安全性动态评估机制、再到探索借鉴ICH、WHO、美国FDA、欧盟EMA等发达国家与组织在药物安全领域构建的组织职能,最终拓展为我国药品监管领域法律法规体系完善。实现对药品上市后安全性评价内容的拓展,研究成果较为显著。
从关键词聚类分析来看,国外的研究重点是针对具体特定疾病的疾病风险以及用药安全进行临床研究,并对其进行药品上市后安全性评价,同时兼顾特殊人群用药、特殊药品的上市后安全性评价,更偏重临床研究与实际定量分析。而国内的研究重点虽然同样包含对于特殊人群用药的上市后安全性评价,但更多的研究仍处于药物警戒、某种具体药物上市后的不良反应发生情况、其他国家/组织在药品上市后安全性评价领域的职能分配和体系构建等定性分析。
从上市后安全性评价科研合作网络来看,国外进行药品上市后安全性评价研究的机构数量、种类多,不仅包括常规的高校、政府机关、研究院,还有部分医药生物企业。此外,各国学术机构与学者之间的联系较为紧密,合作方式多元。其中ICH对协调药品技术要求、规范真实世界数据呈现方式起到重要作用,进一步促进药品上市后安全性评价领域高质量发展。药品上市后安全性评价合作网络的中心国家以及发文量较多的国家或组织如美国食品药品管理局、欧盟委员会欧洲药品管理局、日本厚生劳动省药品和医疗器械管理局为ICH创始监管机构,中国国家药品监督管理局则为ICH监管机构成员与管理委员会成员。而国内进行药品上市后安全性评价研究的机构、学者较少,多为北方高校以及政府机关部门,缺少生物医药企业参与。此外,具有一定规模的研究团队数量较少,各机构和学者之间的合作并不深入,且团队与团队之间的联系不甚紧密,这也间接限制我国药品上市后安全性评价工作进一步深入。
3.2我国药品上市后安全性评价的未来发展方向 药品上市后安全性评价本身是一个系统、动态工程,作为药物警戒工作重要一环,它将直接提供药品风险监管决策的重要证据。此外,我国有着丰富的中药资源,中成药因其本身的药物特点和独特的用药体系,安全性监测工作更加需要上市后安全性评价工作给予临床用药依据。随着药物警戒制度在国内日益受到各方重视,药品上市后安全性评价工作作为药品上市后风险证据的主要来源,急需结合自身国情,厘清概念涵义、确定研究范畴,借鉴成熟经验逐步完善组织体系、政策法规和技术支撑体系。
我国药品上市后安全性评价工作相比于发达国家起步较晚,21世纪初才从法理角度提及药品上市后安全性评价工作开展的必要性,随着国内外药品研制与药品监管经验、日益丰实,以及全球药物警戒概念兴起,我国药品安全监管体系聚沙成塔,从新兴概念频出、方法体系不断升级、法律法规指南不断融合到组织架构日趋完善,我国的药品上市后安全性评价工作正在稳步推进。
虽然我国药品上市后安全性评价工作取得较大进步,但与国外研究相对比,同时也面临着许多问题与发展方向。①从研究方法上来说,我国药品上市后安全性评价的研究以文献分析为主的定性分析为多,与国外研究相比,缺乏多中心大规模的实证研究、临床研究;②从研究机构情况上来看,与国外相比,我国的深层研究多以高校为主,医疗机构尤其是医药企业等责任主体的高质量研究报告数量较少,且各机构和学者之间的合作并不深入,团队与团队之间的联系不甚紧密,难以形成不同责任主体之间的同向发力;③从研究内容上来说,我国药品上市后安全性评价的研究更多关注制度体系的建设以及具体药品的上市后安全性评价研究,与国外相比存在针对于技术支撑体系融合突破的文献匮乏;④从研究广度与深度来说,我国药品上市后研究以药品不良反应的重点监测工作为核心概念的研究报告多见。相比之下,以特殊人群为关注重点的上市后安全性评价研究则相对较少,且多集中于老年人多重用药的研究。而国外不仅对儿童用药等特殊人群的药品上市后安全性进行更多研究,还通过药品上市后安全性评价的研究,对新药的开发研究提出建议。

