苍耳亭与肝癌细胞MHCC97H共培养后细胞外泌体测序及功能分析*
吴育,汪洁,魏晨旭,张硕,李伟东
(1.南京中医药大学南通附属医院药剂科,南通 226000;2.南京中医药大学药学院,南京 210023;3.南京中医药大学泰州分校,泰州 225300)
侵袭转移是肝癌的基本特征,也是影响肝癌治疗效果的关键因素。肝细胞癌(hepatocellular carcinoma,HCC)患者存活率非常低,只有9%患者在诊断后存活>5年[1]。苍耳亭(xanthatin)是20世纪60年代从苍耳(XanthiumstrumariumL.)中分离得到的一种天然倍半萜内酯化合物。研究表明,苍耳亭对肝癌、结肠癌、乳腺癌、肺癌、胃癌、宫颈癌和皮肤癌等具有显著的抗肿瘤活性[2-4]。苍耳亭对肝癌裸鼠有明显的抑制肿瘤作用,并且抑制上皮-间质转化来阻碍肿瘤发展[5-6]。转录因子Sal样蛋白4(Sal-like protein-4 ,SALL4)在调控miR-146a-5p进而影响HCC外泌体和M2极化中起到至关重要的作用[7]。肝癌细胞分泌的外泌体miR-103通过靶向多种内皮连接蛋白增加血管通透性并促进肿瘤转移[8]。
外泌体是直径30~150 nm的囊泡,由内吞过程产生,并由多囊体(MVBs)与质膜融合分泌。几乎所有类型的细胞在生理和病理条件下都会释放外泌体。外泌体是肿瘤细胞与其微环境相互作用的重要载体,它携带多种生物活性物质,包括mRNA、miRNA、蛋白质等。肿瘤外泌体可以相互作用,被癌细胞本身或存在于肿瘤微环境或远离肿瘤部位的其他细胞所吸收,产生不同的作用[9]。MicroRNAs (miRNAs)越来越被认为是代谢、癌症、程序性细胞死亡或细胞分化等的可行治疗靶点。苍耳亭抗肿瘤是否与肿瘤外泌体有关笔者尚未见报道,在本研究通过高通量miRNAs测序,筛选苍耳亭与MHCC97H共培养过程中差异miRNAs,并对其进行验证,希望为寻找治疗肝癌靶点提供有价值的线索。
1 材料与方法
1.1药物与试药 苍耳亭由南京中医药大学李伟东教授实验室提供,经过磁共振及X射线单晶衍射证实是化合物苍耳亭,其纯度达98%。人高转移性肝癌细胞系MHCC97H购于武汉大学。达尔伯克改良伊格尔培养基(DMEM,Sigma-Aldrich,批号:D5796) ;胎牛血清(fetal bovine serum,FBS,BI公司,批号:04-001-1ACS) ;青霉素G 钠盐(Sigma-Aldrich 公司,批号:69-57-8) ;硫酸链霉素盐 (AMRESCO 公司,批号:2018382 );二甲亚砜(DMSO,Solarbio公司,批号:D8370)。
1.2仪器 二氧化碳(CO2)培养箱(Thermo Scientific,型号:3131);超净工作台(ESCO Class ⅡBSC,型号:ESCOAC2);倒置荧光显微镜(德国ZEISS公司,型号:Vert.A1);电子分析天平(赛多利斯科学仪器有限公司,型号:BSA224S-CW);测序分析仪 4000(美国Illumina公司)。
1.3外泌体的提取和测定 细胞MHCC97H培养于含5% FBS、100 U·mL-1青霉素、100 g·mL-1链霉素的DMEM中,在相对湿度5%的CO2培养箱中培养。在所有实验中,苍耳亭均溶解于DMSO中,终浓度5 μmol·L-1。5 μmol·L-1苍耳亭处理细胞24 h。实验分为对照组即未共培养的MHCC97H细胞组(含0.5% DMSO)和苍耳亭与MHCC97共培养细胞组。采用差速离心(4 ℃下,500×g离心5 min,200×g离心30 min,10 000×g离心60 min)收集上清液。用孔径0.22 μm无菌过滤器滤过后,加入超高速离心管中,以4 ℃,120 000×g离心70 min,弃去上清液。最后,根据沉淀量,加入200~400 μL预冷无菌PBS重悬悬液,为高纯度EVs。
1.4外泌体的鉴定
1.4.1透射电镜鉴定外泌体 用PBS 1 mL清洗EVs 3次。加入2%锇酸溶液0.5 mL,4 ℃固定2 h后冲洗。分别用50%、70%、80%、90%乙醇1 mL,梯度脱水15 min。然后用100%乙醇1 mL脱水2次,每次20 min。用丙酮1 mL置换2次,每次15 min。然后对其进行浸渍、封装和聚合。清洗过程依次进行乙酸二氧铀染色和乙酸铅染色10 min。最后,使用Malvern NanoSight系统检测外泌体的颗粒大小。
1.4.2Western blotting鉴定外泌体 细胞用预冷的PBS洗涤,在RIPA缓冲液中溶解,RIPA缓冲液中添加1 mmol·L-1PMSF和蛋白酶抑制剂混合物(Bestbio),稀释1:100。采用BCA蛋白测定试剂盒(Pierce)测定蛋白浓度。等量的蛋白样品(20 μg)通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)。
分离,转移到聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜。将膜在TBST的脱脂干奶中封闭2 h,在≤4 ℃抗体孵育过夜:CD9(1:1000)、 HSP70(1:1000)、β-catenin(1:5000)。另一种膜不加抗体TBST溶液孵育作为阴性对照。反复洗涤后,将膜与二抗结合。用TBST再次冲洗膜3次,并使用增强的化学发光衬底。使用图像分析软件测量各波段灰度值进行分析。
1.5外泌体的miRNA的分析与验证 外泌体的miRNA的测序借助研载生物技术(上海)有限公司平台完成。用TRIzol试剂提取总RNA,用聚丙烯酰胺凝胶电泳富集18 ~ 30 nt的RNA分子。然后,富集36~44 nt RNAs,用PCR提取试剂盒纯化cDNA片段,形成cDNA文库。结扎产物经琼脂糖凝胶电泳筛选,PCR扩增,文库借助上海研载生物技术有限公司的HiSeq 4000 (Illumina)机器进行深度测序。差异miRNAs筛选条件为|log2FoldChange|≥0.58和P<0.05。差异miRNAs的潜在靶基因由miRNA DA预测,并基于数据库(DAVID)、GO网站 (http://www.geneontology.org/)和KEGG网站(http://www.genome.jp/kegg/)。利用热图对归一化聚类数据进行转换,绘制热图。
1.6采用实时荧光定量PCR(qRT-PCR)进行差异miRNAs验证 分别从MHCC97H细胞组和苍耳亭共培养的MHCC97H细胞组中提取外泌体的总RNA,使用PrimeScript RT试剂盒(TAKARA)进行逆转录,采用Roche LightCycler 480 II PCR体系与SYBR Green(TAKARA)进行qRT-PCR。U6和ccel-miR-39分别作为miRNAs的内参和外参。
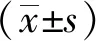
2 结果
2.1外泌体的确证 MHCC97H组和苍耳亭+MHCC97H组肿瘤外泌体粒径分别为(145.5±40.8)和(147.2±41.1)nm。透射电镜观察显示外泌体呈杯状结构,直径在正常范围内。Western blotting实验显示CD9和HSP70表达呈阳性,进一步证实纯化后的囊泡为外泌体(图1)。

A.外泌体颗粒尺寸大小;B.透射电镜观察外泌体形态;C.免疫印迹法检测外泌体的阳性生物标志物CD9和HSP70。
2.2外泌体miRNA谱分析 测序结果显示,共鉴定出已知miRNAs497个,未被命名的miRNAs 510个。基因组比对率75.21%~81.78%,已知miRNA比对率0.59%~0.65%。与对照组比较,苍耳亭处理的MHCC97H细胞中共鉴定出78个差异miRNAs,其中36个上调miRNA,42个下调miRNA(图2)。热图显示,这些差异miRNAs能够区分苍耳亭共培养的MHCC97H细胞组和MHCC97H细胞组(图3)。
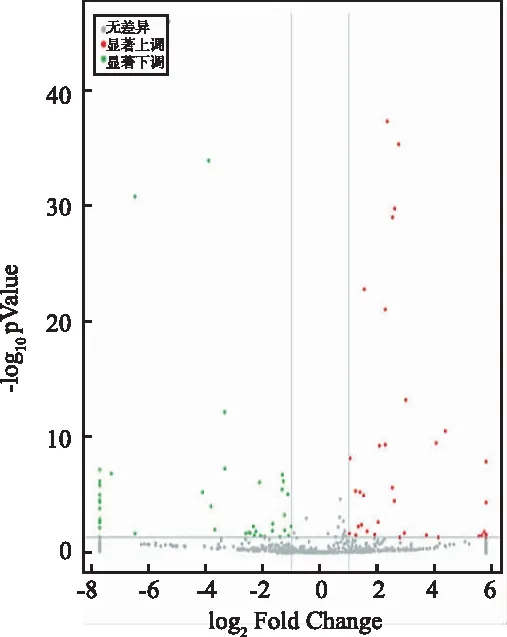
图2 苍耳亭处理MHCC97H细胞后miRNA表达谱火山图
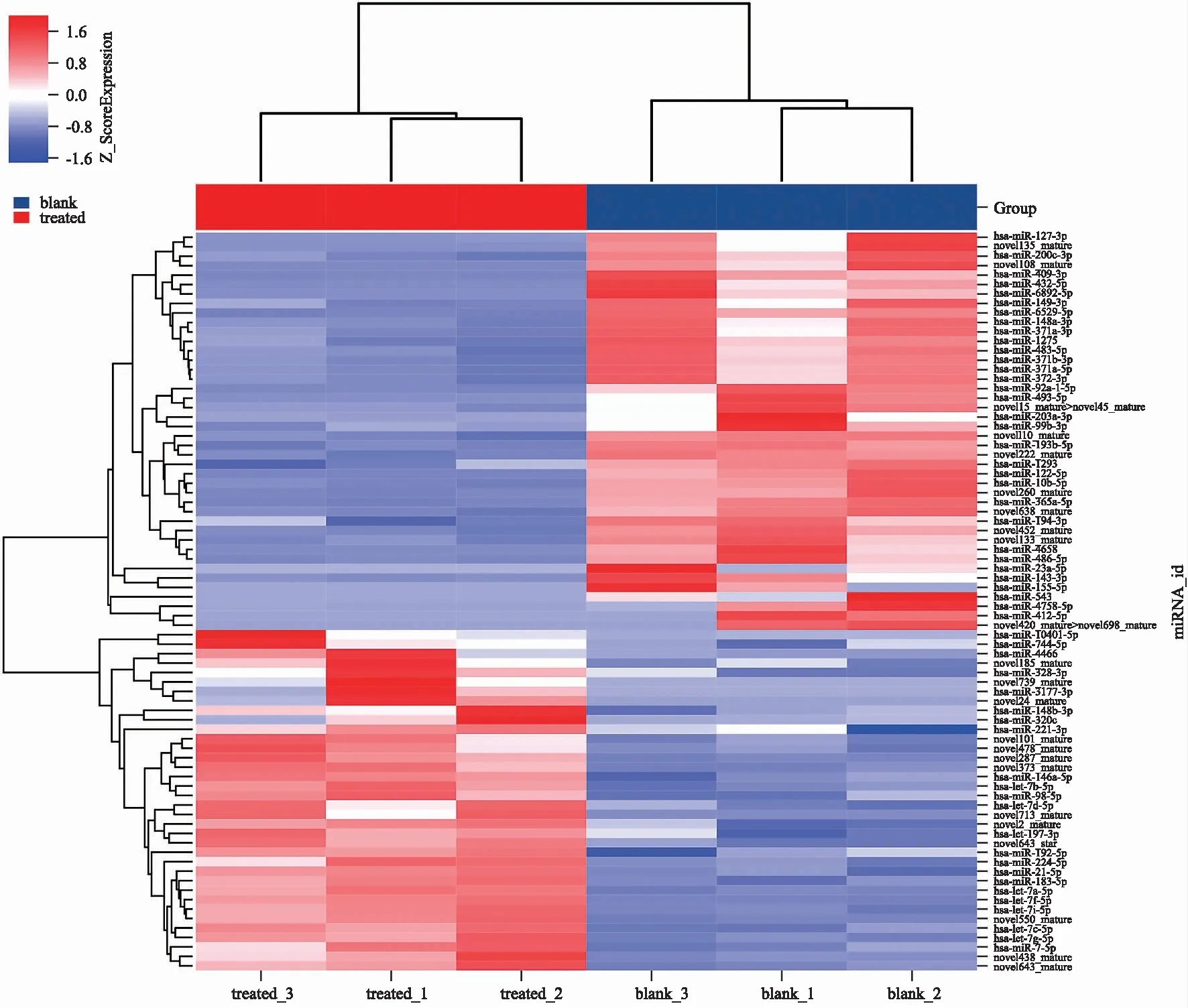
红色表示高表达;蓝色表示低表达。
2.3外泌体miRNA功能分析 对差异miRNAs的靶基因进行预测,将其映射到GO数据库中,并进行比较(图4A)。GO数据库主要从“生物过程”“细胞组成”和“分子功能”三方面进行了分析。“生物过程”方面,基因主要与“细胞过程”“代谢过程”和“单一的生物过程”有关。“细胞过程”方面,基因主要与“细胞成分”和“细胞器组成”有关。“分子功能”方面,基因主要与“结合”和“催化活性”有关(图4B)。
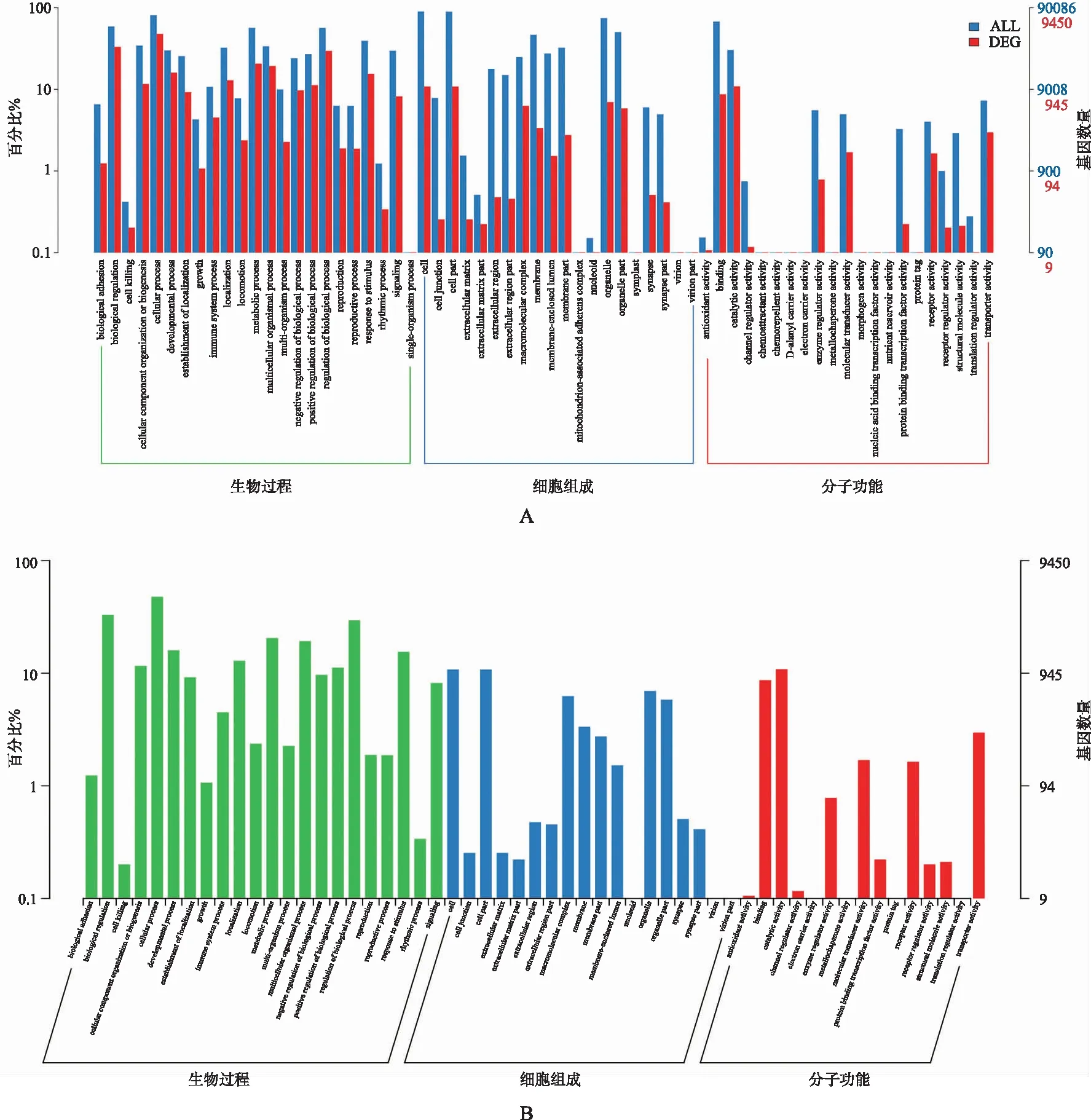
图4 差异miRNA靶基因和所有GO基因的分布情况
2.4KEGG信号通路富集分析 KEGG对差异miRNAs靶基因的功能进行分类,富集出前20条作用的信号通路(图5A-B)。结果显示前20条通路,包括“癌症通路”“钙离子信号通路”“PI3K-Akt信号通路”“黏连信号通路”。根据miRNA测序结果,发现510个未被命名的miRNA,其中对照组发现287个未命名miRNA,苍耳亭治疗组发现354个未命名miRNA。KEGG富集分析显示,差异miRNAs的靶基因主要集中在“钙离子信号通路”“PI3K-Akt信号通路”“Ras信号通路”“cAMP信号通路”和“癌症通路”(图5C)。

A.KEGG分析miRNA靶基因的分布图;B.KEGG分析差异miRNA靶基因分布图;C.KEGG富集分析差异miRNA的TOP20信号通路图;P值越小,颜色越倾向于红色,点越大,表示通路中的基因越多;D.qRT-PCR验证差异miRNA表达水平;①与对照组比较,P<0.05;②与对照组比较,P<0.01。
2.5qRT-PCR验证差异miRNA 采用qRT-PCR共验证7个差异miRNA,结果显示,苍耳亭与MHCC97共培养后,外泌体的let-7f-5p、miR-192-5p、miR-197-3p和let-7b-5p表达上调,与对照组比较差异有统计学意义(P<0.05)(图5D),且与外泌体miRNA谱分析结果相一致。miR-21-5p、miR-483-5p、miR-372-3p的表达水平与对照组比较差异无统计学意义。
3 讨论
目前肝癌是一种难以治愈的疾病。除早期手术切除和肝移植外,尚无有效的治疗方法。外泌体由多种细胞分泌,包括肿瘤细胞。研究表明肿瘤细胞可以分泌比正常细胞更多的外泌体,外泌体中的miRNAs是参与基因表达转录后调控的小型非编码RNAs,可以作为致癌基因或肿瘤抑制因子[10-11]。因此,外泌体中miRNAs不仅与疾病的发生发展机制相关,还可能成为较好的肿瘤早期诊断的生物标志物[12]。研究表明,miRNA在HCC细胞和组织中异常表达与疾病的发生、发展和预后密切相关[13]。除miRNAs外,外泌体还通过靶向不同的物质(如DNAs、RNAs和蛋白质)参与HCC发病机制。
苍耳亭具有抗肿瘤药效,能显著改变肿瘤细胞的外泌体miRNA。苍耳亭是从苍耳草中提取分离的天然倍半萜内酯,具有显著的抗肿瘤活性。研究表明,苍耳亭对人肝癌细胞生长的体外和体内影响,其抑瘤率高达45%。苍耳亭通过调控Wnt/β-catenin 和EMT相关蛋白,从而抑制肿瘤侵袭转移[5]。α-亚甲基-γ-丁内酯基团为苍耳亭活性基团结构。它优先与JAK2的Cys243、IKK β的Cys412和Cys464相互作用,它们分别是STAT3和NF-κB信号通路的关键调控因子[14]。因此,苍耳亭优先抑制激活STAT3和p65的癌细胞株的生长。本研究结果与其研究一致,即苍耳亭作用于肿瘤细胞的外泌体改变了肿瘤细胞的miRNA,这些改变的miRNA作用的信号通路丰富,包括STAT3和NF-κB信号通路。苍耳亭对人LO2肝细胞无明显凋亡作用[15]。进一步研究苍耳亭的抗肿瘤机制对该药物的开发利用具有深远的意义。笔者收集MHCC97H细胞上清液和苍耳亭共培养过MHCC97H细胞上清液,提取外泌体,通过透射电镜和Western blotting对外泌体进行鉴定,确认提取的外泌体质量。对外泌体miRNAs进行高通量测序,筛选出苍耳亭共培养MHCC97H细胞中的差异表达的miRNAs。其中,42个下调miRNAs,36个上调miRNAs。
苍耳亭可能通过上调let-7f-5p、let-7b-5p、miR-192-5p和miR-197-3p的表达发挥治疗作用。荧光定量PCR结果显示,苍耳亭共培养后let-7f-5p表达上调,且与对照组比较差异有统计学意义。许多研究表明,抑癌miRNA let-7家族成员在HCC中的表达下调,抑癌miRNA let-7家族成员在HCC中的表达下调,提示let-7可能作为致癌基因参与这一过程[16-18],Let-7b可能通过上调p21抑制HCC细胞的增殖。下调血清let-7-a1基因表达可能对埃及慢性HCV患者肝癌的发生有显著影响[19]。let-7f-5p在头颈部癌、转移性非小细胞肺癌中的表达下调[17,20]。苍耳亭与MHCC97H细胞共培养后外泌体let-7f-5p表达上调,推测苍耳亭可能通过调控let-7f-5p对HCC产生治疗作用。Let-7b-5p可抑制肝癌细胞中G2/M的转化。它还能诱导肝癌细胞凋亡,同时抑制细胞增殖、转移和EMT进展[21]。此外,已有研究报道miR-192-5p、miR-197-3p和let-7b-5p在HCC中水平较低,并能抑制HCC的生长和转移[22-23]。miR-192-5p作为TRIP13的上游调控因子,通过与ACTN4相互作用,AKT/mTOR信号通路诱导肝癌细胞迁移、侵袭和转移[24]。miR-197-3p可能通过部分下调ZIK1来调控HCC细胞的生存[25]。苍耳亭处理的MHCC97H细胞中let-7f-5p、let-7b-5p、miR-192-5p和miR-197-3p表达上调,推测苍耳亭可能通过调控let-7f-5p、let-7b-5p、miR-192-5p和miR-197-3p对HCC产生治疗作用。miRNA测序结果上传至GEO官方网站(GSE172654)。

